摘要
黑色素瘤約只佔皮膚癌的5%左右,但卻是皮膚癌症中死亡率最高的癌別。當黑色素瘤轉移後的存活率會大幅降低至不到2成,是目前治療上需要面對的挑戰。近年來對黑色素瘤免疫生物學的了解,加速了新一代藥物的興起。這些新的藥物主要作用在黑色素細胞中的 MAPK (mitogen activated protein kinase) 路徑,以及作用在T細胞上可以活化T細胞免疫能力的蛋白質;這些藥物在反應率及整體存活率上得到了較佳的改善,可說是開啟了轉移性黑色素瘤治療的新頁。
關鍵字: 轉移性黑色素瘤、分子標靶治療、免疫治療、BRAF、CTLA-4、PD-1
壹、黑色素瘤治療的現況與發展
黑色素瘤約只佔皮膚癌的5%左右,但卻是皮膚癌症中死亡率最高的癌別1。黑色素瘤的5年整體存活率約為91%,但若已發生轉移則會大幅降低至16%左右2。黑色素瘤的治療依據疾病的期別不同而有差異,對於第 IV 期已轉移的黑色素瘤患者,傳統上使用 dacarbazine (DTIC) 及 temozolomide 等傳統化療藥物單一或複數組合的治療反應並不佳,在存活率的改善上亦沒有幫助3。其他如 Interleukin-2 (IL-2) 及干擾素在反應率及存活率上也不好,產生的毒性也不低。在傳統的治療方式下,轉移性黑色素瘤患者的平均存活率只有6-8個月左右4。
近年來對黑色素瘤免疫生物學的了解,加速了新一代藥物的發展 (圖一),這藥物主要作用在影響黑色素細胞活化的絲裂原活化蛋白激酶 (mitogen-activated protein kinase, MAPK) 路徑,以及調節T細胞活化的蛋白質,在反應率及整體存活率上獲得較佳的改善,可說是開啟了轉移性黑色素瘤治療的新頁。
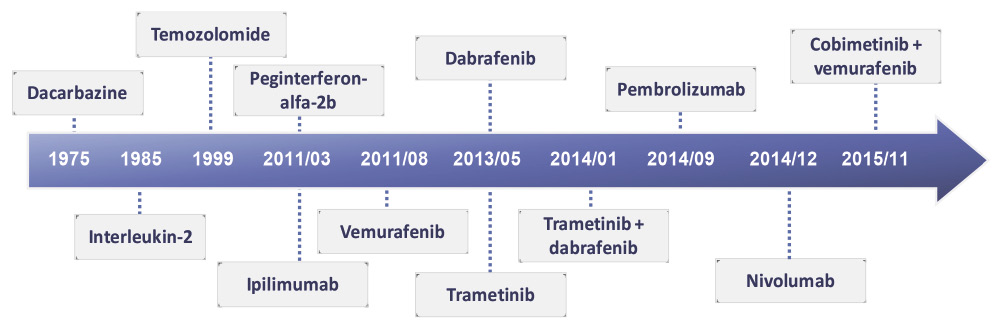
圖一 黑色素瘤治療藥物的核准歷程
貳、 分子標靶治療 (Molecular Targeted Therapy)
一、分子標靶藥物的作用機轉
黑色素細胞中的 MAPK 是黑色素瘤生長、分化及存活等訊息傳遞最重要的路徑之一,當此路徑的 RAS 激酶被活化時,會將活化訊息傳遞至下游如 MEK、ERK 等激酶,進而影響黑色素細胞的增生與分化 (圖二)5。當此過程有異常的基因突變時會造成 MAPK 路徑活化,導致細胞不正常的增生,因此對抗這些不正常活化的突變基因調控即成為此類藥物作用的標的4。
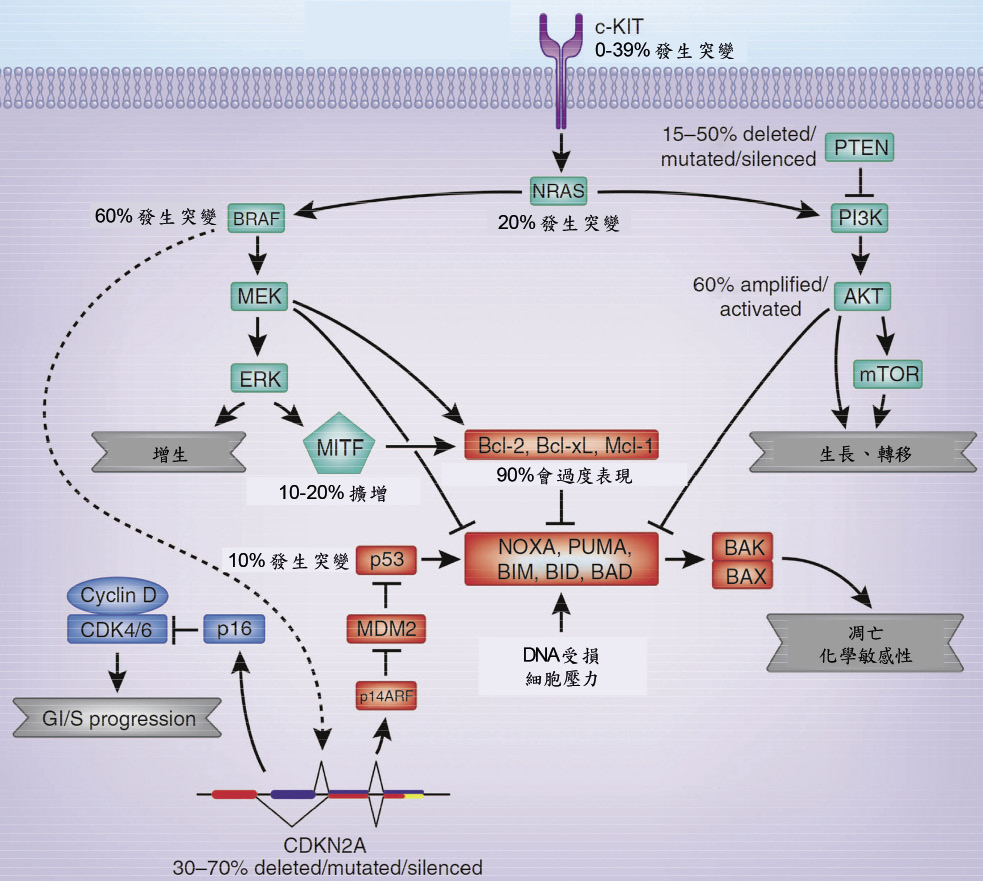
圖二 黑色素瘤細胞分子訊息傳遞路徑5
二、BRAF 抑制劑
BRAF 激酶是黑色素瘤最常突變的基因,突變的 BRAF 會活化下游的 ERK 活性,後續藉由啟動細胞週期與抑制細胞凋亡而促使腫瘤生成。在 BRAF 突變的型態中,約有80-90%為 V600E 的突變,其它的突變型態則還有 V600K 及 V600R1。約有60%惡性黑色素瘤的患者會產生 BRAF 突變,特別容易發生在年輕人及與漸歇性陽光接觸有關的患者上,BRAF 發生突變的位置及頻率與年齡呈現反向的關聯性;另外在這些突變的患者中,發現年齡較大的患者在 V600K 發生突變的比例較高3,6。BRAF 抑制劑即是針對這些特定 BRAF 突變激脢作用的選擇性抑制劑。
(一)Vemurafenib
Vemurafenib 是2011年8月由美國 FDA 核准的第一個 BRAF 抑制劑。在第 IIIC 或第 IV 期有 BRAF V600突變、無法以手術切除且未曾治療過的黑色素瘤患者上,vemurafenib 與 DTIC 相較,兩者的整體存活期 (overall survival, OS) 中位數為13.2個月及9.6個月,6個月的整體存活率為84%及64%;而 vemurafenib 的整體反應率 (overall response rate, ORR) 中位數及無惡化存活期 (progression free survival, PFS) 為48%及5.3個月,DTIC 則為5%及1.6個月。至於在副作用方面,vemurafenib 最常發生的有關節痛、紅疹、光敏感性皮膚反應、疲倦、噁心,以及掉髮、搔癢、表皮角化症、腹瀉、頭痛及嘔吐2。
(二)Dabrafenib
Dabrafenib 是另一個美國 FDA 在2013年5月核准的 RAF 抑制劑。對於無法以手術切除且 BRAF V600E 突變的第3-4期黑色素瘤患者,dabrafenib 不論在 ORR (50% vs 6%)、PFS 中位數 (5.1個月vs 2.7個月;hazard ratio (HR) = 0.30; P < 0.0001) 及 OS (HR = 0.61) 上都較 DTIC 來的佳;在 dabrafenib 的組別中,有31%因為副作用而須停止或降低治療的劑量;其中常見的毒性有皮膚毒性、發熱、疲倦、頭痛及關節痛。若與 vemurafenib 相較,dabrafenib 在光毒性、皮膚鱗狀上皮細胞癌及角質棘皮瘤的發生率上似乎較低,但發熱 (pyrexia) 發生率則較 vemurafenib 高3。
雖然 BRAF 抑制劑的反應率接近五成,但中位反應期卻不到1年,此外約有15%的患者對 BRAF 抑制劑完全沒有反應;且多數有反應的患者在數月後有抗藥性的產生,最後導致疾病的惡化,推測可能與非 BRAF 引起的 MAPK 路徑活化有關,可說是這類藥物目前使用上的侷限7,8。
三、MEK 抑制劑
MEK 是 MAPK 路徑中 BRAF 的下游調節因子,因此也成為抑制 BRAF 突變黑色素腫瘤細胞藥物的作用標的。
(一)Trametinib
Trametinib 是具高度選擇性的 MEK1及 MEK2抑制劑,與 DTIC 或 paclitaxel 相較,trametinib 在 BRAF V600E 或 V600K 突變且無法手術切除或轉移性的黑色素瘤患者上,不論是 ORR (22% vs 8%)、PFS 中位數 (4.8個月 vs 1.5個月;HR = 0.45; P < 0.001) 或6個月 OS (81% vs 67%; HR = 0.54; 95% CI, 0.32-0.92, P = 0.01) 上都較佳4,因此美國 FDA 於2013年5月亦核准了 trametinib 的上市。Trametinib 最常見的副作用為紅疹、腹瀉及周邊水腫,另外有9%的患者出現眼部症狀,7%的患者出現心臟射出分率降低的情形。與 BRAF 抑制劑不同的是,trametinib 治療的患者並沒有出現繼發性皮膚腫瘤的情況。至於因為副作用而需要中斷或降低劑量的比率則為35%及27%3。
(二)Cobimetinib
Cobimetinib 是美國 FDA 於2015年11月核准的第二個選擇性的非競爭性 MEK1/2抑制劑。與單用 vemurafenib 相較,cobimetinib 合併 vemurafenib 的組別在 PFS 較佳 (9.9個月vs 6.2個月),死亡或疾病惡化的危險比 (HR) 為0.51(95% CI, 0.39-0.68; p < 0.001),合併治療的9個月 OS 也較高 (81% vs 73%)2。特別的是,對 MEK 抑制劑產生抗藥性的 BRAF 突變轉移性黑色素瘤患者,仍會對 BRAF 抑制劑有反應;但若是對 BRAF 抑制劑產生抗藥性,對 MEK 抑制劑的治療則沒有反應8。
參、免疫治療 (Immunotherapy)
一、免疫查核點抑制劑的作用機轉
Cytotoxic T lymphocyte antigen-4 (CTLA-4) 及 Programmed cell death protein-1(PD-1) 是人體內為了避免T細胞過度活化的一種負向調節機制,一般稱為“免疫查核點 (immune checkpoint)”,可以對T細胞的活化產生“煞車”的作用,避免組織受到過度的自體免疫傷害9,10。對腫瘤細胞而言,可藉此機制引起免疫抑制而使腫瘤不被免疫系統清除。此類免疫查核點抑制劑即是阻斷 CTLA-4及 PD-1的作用,恢復T細胞活化以加強抗腫瘤的免疫反應,可說是開啟了癌症免疫治療的新一波革命。
CTLA-4是表現在活化T細胞上的抑制性接受體,主要作用在免疫反應前段的促發期(priming phase)11;當T細胞活化後的24-48小時,CTLA-4會大量表現並競爭性結合至樹突細胞的 B7上,並且傳遞抑制性的訊號至T細胞,降低T細胞的活化反應 (圖三) 9-11。
PD-1主要作用於在周邊組織中免疫反應後段的作用期 (effector phase),與 CTLA-4只表現在T細胞不同,PD-1會在如T細胞、B細胞、自然殺手細胞及單核球這些成熟造血細胞 (Hematopoietic cells) 長時間接觸抗原而活化後表現7。當 PD-1與其配體 PD-L1或 PD-L2結合時,會抑制T細胞增殖與細胞激素釋放 (cytokine release) 等作用,進而抑制免疫反應 (圖三)11,12;相較於阻斷 CTLA-4對T細胞的全面活化,阻斷 PD-1路徑則可以選擇性的調節免疫反應。
當腫瘤細胞浸潤免疫細胞時,腫瘤細胞會不正常的表現 PD-L1,進而抑制T細胞的活性,使免疫系統對腫瘤細胞無法辨識與攻擊。PD-L1的表現會因腫瘤類別的不同而有差異,但似乎在黑色素瘤、非小細胞肺癌及卵巢癌與腎臟癌上特別明顯11。
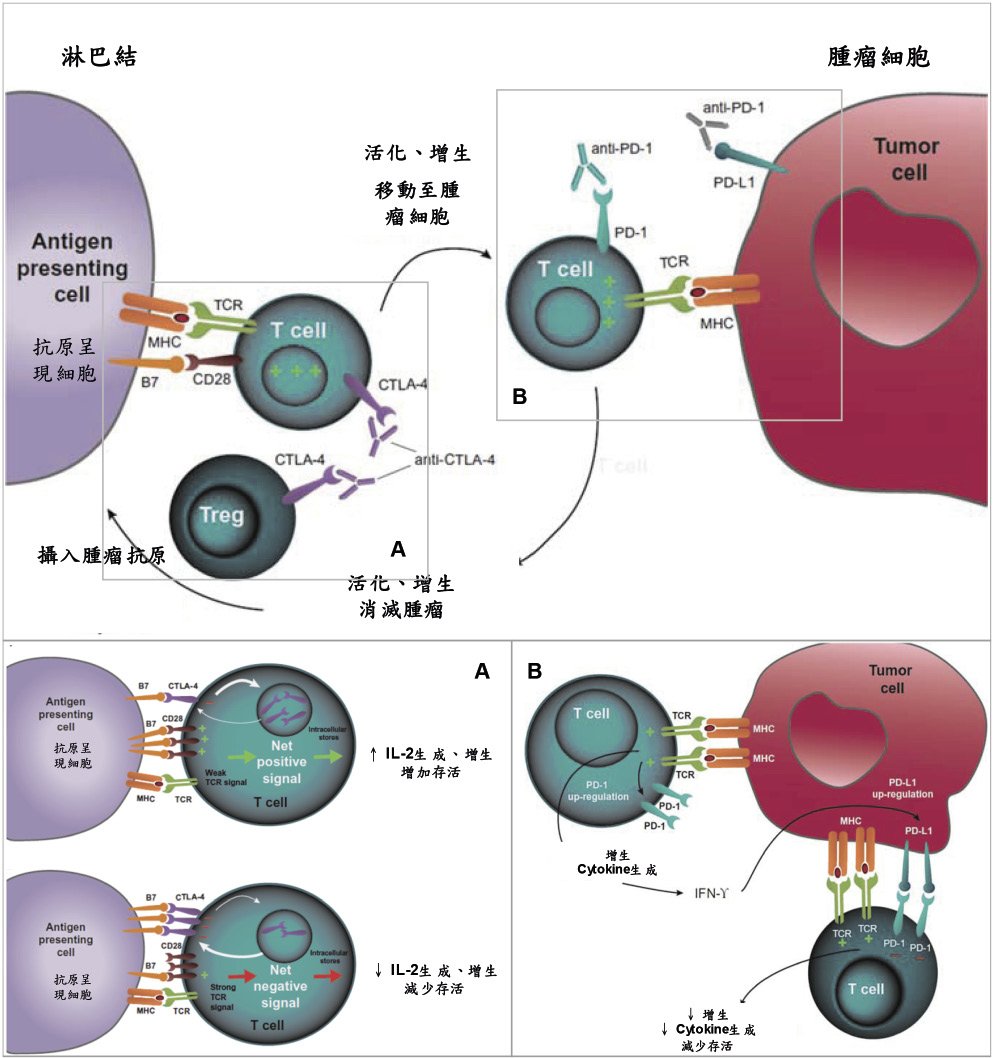
圖三 免疫查核點阻斷劑的作用位置與機轉11
二、CTLA-4抑制劑
(一)Ipilimumab
Ipilimumab 是2011年3月美國 FDA 核准,可抑制 CTLA-4蛋白的人類 IgG1 單株抗體,與 gp100疫苗相較,可以明顯增加患者的 OS 中位數 (10個月vs 6.4個月)2,另外在未曾治療過的第3-4期轉移性黑色素瘤患者上,ipilimumab 合併 DTIC 治療的組別在1年 (47.3% vs 36.3%)、2年 (28.5% vs 17.9%) 及3年 (20.8% vs 12.2%) 的存活率上也都較 DTIC 高10。
雖然約有20%使用 ipilimumab 的患者可呈現長時間的存活期,少數患者甚至可以達10年。但部分患者對 ipilimumab 只呈現暫時甚至沒反應,且只有約10%患者能達到完全反應 (complete response);此外與傳統化療不同的是,ipilimumab 在治療初期會使腫瘤負擔 (tumor burden) 增加,之後才呈現緩慢及平穩的下降,這種延遲性反應對於高腫瘤負擔患者也是治療上的另一項挑戰10。
三、PD-1阻斷劑
(一)Pembrolizumab
Pembrolizumab 是一種擬人化 IgG4單株抗體,是美國 FDA 在2014年9月核准的第一個 PD-1阻斷劑。在以 BRAF 抑制劑治療無效的轉移性黑色素瘤患者上,pembrolizumab 的 ORR 為26%,PFS 在第24週為45%,1年存活率為58%;多數有反應的患者 (88%) 在研究進行分析時仍存活且無疾病惡化,並且持續至少6個月3,6。另外若與 ipilimumab 相較,pembrolizumab 在6個月的 PFS (47.3% vs 26.5%) 及1年存活率 (74.1% vs 58.2%) 都較 ipilimumab 來的好,嚴重副作用的發生率也較低 (13.3% vs 19.9%)10,13。
(二)Nivolumab
Nivolumab 是美國 FDA 在2014年12月核准的另一個 PD-1阻斷劑,也是一種擬人化的 IgG4單株抗體。在 ipilimumab 治療無效的患者上,nivolumab 的客觀反應率較化療藥物為佳 (31.7% vs 10.6%),3-4級副作用發生率也較低 (5% vs 9%)。另 nivolumab 若與 DTIC 相較,兩者在1年存活率為72.9%及42.1%,PFS 中位數分別為5.1個月及2.2個月;另外 ORR 則為40%及13.9%2。另外不論是否曾以 ipilimumab 治療,都不會影響 nivolumab 的效果4。
美國國家癌症資訊網 (NCCN) 在2017年第1版黑色素瘤指引中,已將免疫查核點抑制劑作為轉移性或無法切除黑色素瘤第一線治療的證據等級由 category 2A全部提高至 category 1;而若患者有 BRAF V600突變且臨床上有立即療效的需求,一樣可選擇 BRAF 合併 MEK 抑制劑作為第一線治療。此外,除非患者不適用免疫查核點抑制劑,且對 BRAF 合併 MEK 抑制劑的治療有使用禁忌,否則 BRAF 抑制劑的單獨治療已不在第一線的藥物選擇建議中14。
肆、免疫治療的療效評估與生物標記
一、免疫治療的療效評估
腫瘤的治療傳統上會以療效評價標準 (response evaluation criteria in solid tumors, RECIST) 來評估成效,但由於免疫治療引起的腫瘤體積消退與傳統化療藥物不同,除了在時間上可能延遲外,甚至在消退前會出現明顯的腫瘤成長,若以 RECIST 進行療效的評估,可能會出現腫瘤惡化的評估結果;因此臨床上衍生了所謂的免疫相關反應評估標準 (immune-related response criteria, irRC),可於判斷免疫治療成功與否前,在腫瘤體積變化的評估上更有彈性。不過因為免疫查核點抑制劑的效果在多數的研究中仍是以 RECIST 來評估,irRC 最終是否可以成為免疫查核點抑制劑的療效評估工具,仍需要許多的研究結果來確認 (表一)15。
表一 RECIST 與 irRC 的差異15

二、免疫治療的生物標記
免疫查核點抑制劑的療效雖然讓人驚艷,但由於只有部分的患者對 PD-1抑制劑有反應,如何篩選合適的患者仍是一大挑戰。一般認為在T細胞與腫瘤間最終的免疫反應步驟是 PD-1/PD-L1阻斷劑最重要的作用位置,因此多數針對免疫治療生物標記的研究,都會著重在腫瘤微環境中特別是 PD-1及 PD-L1的免疫表現。雖然在腫瘤出現有 PD-L1表現的患者,似乎在 PD-1阻斷劑的反應率上優於沒有表現 PD-L1的患者;然而,在腫瘤沒有表現 PD-L1的患者上,卻仍然有部分對 PD-1阻斷劑有優異的反應。此外,PD-L1在腫瘤內可被誘發,而且可以受到浸潤的免疫細胞及基因的改變而產生正調節,因此在對於 PD-L1有更進一步的了解前,是否可以使用 PD-L1或其他標記作為篩選 PD-1阻斷劑治療的生物標記仍未有定論15。
伍、藥物的合併治療
一、BRAF 及 MEK 抑制劑的合併治療
由於 BRAF 及 MEK 抑制劑合併治療的效果較單用 BRAF 抑制劑來的佳,因此 BRAF 合併 MEK 抑制劑已被核准於治療 BRAF V600突變的轉移性黑色素瘤患者3。雖然合併治療可以改善反應率及無惡化存活期,但是有研究認為長期而言也有產生抗藥性的疑慮。此外,若對 BRAF 抑制劑已經有抗藥性,合併治療的效果似乎仍有限,安全性上的數據也較另人擔心,都是併用時需要留意的問題8。
二、CTLA-4及 PD-1阻斷劑的合併治療
與 ipilimumab 單獨治療相較,ipilimumab 合併 nivolumab 的治療有53%的患者出現幾近完全緩解 (complete response) 的驚人效果,在 OS 及客觀反應率上也較優異。然而,由於發生第3級以上副作用的比率偏高 (53% vs 21%),因此即便這種組合的臨床效益讓人振奮,但其高副作用發生率也是治療前須考量的因素3,4。
陸、結論
雖然免疫查核點抑制劑及 MAPK 標靶療法的成效,開啟了轉移性黑色素瘤治療的新頁;然而,BRAF 抑制劑抗藥性,以及免疫查核點抑制劑的反應率不高…等問題,都是新一代藥物在治療上仍不盡理想的地方。其他像是何謂最佳的藥物使用順序、最合適的療效評估工具,或是有無可用來預測療效的生物標記…等亦是未來尚待釐清的問題。
Novel Approaches in the Management of Advanced Melanoma
Yu-Wei Hsu
Department of Pharmacy, Ditmanson Medical Foundation Chia-Yi Christian Hospital
Abstract
Advanced melanoma account for only 2-5% of dermatologic cancers, but it’s the major cause of death in skin cancer. The survival rate radically declines to less than 20% in advanced or metastatic cases, and it’s always been a great challenge to clinicians. The findings in the immunobiology of melanoma in the last few years facilitate a rapid emergence of novel therapies. These new drugs mainly act on MAPK (mitogen activated protein kinase) pathway in melanoma cells, and activate T cell immunocompetent proteins in T cells. Those provided response and survival improvement, and therefore entered a new era in the management of advanced melanoma.
參考資料:
1. Tan M, Quintal L: Pembrolizumab: a novel antiprogrammed death 1 (PD-1) monoclonal antibody for treatment of metastatic melanoma. J Clin Pharm Ther 2015; 40: 504-7.
2. Niezgoda A, Niezgoda P, Czajkowski R: Novel Approaches to Treatment of Advanced Melanoma: A Review on Targeted Therapy and Immunotherapy. Biomed Res Int. 2015, doi: 10.1155/2015/851387.
3. Bhatia S, Tykodi SS, Lee SM, et al: Systemic therapy of metastatic melanoma: on the road to cure. Oncology 2015; 29: 126-35.
4. John L, Cowey CL: The Rapid Emergence of Novel Therapeutics in Advanced Malignant Melanoma. Dermatol Ther 2015; 5: 151-69.
5. Hocker TL, Singh MK, Tsao H: Melanoma genetics and therapeutic approaches in the 21st century: moving fromthe benchside to the bedside. J Invest Dermatol 2008; 128: 2575-95.
6. Barnhart C: Pembrolizumab: First in Class for Treatment of Metastatic Melanoma. J Adv Pract Oncol 2015; 6: 234-8.
7. Improta G, Leone I, Donia M, et al: New developments in the management of advanced melanoma-role of pembrolizumab. OncoTargets and Therapy 2015; 8: 2535-43.
8. Dummer R, Schadendorf D, Ascierto PA, et al: Integrating first-line treatment options into clinical practice: what's new in advanced melanoma. Melanoma Res 2015; 25: 461-9.
9. Ott PA, Hodi FS, Robert C: CTLA-4 and PD-1/PD-L1 blockade: new immunotherapeutic modalities with durable clinical benefit in melanoma patients. Clin Cancer Res 2013; 19: 5300-9.
10. Zhu Z, Liu W, Gotlieb V: The rapidly evolving therapies for advanced melanoma-Towards immunotherapy, molecular targeted therapy, and beyond. Crit Rev Oncol Hematol 2016; 99: 91-9.
11. Buchbinder EI, Desai A: CTLA-4 and PD-1 Pathways: Similarities, Differences, and Implications of Their Inhibition. Am J Clin Oncol 2016; 39: 98-106.
12. Poole RM: Pembrolizumab: first global approval. Drugs 2014; 74: 1973-81.
13. Robert C, Schachter J, Long GV, et al: Pembrolizumab versus Ipilimumab in Advanced Melanoma. N Engl J Med 2015; 372: 2521-32.
14. Melanoma. NCCN Clinical Practice Guidelines in Oncology. Version 1. 2017.
15. Postow MA, Callahan MK, Wolchok JD: Immune Checkpoint Blockade in Cancer Therapy. J Clin Oncol 2015; 33: 1974-82.
通訊作者:許育瑋/通訊地址:嘉義市忠孝路539號
服務單位:嘉義基督教醫院藥劑科藥師/聯絡電話:(O) 05-2765041 ext 5107

