摘要
不當使用何首烏導致的藥物性肝損傷 (drug-induced liver injury) 在國際上逐漸受到重視,部分國家並規範含何首烏製劑或產品上需標註警語。文獻記載不良反應主要見於未經炮製的何首烏,何首烏毒性較製何首烏大,因此,中醫藥從業人員除應選購正確炮製之何首烏藥材,並應先行加強對於含何首烏之製劑或產品的警語標示與衛教,以避免藥物不良反應發生。
關鍵字: 何首烏、肝損傷、中藥炮製
壹、前言
何首烏屬台灣中藥典第二版收載之中藥材,其炮製品除用於中藥製劑外,亦常用於坊間食補藥膳調理包,然其並未正面表列於食品藥物管理署所公告之「可供食品使用原料彙整一覽表」中,亦非「可同時提供食品使用之中藥材」。筆者茲表列何首烏與製何首烏背景資料 (表一)。
表一 何首烏與製何首烏比較1-3


圖一 何首烏開花植株

圖二 新鮮何首烏
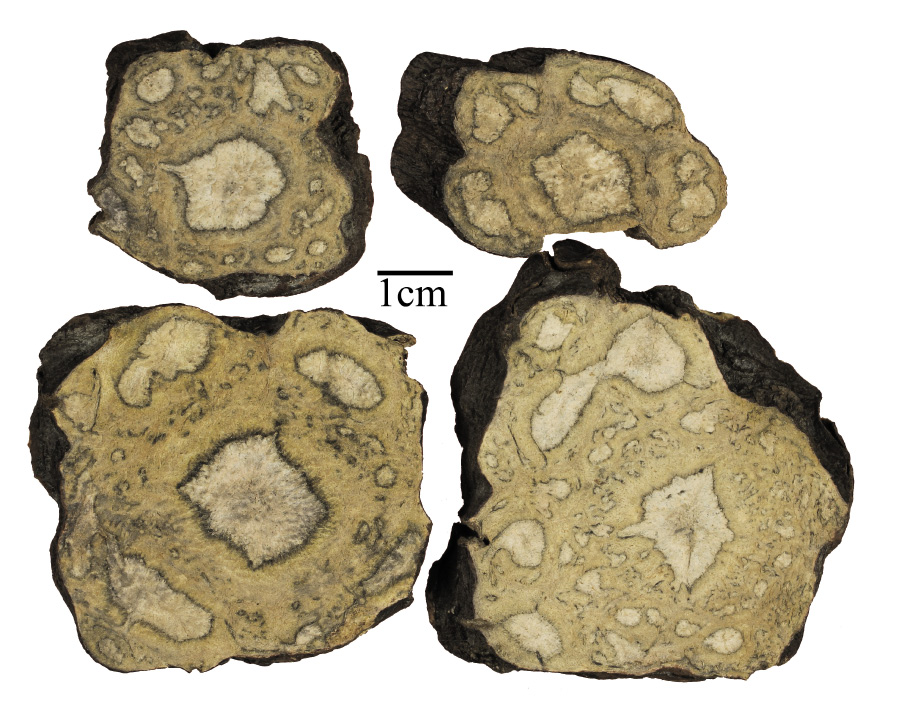
圖三 何首烏飲片

圖四 臺灣市售製何首烏飲片
貳、何首烏成分介紹
何首烏生品約含蒽醌衍生物1.1%,主要是大黃素 (emodin)、大黃酚 (chrysophanol),其次為大黃酸 (rhein)、大黃素甲醚 (physcion)、大黃酚蒽酮 (chrysophanol anthrone) 等,另一類主要成分為二苯乙烯苷 (stilbene glucoside) 類化合物,如含約2.7%之2,3,5,4'-四羥基二苯乙烯-2-O-β-D-葡萄糖苷 (2,3,5,4'-tetrahydroxystilbene-2-O-β-D-glucoside; THSG)4。炮製對何首烏成分變化,經高效液相層析儀 (HPLC) 分析得知,製何首烏所含之 THSG 降低了55.8%,而 emodin 上升了34.0%5。
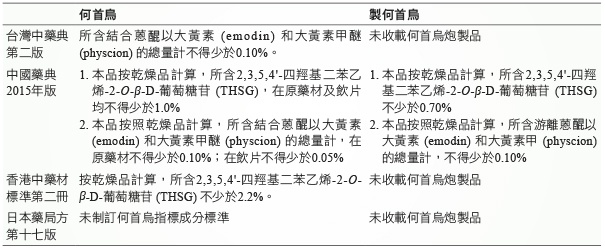
各國藥典對於何首烏之指標成分含量規範 (表二)。
表二 臺灣、中國、香港、日本之何首烏指標成分含量規範
參、何首烏致肝臟損傷成分探討
關於何首烏導致的藥物性肝損傷的成分為何,目前尚有爭議,有的文獻指向為蒽醌類衍生物 (anthraquinones),如大黃素 (emodin),有的則指向二苯乙烯苷類化合物 (stilbene glucosides)。然在正常大鼠及脂多醣 (lipopolysaccharide, LPS) 誘導特異質肝損傷 (idiosyncratic liver injury) 模型上發現,對於正常大鼠,單純給予何首烏50%乙醇萃取物之氯仿層 (此層主要成分為 anthraquinones,主要為 emodin-8-O-glucoside 及 emodin)、乙酸乙酯層 (此層主要成分為 THSG 和少量的 emodin-8-O-glucoside)、殘餘水層 (此層成分未見 anthraquinones 及 stilbenes) 並未導致血清中 ALT 及 AST 值的上升。然以不會誘使 ALT 及 AST 值上升的 LPS 劑量,當作大鼠發炎壓力 (inflammatory stress) 來源,以 LPS 誘導給予氯仿層、乙酸乙酯層、殘餘水層的組別,結果發現含有91% stilbenes (主要為 THSG) 成分的乙酸乙酯層會使 ALT 及 AST 值明顯上升 (p < 0.01),導致肝臟損傷。因此,乙酸乙酯層所含成分可能為何首烏導致特異性藥物肝臟損傷的主要因素6。此項實驗結果顯示,對於正常老鼠未產生肝臟損傷情形,然對於受到 LPS 致炎物質威脅的大鼠卻產生肝臟損傷,此實驗結果提供了臨床應用上一個探討點,正常人食用何首烏與患者 (可能為病理狀態或亞健康狀態) 使用何首烏,可能有不同的限制劑量。
傳統毒性評估方法結果顯示,何首烏須在臨床劑量的50-70倍劑量,且連續使用4-8週才會產生肝臟毒性。而在特異質肝損傷 (idiosyncratic liver injury) 模型上,對於普通正常大鼠,單次灌胃給藥超大劑量何首烏 (75.6 g/kg) 無明顯肝損傷作用;而在 LPS 特異質肝損傷模型上,給予相當於生何首烏每日6 g 之臨床2倍等效劑量 (1.08 g/kg) 即可造成實驗大鼠肝功能損傷7。以上實驗結果可供臨床上何首烏使用劑量及使用者之不同生理狀態參考。
肆、何首烏致肝損傷事件起源
1996年,香港一位31歲的懷孕婦女因使用何首烏製劑引起肝炎8。英國藥品和醫療產品管理中心 (Medicines and Healthcare products Regulatory Agency, MHRA) 在2006年4月其由警示計畫 (Yellow Card Scheme) 發佈7件何首烏相關的不良反應報告9。中國解放軍第三〇二醫院統計了從2009年1月到2014年1月曾服用何首烏而導致的藥物性肝損傷,共計158名患者。其中有66例為僅使用何首烏及其製劑而導致的藥物性肝損傷,佔該醫院那段時間內由中藥所導致肝損傷的10%以上10。
台灣中草藥不良反應通報中心曾於2012年接獲服用含何首烏科學濃縮中藥的不良反應通報案例,一名40歲女性經醫師處方服用科學濃縮中藥:七寶美髯丹、當歸飲子、何首烏、荊芥、防風、川牛膝、木香、砂仁,服用一段時間後,患者出現全身性黃疸,肝功能異常,肝功能檢查數值 AST 達944 U/L、ALT 達1650 U/L、ALK-P 達151 U/L 及 TBil 達8.9 mg/dL,經診斷為急性肝炎,經查所服中藥,其中七寶美髯丹、當歸飲子、何首烏三者皆含何首烏,因此何首烏被懷疑為導致急性肝炎的主因。此案例為臺灣所發生的何首烏致肝損傷的首宗疑似案例。
伍、何首烏致肝損傷中毒症狀
口服何首烏及其成方製劑可能有引起肝損傷的風險,但總體來看其所致肝損傷病例一般屬輕、中度,多呈可逆性。停藥、對症治療後,預後多較好11。文獻記載不良反應主要見於未經炮製的何首烏,何首烏毒性較製何首烏大。何首烏致肝損傷中毒症狀如下3:
一、毒性反應
(一)肝功能損害,表現為食慾減退、乏力或黃疸。(二)上消化道出血,表現為腹瀉及排糊狀黑便。(三)雙眼畏光,視疲勞,角膜內皮表面及晶體前囊表面彌漫細小棕色顆粒狀物沉著。(四)服用過量可引起興奮、煩躁、心動過速、抽搐、陣發性或強直性痙攣,嚴重者可因呼吸肌痙攣而死亡。
二、過敏反應
(一)皮疹:全身皮膚奇癢,出現紅色斑塊,抓破處色素沉著,並可伴有憋氣、心慌、上腹部隱痛、煩躁不安或呼吸急促等。(二)藥熱:高燒達39.5℃,大汗。
陸、各國何首烏製劑或產品規範
一、英國對於含何首烏製劑或產品警示
英國藥品和醫療產品管理中心 (MHRA) 於2006年發佈何首烏不良反應資訊時,同時提醒服用何首烏可能會導致肝損傷,服用何首烏製劑之前應先諮詢醫師,若服用含何首烏製劑時,出現類似肝損傷的症狀,應及時就醫進行詳細檢查9。
二、澳洲對於含何首烏產品規範
澳洲治療藥物管理局 (Therapeutic Goods Administration, TGA) 於2008年規範含有何首烏的製劑必須標明服用可能會導致肝損傷的風險,如該國註冊藥物「An Shen Ning Ye Fang a.k.a. Polygonum & Zizyphus Peaceful Sleep Formula」,包裝上需標示「Warning: Polygonum multiflorum may harm the liver in some people. Use under the supervision of a healthcare professional」12。
三、香港對於含何首烏製劑或產品規範
香港特別行政區政府衛生署中醫藥事務部於2014年發布含「何首烏」中成藥之內服及外用產品標籤及說明書之管理規範如下13,14:(一)於產品的標籤「有效成分名稱」項下列出「何首烏」;(二)於產品的說明書「有效成分名稱及其份量」項下列出「何首烏」及其份量;(三)於產品的說明書「該成藥的禁忌」及「使用該成藥時須採取的預防措施」項下增加以下內容:1.「該成藥的禁忌」:(1)肝、腎功能不全者禁用。(2)孕婦禁用。(3)已知有本品或組方藥物肝損傷個人史的患者不宜使用。2.「使用該成藥時須採取的預防措施」:(1)服藥 (用藥) 期間應注意監測肝生化指標,如發現肝生化指標異常或出現全身乏力、食慾不振、厭油、噁心、尿黃、目黃、皮膚黃染等可能與肝損傷有關的臨床表現時,或原有肝生化檢查異常、肝損傷臨床症狀加重時,應立即停藥並就醫。(2)嚴格按用法用量服用 (使用),不超劑量、長期連續服用 (使用)。(3)老年人及肝生化指標異常、有肝病史者慎用。(4)哺乳婦女服藥 (用藥) 期間應選擇停止哺乳或停止使用本品。(5)目前尚無系統的兒童用藥安全性研究資料,兒童應慎用。(6)已知有本品或其組方藥物肝損傷家族史的患者慎用。(7)應避免與其他有肝毒性的藥物聯合使用。
四、 中國對於含何首烏製劑或產品標示規範
中國國家食品藥品監督管理總局於2014年提出口服何首烏及其成方製劑可能有引起肝損傷的風險,當超劑量、長期連續用藥等可能會增加這種風險,提醒服用期間應注意與肝損傷有關的臨床表現,如發現肝生化指標異常或出現全身乏力、食慾不振、厭油、噁心、尿黃、目黃、皮膚黃染等可能與肝損傷有關的臨床表現時,應立即停藥並盡速就醫11。中國國家食品藥品監督管理總局除了對於口服何首烏及其成方製劑提出警示,同年亦針對含何首烏保健食品加強監管規定15:(一)保健食品中生何首烏每日用量不得超過1.5 g,製何首烏每日用量不得超過3.0 g,此前批准超過此用量的產品,下調至此規定用量;保健功能包括對化學性肝損傷有輔助保護功能的產品,應取消該保健功能或者配方中去除何首烏。(二)2014年9月1日後生產的含何首烏保健食品,標籤標識中不適宜人群增加“肝功能不全者、肝病家族史者”,注意事項增加“本品含何首烏,不宜長期超量服用,避免與肝毒性藥物同時使用,注意監測肝功能”。(三)對研究表明去除或替換何首烏不影響產品安全、功能的產品,批准證書持有者可根據保健食品註冊變更的程式提出配方變更申請,並提供相關科學依據。(四)各省 (區、市) 食品藥品監督管理局根據前期調查摸底情況,督促企業自發文之日起3個月內按照有關規定提出相關變更申請,並提供依據產品品質標準的3批產品全專案檢測報告;督促生產企業加強原料管理,確保所用何首烏原料技術要求符合《中華人民共和國藥典》的相關規定,加強對含何首烏保健食品上市後安全性監測,發現安全隱患的及時採取措施,報告有關情況,有效地保障消費者食用安全。
五、 國內領有含何首烏藥材許可證之中藥製劑
市售含何首烏之中藥製劑如下:(一)單味傳統散劑;(二)單味濃縮製劑;(三)複方製劑,如七寶美髯丹、當歸飲子、活血順氣何首烏散;(四)中藥酒劑,如中藥酒劑基準方八。
柒、結論
不當使用何首烏可能存在特異質肝臟損傷 (idiosyncratic drug-induced liver injury) 的風險,然成因及何種成分所致,目前尚無定論。選購正確品種、正確炮製且炮製完全之何首烏與正確使用可降低造成肝臟損傷情形發生。中醫藥從業人員應密切注意患者是否存在何首烏之使用禁忌與風險,並可適時監測使用者肝臟生化指標,或針對含何首烏製劑或產品做外包裝警語標示,降低產生藥物不良反應之風險。
Risk Management of the Use of Heshouwu
Kun-Chang Wu1, Zhen-Rung Lai2
Department of Chinese Pharmaceutical Sciences and Chinese Medicine Resource,
College of Chinese Medicine, China Medical University1
Rui Sheng Chinese and Western Medicine Pharmacy2
Abstract
The herbal-induced liver injury caused by the use of Heshouwu has gradually been valued and put forward many warning signs on the label. Adverse reactions are mainly seen in the unprocessed Heshouwu. To avoid drug adverse reactions occur, medical institutions and pharmacies should choose the correct processing of the Heshouwu, and should strengthen the warning signs on the label and the health education of the use of Heshouwu containing preparation or product.
參考資料:
1. 行政院衛生福利部:台灣中藥典。第二版。臺北:衛生福利部,2013;106-7。
2. 國家藥典委員會:中華人民共和國藥典。2015年版。一部。北京:中國醫藥科技出版社,2015;175-7。
3. 香港特別行政區政府衛生署中醫藥事務部:曾與香港不良事件有關的中藥材參考資料,2006。http://www.cmchk.org.hk/cmp/news/2006_adverse_events_c.pdf。
4. Ma J, Zheng L, He YS, et al: Hepatotoxic assessment of Polygoni Multiflori Radix extract and toxicokinetic study of stilbene glucoside and anthraquinones in rats. J Ethnopharmacol 2015; 162: 61-8.
5. Wu X, Chen X, Huang Q, et al: Toxicity of raw and processed roots of Polygonum multiflorum. Fitoterapia 2012; 83: 469-75.
6. Li CY, Tu C, Gao D, et al: Metabolomic study on idiosyncratic liver injury induced by different extracts of Polygonum multiflorum in rats integrated with pattern recognition and enriched pathways analysis. Front Pharmacol 2016; 7: 483.
7. 李春雨、李曉菲、涂燦等:基於內毒素模型的何首烏特異質肝損傷評價。藥學學報2015;50:6。
8. But PP, Tomlinson B, Lee KL: Hepatitis related to the Chinese medicine Shou-wu-pian manufactured from Polygonum multiflorum. Vet Hum Toxicol 1996; 38: 280-2.
9. Medicines and Healthcare products Regulatory Agency: Polygonum multiflorum and liver reactions. 2006. http://webarchive.nationalarchives.gov.uk/20141205150130/http://www.mhra.gov.uk/Howweregulate/Medicines/
Herbalandhomoeopathicmedicines/Herbalmedicines/HerbalSafetyNews/Currentsafetyissues/CON2023590.
10. 朱雲、劉樹紅、王伽伯等:何首烏及其製劑導致藥物性肝損傷的臨床分析。中國中西醫結合雜誌2015;35:1442-7。
11. 國家食品藥品監督管理局:藥品不良反應資訊通報(第61期)關注口服何首烏及其成方製劑引起的肝損傷風險,2014。http://www.sda.gov.cn/WS01/CL1033/102902.html。
12. Department of Health Therapeutic Goods Administratin of Australian Government: Required Advisory Statements for Medicine Labels. 2008. https://www.tga.gov.au/sites/default/files/labelling-rasml-update3-1.pdf.
13. 香港特別行政區衛生署中醫藥事務部. 含「何首烏」中成藥標籤及說明書標示要求. 2014. http://www.cmchk.org.hk/pcm/pdf/RPM_TradeAsso.pdf。
14. 香港特別行政區衛生署中醫藥事務部:中成藥說明書指引 (供業界參考), 2014。http://www.cmchk.org.hk/pcm/pdf/gp_pcm_c.pdf。
15. 國家食品藥品監督管理局:食品藥品監管總局辦公廳關於加強含何首烏保健食品監管有關規定的通知,2014。http://www.sfda.gov.cn/WS01/CL1136/102806.html。
通訊作者:吳坤璋/通訊地址:台中市北區學士路91號
服務單位:中國醫藥大學中國藥學暨中藥資源學系/聯絡電話:04-22053366

