摘要
一位直腸癌併肝臟轉移的55歲女性病人,經手術、化療及放療後,仍發現肝轉移部份仍有殘餘腫瘤,因病人 K-RAS 基因突變呈陽性,不適用第三線藥物治療,而使用 regorafenib 160 mg/day (Stivagra) 治療,並依其臨床反應調整劑量,病人完成第一個療程後追蹤發現肝功能指數異常升高,經診斷為急性肝炎、慢性B型肝炎及轉移性大腸直腸癌,而隨即辦理入院治療且停用藥物。住院期間密集地監測病人肝功能變化,並在停藥後呈緩慢下降趨勢。本案例以 RUCAM score 評估表評分為8分,顯示此案例「極有可能」為使用 regorafenib 引起急性肝損傷。有鑒於在一篇國外的回溯性研究中使用 regorafenib 後發生嚴重肝損傷僅有3例且國內目前沒有相關案例文獻報導,藉此案例提醒醫療人員處方 regorafenib 時,應適當地監測病人肝功能變化,並適時依臨床反應調整或中斷治療,以確保病人的用藥安全。
關鍵字: regorafenib、hepatic injury、metastatic colorectal cancer、adverse drug reactions
壹、前言
衛生福利部統計處2015年的資料,惡性腫瘤居國人十大死因首位。在十大癌症排名中,大腸直腸癌死亡率在第三位,每年約5,000人死亡,發生率為第一名,每年約新增15,000人罹病,其發生率及死亡率皆有逐年增長的趨勢1。治療方式包括手術、化學療法及放射療法,由於約50-60%可能有轉移的情況發生2,所以術後配合化療或放療的輔助療程有其必要性,在化療部分應考量病人的身體狀況及藥物劑量等選擇不同的治療組合。在2016年 NCCN guidelines 中提及 regorafenib 可用於晚期或復發性轉移大腸直腸癌 (metastatic colorectal cancer, mCRC) 的病人在標準治療後仍發生惡化之後續治療藥物3。Regorafenib (Stivarga) 是一種口服標靶藥物,為多重激酶的小分子抑制劑,同時具有抑制血管新生、腫瘤增生的作用達到抑制腫瘤轉移的效果4。於2015年9月1日獲得健保給付,適用於接受過基礎的化療和抗血管內皮生長因子 (anti-VEGF) 等療程治療無效的轉移性大腸直腸癌及腸胃道間質腫瘤患者,由於國內使用案例不多,也沒有發生急性肝損傷之案例文獻報導,期望藉此案例提醒臨床使用 regorafenib 治療時,更審慎監測以避免藥物不良反應發生。
貳、案例報告
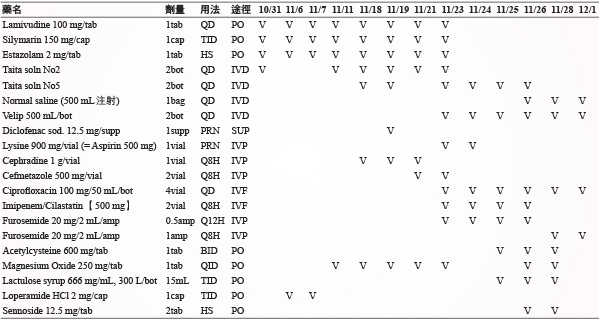
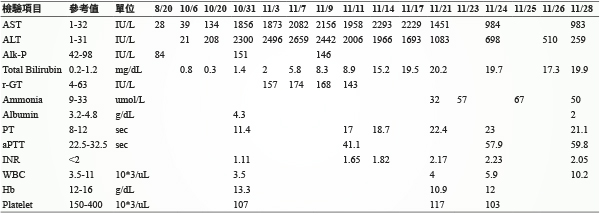
一位55歲女性病人,身高152公分,體重49公斤,對 diclofenac 過敏,過去病史為B型肝炎帶原者。病人在2014年9月經檢查後診斷直腸癌併肝臟轉移,CEA 指數為245 mg/dL。同年10月接受腫瘤切除手術,術後一個月 CEA 指數降為13.2 mg/dL,且胸腹部電腦斷層顯示無明顯他處轉移。然而,術後因肝功能較高,AST/ALT 為85/156 IU/L,經會診肝膽腸胃科醫師後使用抗B型肝炎藥物 lamivudine 2週以避免肝炎發作,待肝功能回復正常,於同年12月起至隔年5月接受標靶藥物 Avastin 與化療藥物 FOLFIRI (Folinic acid/5-Fu/Irinotecan) 治療共計12次。期間追蹤 CEA 指數與電腦斷層皆為正常。後續使用口服 UFUR 與 Folina 做為輔助性治療。2015年12月發現腫瘤復發轉移至肺部及肝臟,隨即安排化療 FOLFOX (Folinic acid/5-Fu/Oxaliplatin) 共6次,但肝轉移疾病惡化,於2016年3月處方改為 FOLFIRI 治療共計6次。期間曾接受2次肝轉移腫瘤射頻燒灼術 (radiofrequency tumor ablation, RFA) 治療。在2016年7月定期追蹤的肝功能檢查 AST/ALT 25/16 IU/L,total bilirubin 0.5 mg/dL,Alk-P (alkaline phosphatase) 84 IU/L。由於同年9月電腦斷層檢查結果,肺轉移部份不變但肝轉移部份仍有殘餘腫瘤,且 CEA 從16.9 mg/dL 上升至75 mg/dL,考慮換藥治療。因患者 K-RAS (Kirsten-ras-2) 基因突變檢查呈陽性,不適用第三線藥物治療。故2016年9月22日處方 regorafenib 治療,以漸進式增加劑量至160 mg QN 使用。使用期間仍持續追蹤病人肝功能,一週後檢查結果 AST/ALT 39/21 IU/L,total bilirubin 為0.8 mg/dL。在10月20日預計第2個療程前的檢查報告 AST/ALT 134/208 IU/L,total bilirubin 0.3 mg/dL,B型肝炎病毒 DNA 定量結果為陰性。因病人有嚴重疲倦感在10月31日至門診就醫時,經檢查肝功能指數異常,診斷為急性肝炎、慢性B型肝炎及轉移性大腸直腸癌,而隨即辦理入院治療並停用 regorafenib。住院期間給予支持性療法及症狀治療以改善感染及肺水腫等相關症狀用藥資料 (表一)。入院當天檢測C型肝炎病毒抗體 (Anti-HCV) 呈陰性,於11月24日再次檢測B型肝炎病毒 DNA 定量結果為陰性,排除因 B、C 型肝炎惡化而導致之肝功能指數異常。住院期間密集地監測病人肝功能變化,在停用 regorafenib 後呈現緩慢下降趨勢 (表二)。因考量病人臨床狀況及體力負荷,經醫療團隊與家屬溝通後,於12月1日辦理出院並以居家安寧緩和照護。
表一 住院期間用藥
表二 檢驗數值
參、 Stivarga 引起肝功能異常與相關文獻探討
Stivarga 成份及含量為 regorafenib 40 mg,口服生體可用率為69%,與血漿蛋白結合度高約99.5%,經由肝臟 CYP3A4及 UGT1A9代謝成活性代謝物,排除半衰期為28小時,經糞便及腎臟排除4,5。臨床上建議一個服藥療程為28天,每療程的前21天 regorfenib 160 mg QD,服藥期間須搭配低脂飲食。持續接受治療直到病況惡化或發生無法接受的不良反應。在腎功能不全者,不需調整劑量。若使用後發生手足皮膚反應、高血壓或肝功能指數上升,則需依狀況調降劑量或中斷治療。此案例腎功能正常,服藥依建議劑量使用,在一週後曾反應右前臂出現紅疹且有肌肉痠痛的症狀,經醫師評估後仍維持劑量治療。第二週回診時因腳及右手出現囊泡 (vesicle formation),經評估後調降至120 mg 睡前使用,並預計完成第三週療程後請病人休息一週後再繼續下一個療程。原預計開始第二次療程,因10月20日病人回診追蹤發現肝指數上升,而延後開始,但肝指數仍不斷上升而導致需入院觀察及治療。
使用 regorafenib 治療前須進行肝功能檢測,包括 AST、ALT 及 total bilirubin 等,在開始治療的前二個療程,應至少每二週監測一次6。後續療程則每月監測,並依臨床情況增加監測頻率。使用此藥期間,如出現 NCI CTCAE (National Cancer Institute Common Terminology Criteria for Adverse Events) 肝臟毒性所列之第3級異常或第2級手足皮膚反應,或自任何第3或4級不良反應恢復後,應減低劑量至120 mg;如有任何 NCI CTCAE 第3或4級的不良反應或症狀沒有改善之手足皮膚反應,則應中斷治療4,5。
回顧本案例造成急性肝損傷原因,病人定期做腹部超音波追蹤且在2016年3月檢查結果與先前並無變化,再者使用 regorafenib 前完成B型肝炎病毒 DNA 檢測且肝功能相關指數皆在正常範圍,可先排除因B型肝炎而導致的肝功能異常。另外,入院前其他慢性用藥並排除其相關性,因此醫療團隊研判應為 regorafenib 導致急性肝損傷,造成肝功能指數異常升高。
近來 regorafenib 使用之安全性也有相關文獻進行分析,在兩篇大型隨機分派第三期臨床試驗 CORRECT 及 CONCUR 中7,8,收納條件皆為轉移性的大腸直腸癌患者且曾接受過至少2次的化療或標靶藥物治療,分別比較使用 regorafenib 及安慰劑之整體存活期 (overall survival) 及無惡化存活期 (progression-free survival) 等結果。特別針對亞洲族群的 CONCUR 研究中,發現使用 regorafenib 產生藥物不良反應的比例較安慰劑組高,分別為132件 (97%)及31 (46%) 件,並以手足皮膚反應 (hand-foot skin reaction)、高血壓、高膽紅素血症 (hyperbilirubinaemia) 及肝指數 (AST、ALT) 上升為最常見。因不良反應而調整治療 (中斷或降低劑量) 發生在 regorafenib 組共計97位 (71%);其中,因此中斷治療共19位 (14%),大多數因檢驗數值異常 (如:高膽素血症、貧血、AST/ALT 上升等),只有1例因手足皮膚反應而停藥。此兩篇試驗結果發現在亞裔族群使用 regorafenib 發生肝臟毒性的比例有較高的趨勢7,8。
在一篇前瞻性研究評估 regorafenib 在臨床使用於轉移性大腸直腸癌患者的有效性及安全性9,收納病人其大部分轉移部位為肝臟及肺臟的個案,平均服用 regorafenib 治療為2.2個月,平均整體存活期比對照組延長5.6個月。安全性方面,有80%的病人在研究期間發生至少一次的不良反應且與藥品相關,最常見為疲倦、手足皮膚反應、腹瀉、食慾不振等。此研究結果特別指出使用 regorafenib 第一個月出現手足皮膚反應比沒有的病人有較長的整體存活期9。
2016年發表的回顧性研究,探討在比利時共93位個案因轉移性大腸直腸癌使用 regorafenib 之肝臟相關毒性,病人使用藥物治療的第一及第二次療程而發生治療相關短暫的 NCI CTCAE 第1-2級 hyperbilirubinemia、AST 及 ALT 上升分別各佔21 (22.5%)、20 (10.7%) 及11 (11.8%) 位。在報告中指出,3位病人出現 NCI CTCAE 所列第3-4級的嚴重肝臟毒性,平均年齡為67歲,受試者都在化療及標靶治療後每天使用 regorafenib 160 mg,其中有2位個案 KRAS mutation 為陽性且之中有1位轉移部位為肝臟及肺臟,與本案例相似。開始使用 regorafenib 後出現肝毒性相關症狀,分別為2週 (2位) 及4個月 (1位);2位個案在停藥後5週肝臟功能檢測值降回正常範圍,而另1位則在停藥後3週因肝臟衰竭而死亡10。因此,不論其腫瘤是否轉移至肝臟,初使用 regorafenib 治療的前2個療程應增加肝功能監測的頻率。
本案例發生在投予 regorafenib 第15天時,當時肝功能指數正常,但因右手及腳出現囊泡而降低劑量至120 mg 使用,並在完成第1個療程後休息1週。在門診追蹤時發現轉移至肝臟及肺臟腫瘤有改善的情況,在預計第2次療程前發現肝功能指數上升,與文獻資料相符。此外,停用 regorafenib 並給予支持性療法後肝功能指數呈緩慢下降的趨勢。依據文獻資料與用藥時序,以 RUCAM (Roussel Uclaf Causality Assessment Method) score 評估表評分為8分 (表三),此案例「極有可能」為使用 regorafenib 引起急性肝損傷。
表三 藥物不良反應相關性之分析探討- RUCAM 評估表

總結來說當醫療人員評估處方 regorafenib 時,應先檢測病人肝功能,並在使用期間監測肝功能、血壓及皮膚反應,尤其是剛開始使用的前2療程應隔週密切監測肝臟指數的變化,並依其臨床反應適當地調整劑量或中斷治療,直到療程完成。若發現肝功能異常或手足之皮膚反應,應適時給予適當的醫療處置及協助。
肆、結論
雖然依目前研究顯示 regorafenib 引起急性肝損傷的案例在亞裔族群有較高的比例,一旦發生此嚴重的不良反應可能需要較長的復原期或甚至死亡。期望藉此案例提醒醫療人員處方 regorafenib 時,應適當地監測病人肝指數的變化,並適時依臨床反應調整劑量或中斷治療,以確保病人的用藥安全。
Regorafenib Induced Acute Hepatic Injury: A Case Report
Chia-Ling Chiang1, Chin-Yu Hsu1, Yu-Chen Hsu2, Ching-Yaw Chen1
Department of Pharmacy, En Chu Kong Hospital1
Division of Colon & Rectal Surgery, En Chu Kong Hospital2
Abstract
A 55-year-old Taiwanese female who has been treated with KRAS-mutated mCRC with liver metastases and hepatitis B carrier. After failure of FOLFOX and FOLFIRI, regorafenib (160 mg/day) was prescribed after disease progression. LFT were normal before starting regorafenib. However, after the first cycle regimen, the patient was admitted due to fatigue, anorexia and elevation of LFT and diagnosed acute hepatic injury, chronic hepatitis B and metastatic colon cancer. Although regorafenib was promptly withdrawn, LFT was monitored closely and gradually decreasing. This event could be classified as probable (RUCAM score 8 points). In this article, we’ve emphasized that health professionals need to aware patients at risk for developing regorafenib-associated hepatic injury, monitor LFT closely.
參考資料:
1.衛生福利部統計處:104年主要死因統計結果分析。臺北:衛生福利部,2016。
2. 台灣癌症臨床研究合作組織(TCOG),大腸癌臨床治療手冊。國家衛生研究院,2010。
3. Benson III AIB, Venook AP, Bekaii-Saab T et al: Colon cancer, version 2.2016 Featured updates to the NCCN guidelines http://www.nccn.org/patients
4. Product Information: Stivarga®, Regorafenib 40mg. Bayer Pharma AG, Taipei, 2015.
5. Stivarga: DRUGDEX® Evaluations (Micromedex 2.0). Truven Health Analytics, Greenwood village, Colorado, USA. Available at: http://www.micromedexsolutions.com/. Accessed on December 1, 2016.
6. Shah RR, Morganroth J, Shah DR.: Hepatotoxicity of Tyrosine Kinase Inhibitors: clinical and regulatory perspectives. Drug Saf 2013; 36: 491-503.
7. Grothey A, Van Custem E, Sobrero A, et al: Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicenter, randomized, placebo-controlled, phase 3 trial. Lancet 2013;381:303-12.
8. Li J, Qin S, Xu R, et al: Regorafenib plus best supportive care versus placebo plus best supportive care in Asian patients with previously treated metastatic colorectal cancer (CONCUR): a randomized, double-blind, placebo-controlled, phase 3 trial. Lancet Oncal 2015;16:619-29
9. Adenis A, Fouchardiere C, Paule B et al: Survival, safety, and prognostic factors for outcome with regorafenib in patients with metastatic colorectal cancer refractory to standard therapies: results from a multicenter study (REBACCA) nested within a compassionate use program. BMC cancer 2016;16:412.
10. Sacre A, Lanthier N, Dano H, et al: Regorafenib induced severe toxic hepatits: characterization and discussion. Liver International 2016; 36: 1590-1594.
通訊作者:江嘉翎/通訊地址:新北市三峽區復興路399號
服務單位:恩主公醫院藥劑科藥師/聯絡電話:(O) 02-26723456 ext 7062

