摘要
Bevacizumab (Avastin,癌思停;以下簡稱 BEV) 是一個可抑制血管生成的抗癌藥品。在臺灣已取得6個癌症適應症:大腸直腸癌、乳癌、多型性神經膠母細胞瘤 (glioblastoma multiforme,GBM)、非鱗狀非小細胞肺癌、卵巢上皮細胞、輸卵管或原發性腹膜癌、子宮頸癌。此外,BEV 也自2011年起健保給付於大腸直腸癌,隔年健保給付於 GBM。除了 GBM 是單獨使用 BEV,其餘的癌症必須 BEV 合併化療。BEV 治療不同的癌症,其使用劑量和併用的化療組合不盡相同。BEV 具有多重作用機轉,除了可抑制血管生成、降低血管通透性、促使腫瘤內血管正常化外,它還具有免疫調節作用,可活化 CD8+細胞毒殺T細胞去攻擊癌細胞。BEV 最常見的副作用是高血壓和蛋白尿,所幸通常都是可以處理的。BEV 的致死率為2.9%,引起死亡最常見的原因是嚴重出血。全球將近有300個有關 BEV 的臨床試驗正在進行,其中不少是併用癌症免疫治療,例如:免疫檢查點抑制劑、癌症疫苗。目前的問題是沒有理想的生物標記可以準確預測何人使用 BEV 會得到最大的效果,期望未來藉由更多腫瘤生物學的研究,能夠解決此問題。
關鍵字: 血管內皮細胞生長因子、Bevacizumab、VEGF
壹、前言
BEV 是一個可抑制血管生成的抗癌藥品。它是單株抗體,可結合血管內皮細胞生長因子 (vascular endothelial growth factor,VEGF)。由於腫瘤細胞會大量製造 VEGF,使得腫瘤血管生成,導致腫瘤生長和轉移;而 BEV 可結合 VEGF,以阻斷其作用。
貳、適應症、健保給付、劑量
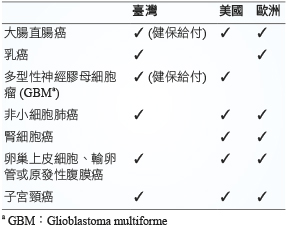
BEV 在臺灣上市所申請核准之適應症和歐美大同小異 (表一),其中腎細胞癌在臺灣之許可中無此適應症1、乳癌在美國上市時無此適應症2、多型性神經膠母細胞瘤 (glioblastoma multiforme,GBM) 則在歐洲上市時無此適應症3。臺灣健保署現今則只給付用於大腸直腸癌和 GBM4。
在臺灣,BEV 的使用規範如下1,4,5:
一、轉移性大腸直腸癌
BEV 併用以5-fluorouracil (5-FU) 為基礎的化療組合 [FOLFOX:FOLinic acid (leucovorin)/Fluorouracil/OXaliplatin 或 FOLFIRI:FOLinic acid/Fluorouracil/IRInotecan],可以做為轉移性大腸直腸癌患者的第一線治療。若第一線使用 BEV 併用 FOLFIRI 後疾病仍惡化,此時 BEV 併用 FOLFOX 可做為第二線治療。然而,健保只給付 BEV 用於第一線治療,且必須併用 FOLFIRI 以及使用總療程以36週為上限。劑量:(一) 第一線治療為5 mg/kg,每兩週一次;或7.5 mg/kg,每三週一次;(二)第一線已接受過 BEV 併用 FOLFIRI 後疾病仍惡化,第二線 BEV 併用 FOLFOX 治療,此時 BEV 劑量為5 mg/kg,每兩週一次;或7.5 mg/kg,每三週一次;(三)第一線已接受過化療但並未使用 BEV,之後疾病惡化,於是採用第二線化療且併用 BEV,此時 BEV 劑量為10 mg/kg,每兩週一次;或15 mg/kg,每三週一次。
二、轉移性乳癌
BEV 與 paclitaxel 合併使用,可以做為轉移性乳癌患者的第一線治療。劑量為10 mg/kg,每兩週一次。
三、GBM
BEV 單獨使用可用於治療曾接受標準放射線治療且含 temozolomide 治療失敗之 GBM 復發患者。健保給付條件同適應症。劑量為10 mg/kg,每兩週一次;或15 mg/kg,每三週一次。
四、 晚期、轉移性或復發性非鱗狀非小細胞肺癌
BEV 與 carboplatin 及 paclitaxel 合併使用,可以作為無法切除的晚期、轉移性或復發性非鱗狀非小細胞肺癌患者的第一線治療。BEV 併用 erlotinib,可作為無法手術切除的晚期、轉移性或復發性且帶有表皮生長因子受體 (epidermal growth factor receptor,EGFR) 活化性突變的非鱗狀非小細胞肺癌患者的第一線治療。劑量為15 mg/kg,每三週一次。第三期 AVAiL 研究發現 BEV 併用 gemcitabine 及 cisplatin 時,BEV 7.5 mg/kg 的成效和15 mg/kg 相當 (皆為每三週一次)6。
五、 復發性卵巢上皮細胞、輸卵管或原發性腹膜癌
(一)對含鉑化療藥品具感受性
BEV 併用 carboplatin 及 gemcitabine 或是併用 carboplatin 及 paclitaxel 治療6個週期後,接著單獨使用 BEV 直到疾病惡化,可以做為曾接受過第一線含鉑 (platinum) 化療藥品治療且間隔至少6個月後復發 (即對含鉑化療藥品具感受性) 之卵巢上皮細胞、輸卵管或原發性腹膜癌患者的治療。劑量為15 mg/kg,每三週一次。
(二)對含鉑化療藥品具抗藥性
BEV 併用 paclitaxel、topotecan 或 pegylated liposomal doxorubicin 可以做為接受過含鉑化療藥品治療後6個月內復發 (即對含鉑化療藥品具抗藥性) 之復發性卵巢上皮細胞、輸卵管或原發性腹膜癌患者的治療。BEV 併用 paclitaxel 或 pegylated liposomal doxorubicin 時,BEV 的劑量為10 mg/kg,每兩週一次。BEV 併用 topotecan 時,BEV 的劑量則視 topotecan 的給藥方式而有所不同,若是每週一次 topotecan,則 BEV 的劑量為10 mg/kg,每兩週一次;若是每三週一次 topotecan,則 BEV 的劑量為15 mg/kg,每三週一次。
六、子宮頸癌
BEV 併用 paclitaxel 及 cisplatin;或是 BEV 併用 paclitaxel 及 topotecan,可用於治療持續性、復發性或轉移性之子宮頸癌。劑量為15 mg/kg,每三週一次。
表一 Bevacizumab 於各國申請核准之適應症1-4
參、 多重作用機轉:聚焦於免疫調節作用
BEV 除了可抑制血管生成和降低血管通透性外7,它也會使得腫瘤內血管正常化,如此可增加化療藥物進入腫瘤內發揮其效果8,9。VEGF 除了作用於血管外,它還會藉由以下機轉對人體免疫造成衝擊:一、抑制樹突細胞 (dendritic cell) 的分化成熟及其功能,樹突細胞是主要的抗原呈現細胞,一旦喪失功能將使得腫瘤抗原無法呈現給T淋巴細胞 (簡稱T細胞) 以進行擊殺癌細胞作用;二、促使許多抑制免疫作用的細胞滲入腫瘤內,調節性T細胞 (regulatory T cell,Treg) 即是其中之一;三、明顯降低可執行免疫作用之T細胞 [特別是 CD8+細胞毒殺T細胞 (cytotoxic T cell)] 的數量10。由於 BEV 可結合 VEGF 以阻斷其作用,因此 BEV 具有免疫調節作用,可活化T細胞去攻擊癌細胞11,如此可應用在癌症免疫治療上。
肆、安全性
統合分析發現,BEV 最常見的副作用是高血壓和蛋白尿,危險比分別為4.89和9.96,所幸通常都不嚴重,是可以處理的12。綜合分析16個大型研究,總人數10217人,顯示化療加上 BEV 的致死率為2.9%,若與單用化療的致死率2.2%相比,加上 BEV 在統計學上有明顯增加致死率 (RR 1.33,95% CI 1.02-1.73,p = 0.04)13。分析也發現 BEV 造成死亡和併用何種化療具有相關性,而和癌症類別無關;併用紫杉醇 (taxane) 或鉑類 (platinum) 化療會明顯增加死亡 (RR 3.49,95% CI 1.82-6.66,p = 0.006)13。BEV 引起死亡最常見的原因依次是出血 23.5%、嗜中性白血球低下 (neutropenia) 12.2%、胃腸道穿孔7.1%13。
伍、未來展望
全球將近有300個有關 BEV 的臨床試驗正在進行中,其中不乏併用免疫治療 (疫苗、免疫檢查點抑制劑等)14。預計不久將來陸續會有結果,值得注意。目前的問題是沒有理想的生物標記 (biomarker) 可以準確預測何人使用 BEV 會得到最大的效果,期望未來藉由更多腫瘤生物學的研究,能夠解決此問題。
陸、結論
自上市後第一個大腸直腸癌適應症申請通過,BEV 在國內已陸續申請通過用於6個適應症治療。此外,BEV 也自2011年起由健保給付用於大腸直腸癌,隔年健保給付可用於 GBM 治療4。除了 GBM 是單獨使用 BEV,其餘的癌症必須BEV合併化療。需要注意的是:BEV 治療不同的癌症,其使用劑量和併用的化療組合不盡相同。由於 BEV 具有多方面的作用機轉,可調節人體免疫,加上可接受的安全性,因此,相信 BEV 在未來可能有相當大的發展空間。
Bevacizumab
Chi-Yuan Cheng, Tzu-Cheng Tsai
Department of Pharmacy, Chang Gung Memorial Hospital, Linkou
Abstract
Bevacizumab (Avastin, BEV) is an anticancer drug to inhibit tumor angiogenesis. In Taiwan, BEV has approved six cancer indications, including colorectal cancer, breast cancer, glioblastoma multiforme (GBM), non-squamous non-small cell lung cancer, ovarian cancer, and cervical cancer. In addition, BEV has reimbursed by National Health Insurance in Taiwan for the treatment of colorectal cancer since 2011, and GBM next year. BEV must combine with chemotherapy except for GBM treatment. The dose of BEV and the combination regimen of chemotherapeutic agents with BEV are not the same for different cancers. BEV shows its multiple effects on inhibiting angiogenesis, reducing vascular permeability, promoting normalization of blood vessels within the tumor, and it has an immunomodulatory effect as well. The most common side effects of BEV are hypertension and proteinuria, but fortunately usually not serious and can be manageable. The overall incidence of fatal adverse events with BEV was 2.9%; the most common cause was severe bleeding. Nearly 300 global clinical trials of BEV are ongoing, many of which are plus cancer immunotherapy, such as immune checkpoint inhibitors, cancer vaccines. No ideal biomarkers are available to predict precisely which patients will benefit most from BEV therapy is the current problem. In the near future, we wish to solve the problem based on more tumor biology studies.
參考資料:
1.Bevacizumab臺灣衛福部適應症https://www.fda.gov.tw/MLMS/H0001D.aspx?Type=Lic&LicId=10000807 (accessed July 31, 2017)
2. Bevacizumab美國FDA適應症
https://www.accessdata.fda.gov/drugsatfda_docs/label/2015/125085s312lbl.pdf (accessed July 31, 2017)
3. Bevacizumab歐洲EMA適應症
http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000582/human_med_000663.jsp&mid=WC0b01ac058001d124 (accessed July 31, 2017)
4. Bevacizumab臺灣健保署給付規定
https://www.nhi.gov.tw/Content_List.aspx?n=E70D4F1BD029DC37&topn=3FC7D09599D25979&upn=2870F203E2BF9DDB (accessed July 31, 2017)
5. Bevacizumab中文仿單
file:///C:/Users/stor/Downloads/Avastin_CDS+34.0_0617-AVA-01-106-06-22.pdf (accessed July 31, 2017)
6. Reck M, von Pawel J, Zatloukal P, et al: Phase III trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer: AVAil. J Clin Oncol 2009;27:1227-34.
7. Midgley R1, Kerr D: Bevacizumab--current status and future directions. Ann Oncol 2005;16:999-1004.
8. Tolaney SM, Boucher Y, Duda DG, et al: Role of vascular density and normalization in response to neoadjuvant bevacizumab and chemotherapy in breast cancer patients. Proc Natl Acad Sci U S A. 2015;112:14325-30.
9. Goel S, Wong AH, Jain RK: Vascular normalization as a therapeutic strategy for malignant and nonmalignant disease. Cold Spring Harb Perspect Med 2012;2:a006486.
10. Li YL, Zhao H, Ren XB: Relationship of VEGF/VEGFR with immune and cancer cells: staggering or forward? Cancer Biol Med 2016;13:206-14.
11. Thomas AA, Fisher JL, Hampton TH, et al: Immune modulation associated with vascular endothelial growth factor (VEGF) blockade in patients with glioblastoma. Cancer Immunol Immunother 2017;66:379-89.
12. Roviello G, Bachelot T, Hudis CA, et al: The role of bevacizumab in solid tumours: A literature based meta-analysis of randomised trials. Eur J Cancer 2017;75:245-58.
13. Ranpura V, Hapani S, Wu S: Treatment-related mortality with bevacizumab in cancer patients: a meta-analysis. JAMA 2011;305:487-94.
14. https://clinicaltrials.gov/ct2/results?term=bevacizumab&Search=Apply&recrs=a&age_v=&gndr=&type=&rslt= (accessed July 31, 2017)
通訊作者:鄭吉元/通訊地址:桃園市龜山區復興街5號
服務單位:林口長庚紀念醫院藥劑部藥師/聯絡電話:(O) 03-3281200 ext 2915

