摘要
人體免疫系統有效地殺死癌細胞是經由7個連續步驟,稱為癌症–免疫循環 (cancer-immunity cycle)。癌細胞可藉著許多方法來干擾這個循環,稱作『免疫逃脫 (immune escape)』,使得癌細胞躲開免疫擊殺,導致癌症發生。免疫逃脫包括:腫瘤免疫抗原性 (tumor immunogenicity) 未表現或表現不佳 (步驟1)、抑制樹突細胞的成熟 (步驟2)、T細胞未進行活化 (步驟3)、T細胞運送到腫瘤處受阻 (步驟4)、T細胞浸潤腫瘤核心內部受阻 (步驟5)、癌細胞無法被T細胞所辨認 (步驟6)、T細胞無法殺死癌細胞 (步驟7)。本文將剖析每一步驟,癌細胞如何進行免疫逃脫,以及破解的對策。
關鍵字: 癌症–免疫循環、免疫逃脫、cancer-immunity cycle、immune escape
壹、前言
人體免疫系統有效地殺死癌細胞是經由7個連續步驟,稱為癌症–免疫循環 (cancer-immunity cycle)1。癌細胞可藉著許多方法來干擾這個循環,稱作『免疫逃脫 (immune escape)』,使得癌細胞躲開免疫擊殺,導致癌症發生。本文將剖析每一步驟,癌細胞如何進行免疫逃脫,以及破解的對策。
貳、免疫逃脫七步曲及其破解的對策
當免疫體系的司令塔「樹突細胞」發現癌症細胞時,會將癌症細胞的特徵,傳遞給負責攻擊的「T細胞」,並對其發出攻擊的信號。但若癌症–免疫循環無法進行最佳執行時,癌症就發生了。例如:腫瘤抗原不被樹突細胞 (dendritic cell) 和 CD8+細胞毒殺T淋巴細胞 (CD8+ cytotoxic T lymphocyte,簡稱 CD8+ T 細胞) 所辨認、CD8+ T 細胞無法滲入腫瘤內、腫瘤微環境 (tumor microenviroment) 抑制 CD8+ T 細胞作用1,2。以下將詳述之。另外,我將本文中所提及會影響癌細胞存亡之分子層面 (表一)。
一、 腫瘤免疫抗原性 (tumor immunogenicity) 未表現或表現不佳 (步驟1)
免疫抗原性就是引發免疫功能的能力。癌症–免疫循環的啟動是藉由垂死中的腫瘤細胞釋放出腫瘤抗原,然後被樹突細胞所辨識而將其攝入並處理之,接著進入淋巴結以『腫瘤抗原–MHC (major histocompatibility complex) class I 複合體』的型式呈現給 CD8+ T 細胞,於是 CD8+ T 細胞被活化以擊殺癌細胞。
腫瘤免疫抗原性與腫瘤之基因突變負擔 (mutation burden) 有關1。基因突變產生新抗原 (neoantigen) 不一定就保證會具有免疫抗原性來引發免疫反應3,然而若基因突變越多,即高突變負擔,則產生免疫抗原性的機會越大,這就好比你手上的統一發票不一定會中獎,但是統一發票張數越多,中獎的機率就越高。黑色素細胞瘤 (melanoma)、肺癌、膀胱癌等具有高突變負擔,使得大量的 CD8+ T 細胞浸潤腫瘤核心內,因此被歸類為發炎性腫瘤 (inflamed tumor)1,3,4。反之,有些癌症通常看不到 CD8+ T 細胞滲入腫瘤核心內,這又分成兩種情況:(一)完全沒有出現 CD8+ T 細胞,稱為免疫沙漠 (immune desert),例如:前列腺癌;(二)有出現 CD8+ T 細胞,但是被阻擋在腫瘤的外圍而無法滲入腫瘤核心內,稱為免疫排除 (immune excluded),例如:大腸直腸癌、胰臟癌1,3。
如果腫瘤免疫抗原性未表現或表現不佳,將會造成免疫逃脫。解決的方法可使用化療、放射線治療、標靶藥物造成癌細胞死亡或凋亡,以提高腫瘤抗原的釋放2;或是研發癌症疫苗來啟動免疫反應1。
二、抑制樹突細胞的成熟 (步驟2)
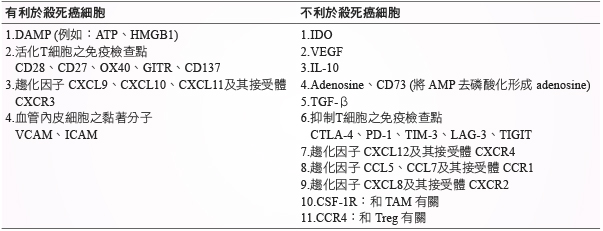
即將死亡的癌細胞會產生 DAMP (damage-associated molecular pattern) [例如:ATP (adenosine triphosphate)、HMGB1 (high mobility group box 1)] 來誘導樹突細胞的成熟1。癌細胞可藉由分解 ATP 或是氧化 HMGB1,使得樹突細胞的成熟受阻1。
很多的癌症衍生相關因子,例如:IDO (indoleamine 2,3-dioxygenase)、VEGF (vascular endothelial growth factor)、IL-10 (interleukin-10)、adenosine、TGF-β (transforming growth factor β) 等皆會抑制樹突細胞的成熟1。此外,腫瘤微環境中的 Treg (regulatory T cell) 會分泌 IL-10、TGF-β 以及 MDSC (myeloid-derived suppressor cell) 也會阻礙樹突細胞的成熟1,5。
抑制樹突細胞的成熟,使其無法發揮抗原呈現功能,自然後續導致T細胞無法活化。解決的方法可使用上述癌症衍生相關因子的拮抗劑,詳情見本文第四和第六部份。
三、T細胞未進行活化 (步驟3)
T細胞和腫瘤抗原 (由樹突細胞呈現) 結合還不足以活化T細胞,T細胞的活化必須還要加上另一個共同刺激 (co-stimulation) 訊號,這兩個步驟缺一不可,如果沒有共同刺激訊號,T細胞將會成休眠狀態或凋亡。樹突細胞和T細胞之間的共同刺激交互作用包括:B7.1/B7.2:CD28 (前者 B7.1/B7.2位於樹突細胞,後者 CD28位於T細胞)、CD70:CD27、OX40配體 (ligand):OX40、GITR 配體:GITR (glucocorticoid-induced tumor necrosis factor-related gene)、CD137 (4-1 BB) 配體:CD1371。上述 CD28、CD27、OX40、GITR、CD137是屬於T細胞表面可活化T細胞之免疫檢查點 (immune checkpoint),作用於這些免疫檢查點可促進T細胞活化,就好比汽車的踩油門6。因此,上述免疫檢查點作用劑可增進T細胞活化,例如:OX40作用劑,目前正在進行臨床試驗。
當T細胞活化啟動免疫攻擊癌細胞期間,T細胞會開始表現負性回饋機制[例如:CTLA-4 (cytotoxic T-lymphocyte–associated protein 4)] 來抑制T細胞的活化1。CTLA-4是屬於T細胞表面可抑制T細胞之免疫檢查點,作用於 CTLA-4會抑制T細胞活化,就好比汽車的踩煞車6。因此,CTLA-4抑制劑可促使T細胞活化。2011年美國 FDA 核准 CTLA-4抑制劑 ipilimumab 用於治療轉移性黑色素細胞瘤,自此癌症治療進入新紀元7,ipilimumab 在台灣也已上市。
四、T細胞運送到腫瘤處受阻 (步驟4)
CD8+ T 細胞活化,可促進干擾素γ (interferon-γ,IFN-γ) 產生,而 IFN-γ 會促使 CD8+ T 細胞表現 CXCR31。CXCR3是趨化因子 (chemokine) CXCL9、CXCL10、CXCL11的接受體 (receptor)1。研究發現,浸潤腫瘤核心內部的 CD8+ T 細胞具有高度表現 CXCR3,又上述趨化因子若處在低濃度下會降低 CD8+ T 細胞浸潤腫瘤的能力1。
活化的 CD8+ T 細胞會經由血液,穿越血管內皮細胞後運送至腫瘤處。T 細胞要穿越血管內皮細胞前必須先黏著 (adhesion) 在內皮細胞上,這個步驟需要依靠T細胞表面的整合素受體 (integrin) 和血管內皮細胞上的 VCAM (vascular cell adhesion molecule)、ICAM (intercellular adhesion molecule) 彼此結合來完成1。癌細胞可透過分泌一些物質來抑制 CD8+ T 細胞穿越血管內皮細胞,其中最重要的物質就是 VEGF1。VEGF 會使VCAM、ICAM 的濃度下降,導致活化的 CD8++ T 細胞無法運送到腫瘤處1。針對這個免疫逃脫可使用 bevacizumab 來解決,bevacizumab 是單株抗體,可結合 VEGF,以阻斷其作用。全球將近有300個有關 bevacizumab 的臨床試驗正在進行中,其中不乏併用免疫治療 (癌症疫苗、作用於免疫檢查點的藥物等)8。
五、 T細胞浸潤腫瘤核心內部受阻 (步驟5)
CD8+ T 細胞已來到腫瘤處,但是卻被阻擋在外圍,無法進入腫瘤的核心,這也是免疫逃脫的機轉之一。主要原因是腫瘤的基質 (stroma) 中之癌症相關纖維母細胞 (cancer-associated fibroblast,CAF) 所致1。CAF 會產生大量的纖維蛋白或膠原蛋白等物質,使得T細胞無法深入腫瘤核心1。CAF 也會藉由分泌趨化因子 CXCL12來抑制T細胞滲入腫瘤內1。CXCR4是 CXCL12的接受體,很多癌症皆會過度表現 CXCR4,導致免疫逃脫1。因此,針對此免疫逃脫步驟,抑制 CAF、CXCL12和 CXCR4是可以採取的對策。
六、癌細胞無法被T細胞所辨認 (步驟6)
癌細胞需要以癌細胞本身的 MHC 將腫瘤抗原呈現給活化的 CD8+ T 細胞,如此T細胞才能辨認出癌細胞而將之擊殺。如果癌細胞的 MHC 消失或是表現不足,會導致癌細胞無法被T細胞所辨認,造成免疫逃脫1。這個現象在許多癌症都會發生,發生率為16-50%1。解決之道可使用 BITE (bispecific T cell engager) 或 CAR-T (chimeric antigen receptor T cell),因為這兩種手法是不需要 MHC 也可針對腫瘤抗原予以擊殺1。
七、 腫瘤微環境中免疫細胞和癌細胞的殊死戰 (步驟7)
當 CD8+ T 細胞已經兵臨城下,直接面對癌細胞時,癌細胞時常會出現 PD-L1 (programmed cell death ligand-1),而 PD-L1和T細胞上 PD-1 (programmed cell death protein-1) 結合後,會導致T細胞無法發揮作用6。同 CTLA-4,PD-1也是屬於T細胞表面可抑制T細胞之免疫檢查點6。因此,PD-1或 PD-L1抑制劑則可以恢復T細胞原本功能6。目前,PD-1抑制劑已上市nivolumab、pembrolizumab,PD-L1抑制劑已上市 atezolizumab、avelumab、durvalumab9,其中 nivolumab、pembrolizumab 和 atezolizumab 在台灣有上市。核准的適應症至少涵蓋8種癌症,且不斷再增加中9。PD-1或 PD-L1抑制劑是現階段癌症免疫治療的主幹,有相當多的臨床試驗正在進行中,其中大部份是併用其他藥物之合併療法1,10。
除了 PD-1外,CD8+ T 細胞也可能共同出現其他抑制性免疫檢查點,包括 LAG-3 (lymphocyte-activation gene 3 protein)、TIM-3 (T-cell immunoglobulin domain, mucin domain-3)、TIGIT (T-cell immunoglobulin and immunoreceptor tyrosine-based inhibitory motif domain) 等1,此時使用 PD-1或 PD-L1抑制劑則無效。解決之道是使用 LAG-3、TIM-3或 TIGIT 的拮抗劑,但是必須併用 PD-1或 PD-L1抑制劑才會有效1。
腫瘤微環境中存在有許多抑制 CD8+ T 細胞作用的免疫細胞,包括腫瘤相關巨噬細胞 (tumor-associated macrophage,TAM)、Treg、MDSC 等1,5。TAM 會分泌 IL-10,Treg 會分泌 IL-10、TGF-β 來抑制 CD8+ T 細胞作用1,5。癌細胞也可產生 IDO 以促進 Treg 和 MDSC 的增生1,以及分泌趨化因子 CCL5、CCL7、CXCL8去結合 MDSC 上相對應的接受體 CCR1和 CXCR2來吸引 MDSC 進入腫瘤微環境中11。另一個癌症衍生相關因子 adenosine 則會經由 CD8+ T 細胞上的 A2A 接受體來抑制 CD8+ T 細胞作用,以及經由癌細胞上的 A2B 接受體以促進癌細胞轉移11。值得注意的是 CD73,它是一酵素,可將 AMP (adenosine monophosphate) 去磷酸化形成 adenosine11。研究顯示,CD73高度表現的癌症其預後差,也會限制 PD-1抑制劑的效果11。目前有不少的臨床試驗即是針對腫瘤微環境,例如:研發藥物抑制 IDO、TGF-β、CD73、adenosine 等,以及藉由阻斷 CSF-1R (colony stimulating factor 1 receptor,macrophage colony-stimulating factor receptor) 來降低 TAM 的數量或是 CCR4抑制劑來阻止 Treg 進入腫瘤微環境中11。
表一 影響癌細胞存亡之分子層面
參、結論
癌症免疫治療已在許多癌症上看到長期持續效果,其中 PD-1或 PD-L1抑制劑是現階段癌症免疫治療的主幹。然而,只有一小部份的癌症病人受惠,原因可由癌症–免疫循環看出一些端倪。此循環中每一個步驟都缺一不可,完成這7個步驟才能有效治療癌症。我們需要深入瞭解癌細胞如何逃脫免疫擊殺、不同癌症的免疫表現型 (phenotype) 以及每位癌症病人本身腫瘤的免疫狀況,如此才能給予個人化最佳治療以及有效的合併療法。
附錄
AMP: adenosine monophosphate。
ATP: adenosine triphosphate。
BITE: bispecific T cell engager。
CAR-T: chimeric antigen receptor T cell。
CSF-1R: colony stimulating factor 1 receptor (macrophage colony-stimulating factor
receptor)。
CTLA-4: cytotoxic T-lymphocyte–associated protein 4。
DAMP: damage-associated molecular pattern。
GITR: glucocorticoid-induced tumor necrosis factor-related gene。
HMGB1: high mobility group box 1。
ICAM: intercellular adhesion molecule。
IDO: indoleamine 2,3-dioxygenase。
IL: interleukin 。
LAG-3: lymphocyte-activation gene 3 protein。
MDSC: myeloid-derived suppressor cell。
MHC: major histocompatibility complex。
PD-1: programmed cell death protein-1。
PD-L1: programmed cell death ligand-1。
TGF-β: transforming growth factor β。
TIGIT: T-cell immunoglobulin and immunoreceptor tyrosine-based inhibitory motif domain。
TIM-3: T-cell immunoglobulin domain, mucin domain-3。
Treg: regulatory T cell。
VCAM: vascular cell adhesion molecule。
VEGF: vascular endothelial growth factor。
To Overcome Seven Steps of Tumor Immune Escape
Chi-Yuan Cheng1, Tzu-Cheng Tsai1, Wen-Cheng Chang2
Department of Pharmacy, Chang Gung Memorial Hospital, Linkou1
Department of Oncology, Chang Gung Memorial Hospital, Linkou2
Abstract
The human immune system effectively kills cancer cells through seven consecutive steps, known as the cancer-immunity cycle. Cancer cells can interfere with this cycle by many ways, called "immune escape", which allows cancer cells to escape from immune attack, leading to the cancer development. Immune escape includes no or poor tumor immunogenicity (step 1), inhibition of dendritic cells maturation (step 2), lack of optimal T-cell activation (step 3), impairment of T-cell trafficking to the tumor (step 4), blockade of T-cell infiltration into the tumor center (step 5), loss of recognition of cancer cells by T cells (step 6), and incapable of killing cancer cells by T cells (step 7). This article will discuss each step in detail to explore how tumor immune escape processing, and the strategies to overcome it.
參考資料:
1.Kim JM, Chen DS: Immune escape to PD-L1/PD-1 blockade: seven steps to success (or failure). Ann Oncol 2016;27:1492-504.
2. Chen DS, Mellman I: Oncology meets immunology: the cancer-immunity cycle. Immunity 2013;39:1-10.
3. Chen DS, Mellman I: Elements of cancer immunity and the cancer-immune set point. Nature 2017;541:321-30.
4. Alexandrov LB, Nik-Zainal S, Wedge DC, et al: Signatures of mutational processes in human cancer. Nature 2013;500:415-21.
5. Kerkar SP, Restifo NP: Cellular constituents of immune escape within the tumor microenvironment. Cancer Res 2012;72:3125-30.
6. Tykodi SS: PD-1 as an emerging therapeutic target in renal cell carcinoma: current evidence. Onco Targets Ther 2014;7:1349-59.
7. Hoos A: Development of immuno-oncology drugs - from CTLA4 to PD1 to the next generations. Nat Rev Drug Discov 2016;15:235-47.
8. https://clinicaltrials.gov/ct2/results?term=bevacizumab&Search=Apply&recrs=a&age_v=&gndr=&type=&rslt= (accessed October 27, 2017)
9. Haanen JBAG, Carbonnel F, Robert C, et al: Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017;28(suppl_4):iv119-42.
10. Melero I, Berman DM, Aznar MA, et al: Evolving synergistic combinations of targeted immunotherapies to combat cancer. Nat Rev Cancer 2015;15:457-72.
11. Sharma P, Hu-Lieskovan S, et al: Primary, adaptive, and acquired resistance to cancer immunotherapy. Cell 2017;168:707-23.
通訊作者:鄭吉元/通訊地址:桃園市龜山區復興街5號
服務單位:林口長庚紀念醫院藥劑部藥師/聯絡電話:(O) 03-3281200 ext 2915

