摘要
N-甲基-D-天冬胺酸受體 (NMDAR) 功能低下造成多巴胺傳遞路徑的失能已歸類為思覺失調症的病理因素之一。而藉由甘胺酸運輸體抑制劑 (GTI) 增加 NMDAR 功能進而改善負性症狀的治療,也符合藥理學上治療思覺失調症的方針。但在近期的 Bitopertin (RG1678) phase III 的長期試驗中並無顯著改善負性症狀的結果,而 AMG747的臨床研究中也無顯示符合治療理論之實驗結果,而使得此類治療藥物及理論仍需再受考驗。在本文中我們將介紹 NMDA 受體及 GTI 如何增加 NMDAR 功能的機制,此外我們也討論在臨床研究中未符合期待結果的原因-NMDAR 減量調節。甘胺酸運輸體抑制劑在亞慢性使用下具有改善負性症狀的效果,但在長期治療的使用下卻無明顯效益。雖然減量調節可能會發生在其他的應用上,但仍期待甘胺酸運輸體抑制劑在其他疾病治療應用的情形。
關鍵字: 甘胺酸運輸體抑制劑、NMDA功能減弱、負性症狀、Glycine transporter inhibitor、NMDA Hypo-function、negative symptoms
壹、前言
思覺失調症 (schizophrenia, SZ) 是一種嚴重且複雜的精神性疾病,並可能同時具有正性症狀 (positive symptoms) 如:妄想 (delusions)、幻想 (allusions)、混亂的言語、行為 (disorganized speech、behavior) 及負性症狀 (negative symptoms) 如:情感淡漠 (affect blunting)、言語貧乏 (alogia)、意志力缺乏 (avolition)、社交性缺乏 (asociality)、興趣缺乏 (anhedonia) 的特徵。SZ 的病理原因以腦部多巴胺 (dopamine, DA) 異常所造成的多巴胺假說 (dopamine hypothesis) 為主,並同時以拮抗 DA 作為治療精神症狀為主要架構。目前治療上常用的抗精神科藥物 (表一),第二代抗精神病藥物明顯與第一代的機轉區別在於具有拮抗5-HT2受體外,椎體外症狀 (EPS) 的副作用也大幅下降。
表一 抗精神科藥物分類

在精神病理學的治療概念上,SZ 的正性症狀與腦部多巴胺活性增強 (hyperdopaminergia) 相關,因此抗精神病藥物利用拮抗 DA 來治療正性症狀部份。而負性症狀應是與腦部某區域功能低下 (如:海馬迴) 或是中樞神經系統結構性的改變,造成負性症狀的行為產生,在治療上有多種用藥的選擇,但現未有廣泛且有效的藥物治療,以下是對負性症狀治療的概括介紹1:
一、 抗精神性藥物 (antipsychotics, APs)
在具有 D2/5-HT2受體拮抗作用之第二代 APs–clozapine,相較第一代 APs 具有改善負性症狀的效果,也間接證明負性症狀可能受 DA 以外的神經傳遞物質影響,因此也啟發了負性症狀的各種治療理論。
二、 抗憂鬱劑 (antidepressants, ADs)
負性症狀和憂鬱症 (Depression) 在臨床上雖不易區別,在病理因素上卻是不相同。但 ADs 仍是可對負性症狀有所改善,其中以 Mitrazapine 的次級分析研究證實較有效。
三、抗痙攣劑 (anticonvulsants)
如同電痙攣療法 (Electroconvulsive therapy, ECT),抗痙攣劑也常作 SZ 患者中次族群 (clozapine 抗性,攻擊性) 的穩定輔助治療方式,例:larmotrigine。
四、中樞興奮劑 (CNS stimulants)
在 SZ 的治療中,早期因可能會增加正性症狀的風險是不建議使用中樞興奮劑來治療負性症狀的部份。但在近期的研究中已證實在臨床上病情穩定且接受精神科藥物治療的患者,產生急性發作的風險較低。例:methylphenidate、modafinil、armodafinil。
五、乙醯膽鹼 (acetylcholine, ACh)
ACh 主要著重在認知功能的改善,在早期 SZ 的患者使用乙醯膽鹼酯酶抑制劑 (AChE-I) 的研究中發現有明顯改善病人認知功能而非負性症狀。但在近期重新研究分析下,donepezil 及 galantamine 同時具有異位調節尼古丁受體的作用,間接提升麩胺酸受體及血清素受體功能,因此也被認定為是具有改善負性症狀的相關機轉。
六、血清素 (serotonin)
在第二代 APs 具有拮抗5-HT2受體而改善負性症狀的概念下,5-HT2拮抗劑如:ritanserin也成為改善負性症狀的治療方向,近期中也有使用選擇性5-HT3拮抗劑如:ondansetron、tropisetron、granisetron 作為治療負性症狀的相關研究,但效果普通。
七、麩胺酸 (glutamate, Glu)
在 SZ 的精神病理學中,多巴胺理論為主流的治療方向外,自1987年即有提出N–methyl–D-asparate receptors (NMDAR) 功能低下所造成精神症狀的假說。
(一)在動物實驗中 PCP (NMDA antagonist) 會增加實驗小鼠運動活性 (正性症狀行為模式),小鼠社交活動行為缺失 (social deficits)、增加強制游泳測試 (forced swimming test) 的不游動時間 (負性症狀行為模式),增加感覺運動行為的運動失調(ataxia)及認知缺失 (cognition deficits) 的影響。(二)在臨床上的觀察,使用 PCP , Ketamine 對於健康受試人也會誘發類精神症狀之正性、負性症狀及認知缺失的情形。(三)在 SZ 患者的脊椎中也發現了 Glu 濃度相較正常人是減少的,並且在病理學中也有疑似基因造成 NMDA 受體媒介 glutamate 傳遞缺失的相關研究。
以上相關研究都支持著 NMDARs 功能減退而造成 SZ 的假說,因此現也將 NMDARs 功能低下造成多巴胺傳遞路徑失能歸類為 SZ 的治療概念。至2007年時已有多項研究證實藉由活化 NMDAR 可以改善 SZ 部份的正性及負性症狀2,但時至2016年後的臨床研究結果卻是峰迴路轉地未能有明確的治療效果,至今也未有一項藥品上巿。
貳、 N–methyl–D-asparate receptors (NMDARs) 介紹
一、受體結構、次單位組成
複合型的雜原性受體,主要由2個 NR1次單位及2個 NR2或 NR3次單位組合成。
二、受體特性
(一)NR1次單位上具有 glycine B site 辦識位置 (可受 D-serine, cycloserine 活化);而 NR2或 NR3次單位存有 glutamate 辦識位置,另具有其他調控物質的接合位置如:polyamine site、glutathione、二價離子 (Mg2+、Zn2+)、PCP 阻斷位置 (圖一)2。(二)NMDARs 屬於物控型離子通道之受體 (ligand-activated, ion channel receptor),需同時接受 NR1 (glycine 異位調控) 及 NR2 (glutamate) 接合物質調控才能有效地活化受體以進行離子通道開啟,造成 Ca2+、Na+、K+離子流動,但此作用會受到 Mg2+的影響而阻斷。(三)NMDARs 活化時間也會受到突觸後去極化的影響 (如:AMPA receptor),可自動移除 Mg2+ 的阻斷作用,延長開啟時間,因此比其他類型的受體作用時間持續的更久。(四)在同時具有物控 (ligand-) 及電控 (voltage-) 的特性下,NMDARs 可以非線性型態增加細胞內 Ca2+濃度,因此 NMDARs 也被認為與突觸可塑性 (synaptic plasticity) 中的長期增益作用 (long term potentiation, LTP) 及長期壓抑作用 (long term depression, LTD) 相關。LTP/LTD 是描述發生在各種 CNS 突觸中一種顯著長期突觸傳導的加強或抑制作用 (活體外數小時,活體內數日或數週)。在理論上 LTP 與突觸間的 NMDARs 及細胞存活路徑相關;LTD 則與突觸間及突觸外的 NMDARs 及細胞凋亡路徑相關,也因此 NMDRs 對各疾病的影響不盡相同。
三、NMDARs 的生理功能
一般認為具有興奮性毒性,與 AMPA 及 Kainate 受體被認為與癲癇、慢性疼痛相關。近年的研究則著重於拮抗 NMDAR 而達到預防神經退化性疾病的產生,如阿茲海默症的治療。但在神經元活性的生理變化上 (如學習或記憶),活化 NMDAR 則是有改善認知功能及調節其他神經元活性的作用。
四、活化 NMDARs 的方法
其中最有效的策略是藉由調節對甘胺酸 (Glycine, Gly) 高親合力運輸體 (transporter) 的回收作用,增加突觸間隙內 Gly (co-agonist) 可用率,進而增強 NMDARs 的功能。若單獨只增加 Glu 的情況下,反而會增加誘發癲癇的風險,而直接補充 Gly 的方式,雖無此嚴重的副作用,但卻會因 Gly-T 的作用而降低 Gly 活性。
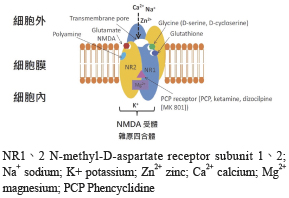
圖一 NMDA 受體主要接合位置
參、 甘胺酸運輸體抑制劑 (Glycine transporter inhibitor, GTI)
甘胺酸 (glycine,Gly) 為1960年代第一個發現的抑制性神經傳遞物質胺基酸,而甘胺酸受體 (Gly Receptor, GlyR) 主要分佈人類中樞系統中的前額葉、腦幹及腦脊髓中,在此以 glycine A site 調控抑制類型的神經傳導作用。在前項介紹中,Gly 也是興奮型神經元 NMDARs 的輔作用劑 (co-agonist),所以 Gly 依受體不同而產生不同的訊息傳遞作用。
在中樞神經系統中調節突觸間 Gly 濃度的機制是藉由一種高親合性的 Na+、Cl-運輸體 (transporter) 的方式將甘胺酸回收,此運輸體具有二種類型 glycine transporter 1 (GlyT1) 及 glycine transporter 2 (GlyT2),在分佈也有明顯區分:一、GlyT1主要分佈在麩胺酸興奮型神經元突觸後的 NMDARs 上、星狀膠細胞 (astrocyte) 及神經膠細胞 (glial cell) 上,也是興奮型神經元 Gly 回收的主要方式。二、GlyT2則主要存在甘胺酸抑制型神經元突觸前的神經元上,負責回收及存載此類型突觸間隙 Gly,但在抑制性神經元 Gly 回收時也需依賴在神經膠細胞上 GlyT1的協助 (圖二)2。
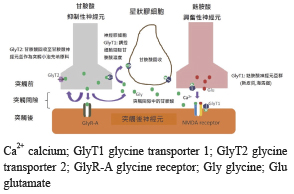
圖二 GlyT1於興奮型神經元突觸間隙及 GlyT2於抑制型神經元突觸間隙位置示意圖
GlyT1回收機制具有:一、調控麩胺酸興奮型神經元突觸間隙 Gly 濃度在活化 NMDARs 之基準點之下及,二、降低了 NMDARs 之活性的雙重功能。反之,若阻斷其作用是可以增加或延長 NMDARs 的活性 (圖三)2,此外 GlyT1本身也會受到麩胺酸興奮型神經元釋放的 Zn2+ 抑制其回收作用而增加 NMDARs 自體活性。
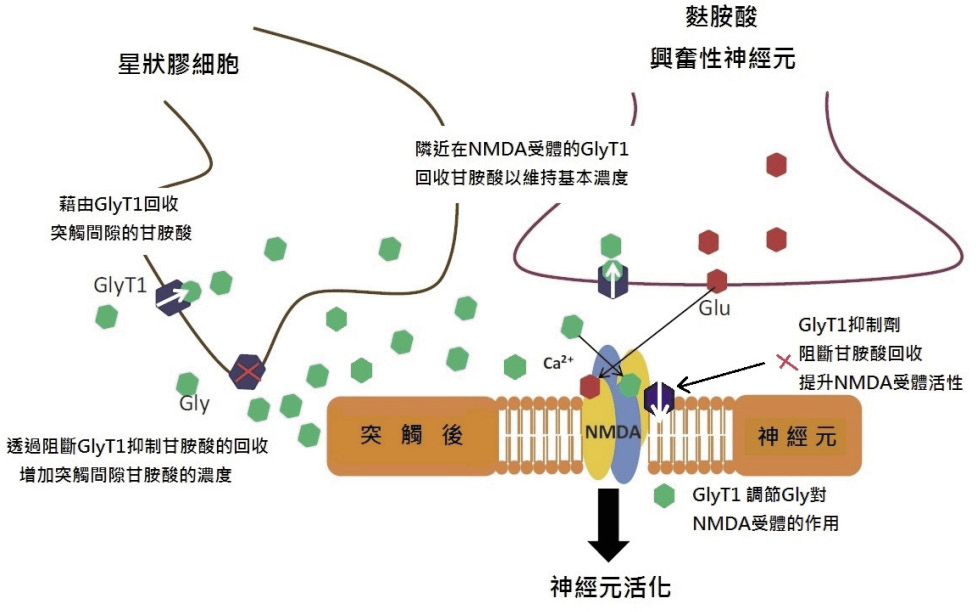
圖三 GlyT1功能及利用 GlyT1抑制劑增加 NMDA 受體活性示意圖
第一個 GlyT1抑制劑是結構近似 glycine 的 sarcosine (N-methylglycine),但因其結構相似,同時也會以非競爭型的方式活化 glycine A site (抑制型神經元),並因具有減緩與受體解離的作用而增加延長作用時間的效果,所以有明顯活化抑制型神經元的副作用 (如:運動活性下降、運動不能、致命性的呼吸抑制作用)。因此非 sarcosine 結構的衍生物也相繼合成 (圖四)4,雖然此類衍生物以競爭型的活化方式進行作用,但在高劑量下仍也是具有提升細胞外 Gly 濃度而有同樣活化抑制型神經元的副作用。
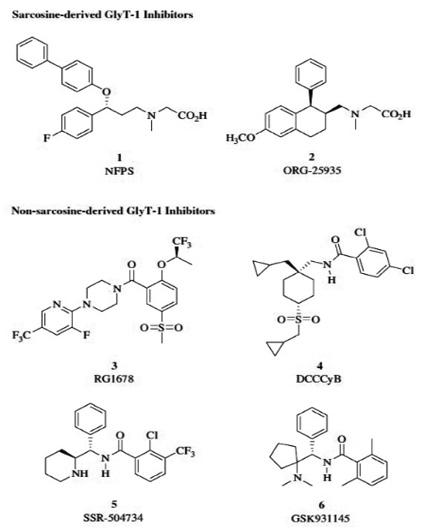
圖四 sarcosine 衍生結構及非-sarcosine 衍生結構的 GlyT-1抑制劑
GlyT1抑制劑如:ALX 5407 (NFPS; N-[3-(4'-fluorophenyl)-3-(4'-phenylphenoxy) propyl]sarcosine)及其衍生物 NPTS、ORG 25935 (cis-Nmethyl-N-(6-methoxy-1-phenyl-1,2,3,4- tetrahydronaphthalen-2-ylmethyl) amino-methylcarboxylic acid hydrochloride),非 sarcosine 衍生物如:bitopertin (RG1678)、SSR 504734、GSK931145的動物實驗中,已證明能藉由提升 NMDAR 活性而改善動物行為模式的正性症狀 (減低 PCP 及 amphetamine 所造成的運動活性上升)、增加大鼠腦部海馬迴區的 Gly 濃度及降低腦部 DA 濃度的效果2。
在符合其治療理論及動物實的結果下,受 NMDARs 影響調控的各種疾病機轉理論也將 GlyT1抑制劑對於中樞性疾病如:思覺失調症、憂鬱症、焦慮症、強迫症…等認為有治療上的效益並進行相關臨床實驗。近年來的研究指出 GlyT1抑制劑也具有神經保護之潛力,可用於泛自閉症障礙症候群 (autism spectrum disorders/ ASD) 外,另對於疼痛、帕金森氏症、癲癇的症狀治療也有幫助3。
肆、 甘胺酸作用劑及 GlyT1抑制劑治療思覺失調症之相關臨床研究
在整理之相關臨床試驗及重要發現之表格 (表二)2,sarcosine 相關項究顯示 GlyT1抑制劑作為抗精神病藥物之佐劑,皆明顯有效地改善負性症狀5-8。在 NMDA 功能減退的假說下,SZ 患者在海馬迴區 (hippocampus) 的麩胺酸傳遞物質 Glx (complex of glutamate, glutamine and GABA) 因神經功能異常而有過度活化的反饋性增加之情形。但在輔助治療後,發現治療組有可視為改善神經元功能而降低 glutamate 活性 (Glx/cr (p = 0.028) Glx/cho (p = 0.042)) 的作用8。
表二 甘胺酸作用劑及 GlyT1抑制劑之相關臨床研究
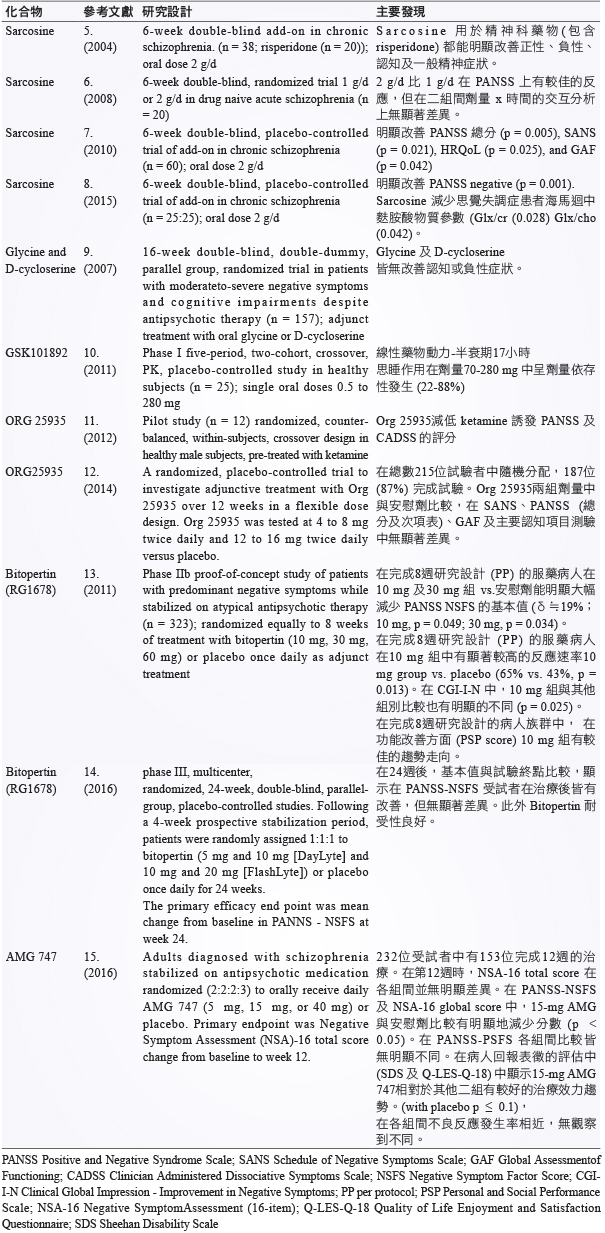
在使用 glycine 及 D-cycloserine 作為治療 SZ 之藥物佐劑時,未有明顯的治療效果9。非 sarcosine 衍生物之 GTI–GSK101892 則在臨床試驗 phase 1中,觀察到劑量依存之不良反應–思睡10。而 ORG25935的臨床試驗中具有降低 ketamine 影響 PANSS 及 CADSS 的效果11,但在合併使用精神科用藥的臨床試驗中卻無任何明顯改善負性症狀的結果12。
在 Bitopertin (RG1678) phase 2試驗中,在完成8週給藥的佐劑試驗有顯著改善 PANSS-NSFS 的效果 (10 mg p = 0.049,30 mg p = 0.032),而其在 NS response rate (p = 0.013) 及 CGI-I-N (p = 0.025) 是以10 mg 呈現較好的治療反應,在此實驗中也提出 Bitopertin 的治療劑量上呈現出倒U曲線的治療效果 (10 mg > 30 mg > 60 mg)13。Bitopertin 再進行為期24週的 phase 3試驗,但遺憾的是並無有效或明顯的治療差異,並且同樣的出現倒U曲線 (5 mg > 10 mg;10 mg > 20 mg) 的治療效應14。註:倒U曲線為治療劑量愈高但治療效果未呈線性上升或飽合,反而因劑量增加而使治療效果下降,而呈現倒U型的治療曲線。
最後一個是為期12週 AMG747的臨床試驗,在治療結果 (5 mg, 15 mg, or 40 mg or placebo.) 在 NSA-16 total score 上無顯著的治療差異。但15 mg AMG747相較於其他劑量上,在 NSA-16 global score 及 PANSS-NSFS 有明顯的差異 (P < 0.05),在 Q-LES-Q18的量表中也顯示15 mg AMG747有較好的治療趨勢。同樣地在 AMG747也呈現倒U曲線的治療效果 (5 mg < 15 mg > 40 mg)15。
伍、 討論
在 NMDA 功能減退的理論下,GylT-1抑制劑作為思覺失調症-負性症狀的輔助治療曾經是符合藥理學上預期且有效的方向,但隨著近年的臨床試驗實驗結果卻不如預期,也因此治療理論也開始被質疑是否為該繼續為負性精神症狀的治療及發展方向。然而在以上實驗結果中發現了倒U曲線的治療效應13-15,除了說明此類藥品在治療的劑量上需依各藥劑提出最適合之治療劑量外,似乎也可能說明了此藥品無效的原因。
我們推論在高劑量或長期使用 GlyT 抑制劑可能會造成 NMDARs 數目的減量調節 (down-regulation),而使原興奮型神經元的傳遞效果回復為基本值,如 bitopertin 在上述表格中為期8週及24週的實驗結果即有戲劇性的不同13-14。此外使用非 sarcosine 衍生物雖能更有效地抑制 GlyT1,但是否也更易造成過度活化而使 NMDARs 減量調節的現象產生。因此如何避免此情況的發生,是此治療理論上需先克服及發展的修正方向。
GlyT1抑制劑在相關中樞性疾病的動物實驗中具有改善及神經保護作用,但運用在其他中樞神經性疾病治療的臨床試驗時,是否同樣也會發生減量調節現象,這是值得注意且可預期的問題。另外 GlyT 抑制劑–sarcosine 改善負性症狀的效果可能不單來自於 NMDARs 的活化,也可能來自於 GlyR 或 GABA 的影響,這或許是 GlyT 抑制劑對其他中樞性疾病有治療潛力的原因之一。
陸、 結論
雖然相較於長期實驗中所能改善的效果不如預期,但此藥物選擇用在急性期的輔助治療也可能會是另一個應用方向,並期待在其他中樞性疾病的應用情形。
Introduction of Glycine Transporter Inhibitor
Hsiang-Sheng Chung, Chi-Jen Lin
Department of Pharmacy, Taipei Veterans General Hospital YuLi Branch
Abstract
Hypofunction of the NMDAR together with dysregulated dopaminergic transmission is thought to contribute to the pathophysiology of schizophrenia. Enhanced the NMDAR function to ameliorate negative symptoms by Glycine transporter inhibitor (GTI) is a predicted pharmacological therapeutic strategy for the management of schizophrenia. In recent clinical studies – Bitopertin (RG1789) phaseIII and AMG747, they doesn’t appear a good expectation for the therapeutic theory. In paper, we introduce the NMDAR and mechanism of GTI that how to enhance NMDAR function and discuss the unexceptional result of clinical studies to reason - NMDAR down regulation. The GTI may be used to ameliorate negative syndrome for a subchronic use despite little evidence to apply in long term therapy. We are look forward to therapeutic results of GTI in other CNS disease.
參考資料:
1.Gary Remington, George Foussias, Gagan Fervaha, et al: Treating Negative Symptoms in Schizophrenia: an Update. Curr Treat Options Psych (2016) 3:133-150.
2. Pierre Chue: Glycine Reuptake Inhibition as a New Therapeutic Approach in Schizophrenia: Focus on the Glycine Transporter 1 (GlyT1). Current Pharmaceutical Design, 2013, 19, 1311-1320
3. Christopher LC, Peter RG: Inhibitors of Glycine Transporter-1: Potential Therapeutics for the Treatment of CNS Disorders. Current Topics in Medicinal Chemistry Volume 16 , Issue 29 , 2016.
4. Christopher LC, Mark AW, Peter R G, et al: Design, synthesis, and SAR of N-((1-(4-(propylsulfonyl)piperazin-1-yl)cycloalkyl)methyl)benzamide inhibitors of glycine transporter-1. Bioorganic & Medicinal Chemistry Letters 23 (2013) 1257-1261.
5. Tsai G, Lane HY, Yang P, et al: Glycine transporter I inhibitor, N-methylglycine (sarcosine), added to antipsychotics for the treatment of schizophrenia. Biol Psychiatry 2004; 55: 452-6.
6. Lane HY, Liu YC, Huang CL, et al: Sarcosine (N-methylglycine) treatment for acute schizophrenia: a randomized, double-blind study. Biol Psychiatry 2008; 63: 9-12.
7. Lane HY, Lin CH, Huang YJ, et al: A randomized, double-blind, placebo-controlled comparison study of sarcosine (Nmethylglycine) and D-serine add-on treatment for schizophrenia. Int J Neuropsychopharmacol 2010; 13: 451-60.
8. Dominik S, Micha, Olga K, et al: Supplementation of antipsychotic treatment with sarcosine - GlyT1inhibitor - causes changes of glutamatergic 1NMR spectroscopy parameters in the left hippocampus in patients with stable schizophrenia. Neuroscience Letters 606 (2015) 7-12.
9. Buchanan RW, Javitt DC, Marder SR, et al: The cognitive and negative symptoms in schizophrenia trial (CONSIST): The efficacy of glutamatergic agents for negative symptoms and cognitive impairments. Am J Psychiatry 2007; 164: 1593-602.
10. Ouellet D, Sutherland S, Wang T, et al: First-time-in-human study with GSK1018921, a selective GlyT1 inhibitor: relationship between exposure and dizziness. Clin Pharmacol Ther 2011; 90: 597- 604.
11. D'Souza DC, Singh N, Elander J, et al: Glycine transporter inhibitor attenuates the psychotomimetic effects of ketamine in healthy males: preliminary evidence. Neuropsychopharmacology 2012; 37:1036-46.
12. Schoemaker JH, Jansen WT, Schipper J, et al: The Selective Glycine Uptake Inhibitor Org 25935 as an Adjunctive Treatment to Atypical Antipsychotics in Predominant Persistent Negative Symptoms of Schizophrenia: Results From the GIANT Trial. Journal of Clinical Psychopharmacology: April 2014 - Volume 34 - Issue 2 - p 190-198.
13. Umbricht D, Martin-Facklam M, Pizzagalli E, et al: Glycine transporter type 1 (GLYT1) inhibition RG1678: Results of the proof-of concept study for the treatment of negative symptoms in schizophrenia. Schiz Bull 2011; 37(1): 324.
14. Dragana BK, Thomas B, Celso A, et al: Bitopertin in Negative Symptoms of Schizophrenia-Results From the Phase III FlashLyte and DayLyte Studies. Biological Psychiatry July 1, 2017; 82:8-16
15. Eduardo D, Robert WB, Chao-Yin C, et al: Efficacy and safety of the glycine transporter type-1 inhibitor AMG 747 for the treatment of negative symptoms associated with schizophrenia. Schizophrenia Research 182 (2017) 90-97.
通訊作者:鍾享昇/通訊地址:花蓮縣玉里鎮新興街91號
服務單位:臺北榮民總醫院玉里分院藥劑科藥師/聯絡電話:(O) 03-8883141 ext 385

