摘要
近年來,癌症的治療快速發展,其中包含單株抗體、標靶治療、免疫療法以及抗體藥物複合體。抗體藥物複合體是一種單株抗體同時結合細胞毒性藥物,擁有單株抗體對於腫瘤的專一性,以及細胞毒性藥物的強度;相較於傳統的化療,較少產生全身性副作用。截至目前,美國 FDA 核准的此類藥物有四個,包含 Mylotarg (Gemtuzumab ozogamicin)、Adcetris (Brentuximab vedotin)、Kadcyla (Trastuzumab emtansine)、Besponsa (Inotuzumab ozogamicin),分別應用於急性骨髓白血病、何杰金氏淋巴瘤、乳癌、急性淋巴白血病。這些藥物應用在轉移、復發或頑固性腫瘤為病人帶來希望,藥師有必要了解這類新型的抗癌藥品,藉以提供病人完整的用藥資訊。
關鍵字: 抗體藥物複合體、頑固性腫瘤、Antibody-drug conjugate、Refractory tumor
壹、前言
抗體藥物複合體的概念最早可於追溯到20世紀初,德國科學家 Paul Ehrlich 所提出的「Magic bullet」,將具有細胞毒性的藥物傳遞到腫瘤細胞表面。約50年後有學者嘗試將 methotrexate (MTX) 和抗體相接,藉以治療白血病,但宣告失敗;直到1975年,Georges Köhler 和 César Milstein 成功製造出單株抗體,也為這個領域開拓新的視野1。
抗體藥物複合體 (Antibody-drug conjugates;ADC),是包含抗體 (Antibody) 和藥物 (Drug),透過連接子 (Linker) 將兩者相連的一類藥物 (圖一),利用單株抗體辨識特定抗原的專一性,搭載著高強度細胞毒性的藥物分子,結合到受體過度表現的癌細胞表面,經由癌細胞將抗體和藥物內生化 (Internalization) 的作用,達到毒殺癌細胞的效果。例如 HER2基因陽性的癌細胞,相較於正常的組織細胞,其細胞膜會過度表現 HER2受體,容易受到刺激而快速生長分裂,透過抗體辨識該受體的專一性,將藥物帶到癌細胞表面。即使有部分藥物可能提早斷裂或是結合到正常細胞的表面受體,但相較於傳統的全身性化療,較能夠避免誤殺正常細胞,降低全身性副作用2,3。本文將簡介抗體藥物複合體的概念和組成,以及目前獲得美國 FDA 核准的四個藥物個論。為方便讀者閱讀,本文部分專有名詞將以縮寫表示 (表一)。
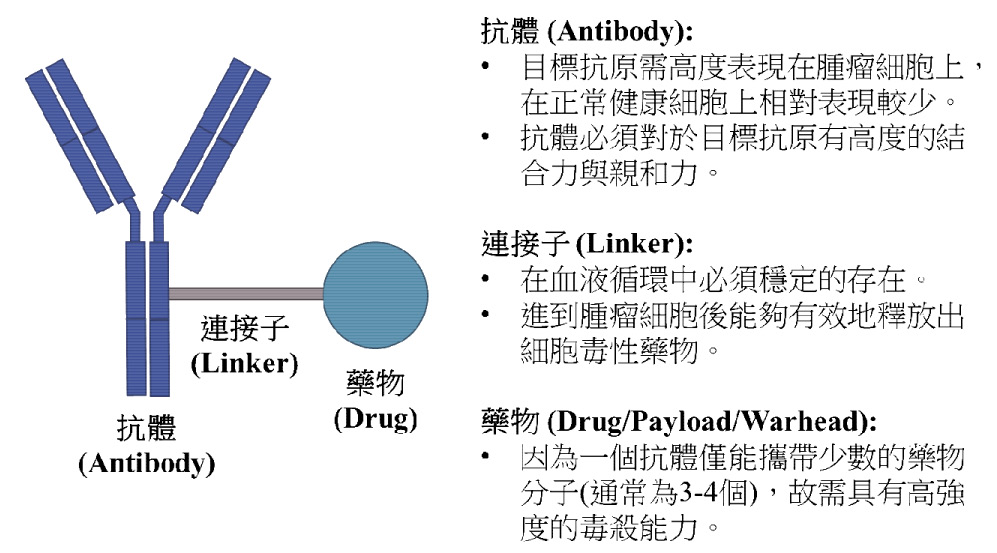
圖一 抗體藥物複合體 (Antibody-drug conjugates) 的基本結構2
表一 名詞縮寫對照表

貳、目標抗原
一個好的目標抗原作為抗體藥物複合體開發的目標,通常具備三個條件:在腫瘤細胞中高度表現且很少或不表現於正常細胞、抗原必須表現在細胞表面得以接觸到抗體、抗原必須能被內生化讓癌細胞攝入藥物。目前在研究中作為目標抗原的種類眾多,有些抗原僅侷限在部分腫瘤類型,如 CD22主要表現於B淋巴球的惡性疾病;有些則廣泛存在於多種腫瘤細胞,如:5T4、mesothelin、CD138於固態腫瘤;SAIL、CD37於血液腫瘤4。其中,mesothelin 高度表現於多種惡性疾病,包括上皮間皮瘤、胰臟癌、膽管腺癌、胃癌、卵巢癌以及非小細胞肺癌,且正常組織僅表現在胸膜、腹膜及心包膜,是一個值得發展的抗原目標2。目前以 mesothelin 為抗原的臨床試驗中藥物,如 Anetumab ravtansine。
參、基本結構介紹1-3
一、抗體 (Antibody)
抗體的組成可依照來源分成第一代及第二代。較早期的第一代抗體為鼠源性抗體 (Murine antibody;命名以-omab 結尾),此種抗體有較高的免疫原性,對人體而言屬於外來的抗體,較易引起人體的免疫反應;第二代的抗體包括人鼠嵌合抗體 (Chimeric antibody;命名以-ximab 結尾) 及人源性抗體 (Humanized antibody;命名以-zumab 結尾),較不容易造成免疫反應,因此目前已核准的 ADC 以及正在臨床試驗中的 ADC 以第二代抗體為主。
二、藥物 (Drug/payload/warhead)
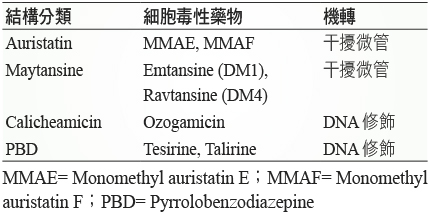
過去曾經使用過 MTX、5-fluorouracil、mitomycin、vinblastine、doxorubicin 等傳統化療藥物嘗試做為 ADC,但都宣告失敗1。目前常被納入研發的藥物依機轉可分為兩類,第一類是干擾微管 (Microtubule disrupting) 在 G2/M 期的聚合,進而抑制有絲分裂,藥物有 auristatin、maytansine;第二類是透過 DNA 修飾 (DNA modifying),結合到 DNA 的 minor groove 進行烷基化或是切開 DNA,直接殺死癌細胞,藥物有 calicheamicin、pyrrolobenzodiazepines (PBD)。目前臨床試驗進行中的藥物以抑制有絲分裂為大宗 (表二)。表所列為 ADC 常使用的細胞毒性藥物,因單獨使用時,細胞毒性較一般傳統化療藥品高出許多,目前僅在 ADC 藥物中使用。
表二 抗體藥物複合體中常使用的細胞毒性藥物2,3
三、連接子 (Linker)
連接子區分為可分解 (cleavable) 及不可分解 (non-cleavable) 兩大類 (表三)。可分解的連接子在循環中維持穩定的狀態,被內生化後,可能受到蛋白酵素,如:Valine-Citrulline 肽鍵,或是酸鹼值,如:Hydrazone 等影響而斷開,釋放出藥物;相反地,不可分解的連接子,則是抗體本身被分解掉,留下帶有連接子的藥物。不可分解的連接子在血液循環中穩定性較高,較不易提前釋放出藥物而造成全身毒性,是其一大優點;至於藥物的半衰期兩者之間沒有顯著差異1。
表三 連接子的種類1

肆、已上市 ADC 藥物介紹
一、 Gemtuzumab ozogamicin (Mylotarg 4.5 mg/vial)
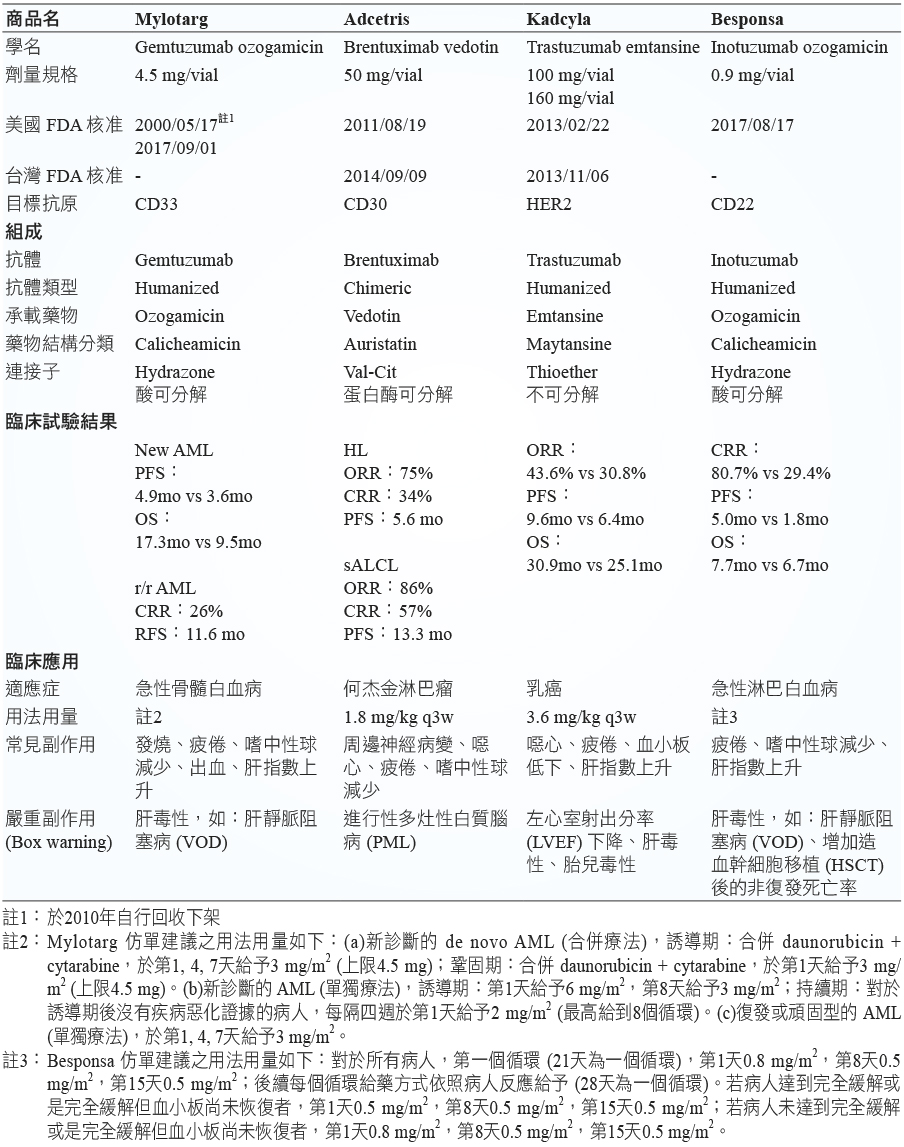
Gemtuzumab ozogamicin 為第一個上市的 ADC 藥物,美國 FDA 於2000年5月17日首次核准,適應症為60歲以上、首次復發、不能接受傳統化學治療,且 CD33呈現陽性的急性骨髓白血病病人。組成包含:IgG4 kappa 抗體,切斷 DNA 的 ozogamicin,以及酸可分解的 hydrazine 連接子。CD33抗原主要表現在芽細胞上,大約80%的 AML 病人呈現 CD33陽性。早期的試驗收集142位首次復發的病人接受每兩週靜脈注射9 mg/m2的藥物,一共兩個劑量,整體緩解率為30%(42/142),其中完全緩解率為16%(23/142)。最被關注的安全性,主要是血液和肝臟毒性,幾乎所有病人發生嗜中性白血球低下 (97%) 及血小板低下 (99%),嚴重度達第三、四級的不良反應,以高膽紅素血症 (23%) 和肝指數上升 (17%) 最為常見5。另一臨床試驗比較 gemtuzumab ozogamicin 有無加入傳統化療 (daunorubicn+cytarabine),發現加入 gemtuzumab ozogamicin 並未改善完全緩解率和整體存活率,且有較高的致命副作用發生 (5.5% v.s. 1.4%)6,因此藥廠於2010年自行下架該藥物。直到2017年9月1日,gemtuzumab ozogamicin 因為重新設計臨床試驗給藥時程、劑量、頻次,呈現正向結果 (表四),重新獲得美國 FDA 核准,用在新診斷及復發或頑固型 AML。新診斷 AML 使用 gemtuzumab ozogamicin 單一藥物治療,相較於支持性療法,延長 OS (4.9個月 v.s. 3.6個月)7。Gemtuzumab ozogamicin 亦能合併傳統化療 (daunorubicn+cytarabine),延長 PFS (17.3個月 v.s. 9.5個月)8。另外一篇較小規模的試驗,收錄57名復發或頑固型的病人,單獨使用 gemtuzumab ozogamicin 3 mg/m2 on D1, D4, D7治療,CRR 為26%,並持續11.6個月沒有復發9。
表四 美國 FDA 核准的四個抗體藥物複合體比較表
二、 Brentuximab vedotin (Adcetris 50 mg/vial)
美國 FDA 於2011年8月19日核准 Brentuximab vedotin,適應症為治療 CD30陽性的復發或頑固型何杰金氏淋巴瘤及全身性退行分化型大細胞淋巴瘤 (systemic anaplastic large cell lymphoma;sALCL)。組成包含:IgG1 抗體,干擾微管的 MMAE,以及蛋白酶可分解的 Valine-Citrulline 肽鍵連接子。一篇收錄102人的二期臨床試驗,針對經過自體幹細胞移植的 HL 的病人,每三週靜脈注射1.8 mg/m2,最多16次,ORR 達到75%,CRR 為34%;PFS 為5.6個月。安全性方面,周邊神經病變 (42%)、噁心 (35%)、疲倦 (34%) 為常見副作用,其中較嚴重的副作用為嗜中性白血球低下10。另一篇收錄58人的二期臨床試驗,針對先前至少接受過一種治療的 sALCL 病人,每三週給予1.8 mg/m2,ORR 達到86%,其中 CRR 為57%,PFS 為13.3個月11。
三、 Trastuzumab emtansine (Kadcyla 100 mg/vial;160 mg/vial)12
美國 FDA 於2013年2月22日核准 Trastuzumab emtansine,適應症為治療 HER2陽性且之前曾接受過 trastuzumab 與 taxane 藥物治療的轉移性乳癌病人。組成包含:IgG1抗體,干擾微管的 emtansine,以及不可分解的硫醚連接子。Trastuzumab (Herceptin) 本身是一個治療 HER2陽性乳癌的單株抗體;透過 ADC 的設計,trastuzumab emtansine 能夠做為更後線的乳癌治療。在 EMILIA 試驗中,一共收錄991位先前使用過 trastuzumab 和 taxane 的病人,隨機分配到 trastuzumab emtansine 組或是 lapatinib+capecitabine 組,以 PFS 和 OS 為主要臨床試驗終點,結果顯示兩組 PFS 中位數分別為9.6個月及6.4個月 (HR = 0.65; P < 0.001);OS 中位數的期中分析 (interim analysis) 為30.9個月及25.1個月 (HR = 0.68; P < 0.001);trastuzumab emtansine 組在任何原因造成的死亡風險較低 (HR = 0.68; P < 0.001),其他次要臨床試驗終點在 trastuzumab emtansine 組結果均較佳。安全性方面,trastuzumab emtansine 發生血小板低下 (28.0% v.s. 2.5%) 和肝指數上升的副作用 (ALT: 16.9% v.s. 8.8%;AST: 22.4% v.s. 9.4%) 均較高,建議每次給藥前檢查 AST、ALT、膽紅素以及血小板數目;反之,trastuzumab emtansine 則較少發生腹瀉 (23.3% v.s. 79.7%)、手足症候群 (1.2% v.s. 58.0%) 等副作用。
四、 Inotuzumab ozogamicin (Besponsa 0.9 mg/vial)13
美國 FDA 於2017年8月17日核准 Inotuzumab ozogamicin,適應症為治療復發或頑固型的B細胞急性淋巴白血病。組成包含:IgG4 kappa 抗體,切斷 DNA 的 ozogamicin,以及酸可分解的 hydrazine 連接子。CD22為B細胞急性淋巴白血病常表現的一種抗原,因此透過辨識 CD22抗原來治療此類型白血病。在 INO-VATE ALL 第三期臨床試驗中,一共納入326位復發或頑固型 ALL 的病人,隨機分配到 inotuzumab ozogamicin 組或是標準化學治療組,以 CRR 及 OS 為主要臨床試驗終點。結果顯示兩組 CRR 分別為80.7%及29.4% (P < 0.001);OS 分別為7.7個月及6.7個月 (HR = 0.77; P = 0.04),前者皆優於後者。安全性方面,inotuzumab ozogamicin 有較高的肝臟方面副作用,例如:肝靜脈阻塞疾病 (Veno-occlusive disease;VOD),兩組的發生率分別為11%和1%。
伍、結語
近年來癌症藥物的發展日新月異,癌細胞表面的抗原陸續被發現,加上單株抗體技術更加成熟,藥物能夠更準確的作用在癌細胞,而降低副作用。抗體藥物複合體結合了單株抗體的專一性以及化療藥物的作用強度,集兩者的優點於一身,應用於急性骨髓白血病、何杰金淋巴瘤、乳癌、急性淋巴白血病之治療。目前有超過四十個正在執行試驗的藥物2,展望未來,能否繼續有藥品核准上市,更廣泛應用在臨床治療,值得藥師關注。
Application of Antibody-drug Conjugates in the Treatment of Malignancy
Yu-Chuan Chang1, Hung-Yi Chen1, Pheng-Ying Yeh1, Chia-Cheng Lai2
Department of Pharmacy, National Cheng Kung University Hospital1
School of Pharmacy, National Cheng Kung University2
Abstract
During the past years, the number of alternative ways of treating cancer is rapidly growing, including monoclonal antibody, targeted therapy, immunotherapy and antibody-drug conjugates (ADC). Antibody-drug conjugate consists of a monoclonal antibody conjugated to a cytotoxic agent via a linker. ADCs have tumor specificity from monoclonal antibodies and high potency from cytotoxic agents. Compared with conventional chemotherapy, they may have less systemic adverse effects. So far, there are four drugs approved by FDA, including gemtuzumab ozogamicin, brentuximab vedotin, trastuzumab emtansine and inotuzumab ozogamicin, respectively indicated for acute myeloid leukemia, non-Hodgkin lymphoma, metastatic breast cancer and acute lymphoblastic leukemia. The use of these drugs offers hope for patients with metastases or relapsing/refractory tumors. Pharmacists have to know these brand-new anticancer drugs and provide patients complete drug information.
參考資料:
1.Perez HL, Cardarelli PM, Deshpande S, et al: Antibody-drug conjugates: current status and future directions. Drug Discov Today. 2014; 19(7):869-81.
2. Thomas A, Teicher BA, Hassan R: Antibody-drug conjugates for cancer therapy. Lancet Oncol. 2016; 17(6):e254-e262.
3. Lambert JM, Morris CQ: Antibody-Drug Conjugates (ADCs) for Personalized Treatment of Solid Tumors: A Review. Adv Ther. 2017; 34(5): 1015-1035.
4. Beck A, Goetsch L, Dumontet C, et al: Strategies and challenges for the next generation of antibody-drug conjugates. Nat Rev Drug Discov. 2017 May;16(5):315-337.
5. Sievers EL, Larson RA, Stadtmauer EA, et al: Efficacy and safety of gemtuzumab ozogamicin in patients with CD33-positive acute myeloid leukemia in first relapse. J Clin Oncol. 2001; 19(13):3244-54.
6. Petersdorf SH, Kopecky KJ, Slovak M, et al: A phase 3 study of gemtuzumab ozogamicin during induction and postconsolidation therapy in younger patients with acute myeloid leukemia. Blood. 2013; 121(24): 4854-4860.
7. Amadori S, Suciu S, Selleslag D, et al: Gemtuzumab Ozogamicin Versus Best Supportive Care in Older Patients With Newly Diagnosed Acute Myeloid Leukemia Unsuitable for Intensive Chemotherapy: Results of the Randomized Phase III EORTC-GIMEMA AML-19 Trial. J Clin Oncol. 2016; 34(9):972-9.
8. Castaigne S, Pautas C, Terré C, et al: Effect of gemtuzumab ozogamicin on survival of adult patients with de-novo acute myeloid leukaemia (ALFA-0701): a randomised, open-label, phase 3 study. Lancet. 2012; 379(9825):1508-16.
9. Taksin AL, Legrand O, Raffoux E, et al: High efficacy and safety profile of fractionated doses of Mylotarg as induction therapy in patients with relapsed acute myeloblastic leukemia: a prospective study of the alfa group. Leukemia. 2007;21(1):66-71.
10. Younes A, Gopal AK, Smith SE, et al: Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin's lymphoma. J Clin Oncol. 2012; 30(18):2183-9.
11. Pro B, Advani R, Brice P, et al: Brentuximab vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: results of a phase II study. J Clin Oncol. 2012; 30(18):2190-6.
12. Verma S, Miles D, Gianni L, et al: Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med. 2012; 367(19):1783-91.
13. Kantarjian HM, DeAngelo DJ, Stelljes M, et al: Inotuzumab Ozogamicin Versus Standard Care for Acute Lymphoblastic Leukemia. N Engl J Med. 2016; 375(8):740-53.
通訊作者:張育銓/通訊地址:台南市勝利路138號
服務單位:成功大學醫學院附設醫院藥劑部藥師/聯絡電話:(O) 06-2353535 ext 5693

