摘要
腹膜轉移在胃癌、大腸直腸癌及卵巢癌晚期或復發的病人是常見徵兆。腫瘤減量手術和腹腔內溫熱化療對於符合條件之病人能增加總體存活率,因此成為腹膜癌轉移的標準治療。腹腔內化療包含前導性腹腔內化療、腹腔內加壓氣霧化療、腹腔內溫熱化療和術後早期腹腔內化療等不同時機或方式的治療。腹腔內化療的效果與許多因素有關,包含加熱與否、藥品種類和其藥物動力學及藥效學等。本文將討論各種腹腔內之化學治療,以瞭解其治療策略。
關鍵字: cytoreductive surgery (CRS)、neoadjuvant intraperitoneal systemic chemotherapy (NIPS)、early postoperative intraperitoneal chemotherapy (EPIC)、hyperthermic intraperitoneal chemotherapy (HIPEC)、intraperitoneal chemotherapy (IPC)、pressurized intraperitoneal aerosol chemotherapy (PIPAC)
壹、前言
腹腔內化療 (intraperitoneal chemotherapy,IPC) 最早源自1955年 Weisberger 等人使用氮芥劑 (nitrogen mustard) 治療擴散至肋膜及腹膜的腫瘤1。腹膜癌包含原發性腹膜癌 (primary peritoneal carcinoma)、腹膜假性黏液瘤 (pseudomyxoma peritonei,PMP)、腹膜間質瘤 (peritoneal mesothelioma) 等。而腹膜轉移癌 (peritoneal carcinomatosis) 為腫瘤轉移至腹膜腔所致,常見包含胃癌、大腸直腸癌及卵巢癌,另少數如肝膽癌、胰臟癌、子宮癌及泌尿道癌等也會發生。
對於腹膜癌或腹膜轉移癌的病人,僅給予靜脈化療效果不佳,主因是血管腹膜障壁 (blood-peritoneal barrier) 厚約90 µm,阻礙藥品從血管進入腹膜腔,而無法達到有效治療。若提高靜脈給藥劑量相對會增加化療藥品全身毒性及副作用,直接進行腹腔內化療的治療方式不但療效更好也不會增加全身毒性。目前腫瘤減量手術 (cytoreductive surgery,CRS) 合併腹腔內溫熱化療 (hyperthermic intraperitoneal chemotherapy,HIPEC) 已是腹膜轉移癌的標準治療,一項研究統計顯示有33.6%病人發生 Grade 3-4級併發症及4.1%死亡率2,因此必須嚴格挑選手術對象。
貳、腹腔內化療目的
腹腔內化療依治療目的可分為兩類,一是積極治療 (aggressive therapy),目的是將腫瘤完全消滅,達到根治治療 (radical therapy) 效果,一般多合併 CRS 使用;另一類是消極的緩和治療 (palliative therapy),用於無法治癒之病人,目的是緩解病人症狀,減輕其痛苦。
腹膜癌或腹膜轉移癌可利用腹腔鏡抽取腹水或腹腔灌洗,藉由細胞學檢查確認是否有腹膜游離癌細胞 (peritoneal free cancer cells,PFCCs) 的存在,而電腦斷層掃瞄儀等影像學要能檢查出腫瘤大都已超過1 cm,此時僅靠腹腔內化療已無法達到有效治療,因藥品無法穿透到腫瘤最內層,故積極治療方式須配合 CRS 讓殘留腫瘤儘可能變小,以利化療藥品能發揮最大效果。是否執行 CRS 的一個重要指標就是腹膜癌指數 (peritoneal cancer index,PCI),計算方式是將腹膜腔區域分13個區域,每個區塊依腫瘤大小分別以0-3分來表示,之後加總而得,最大分數為39分,其主要作為預後的評估。以胃癌腹膜轉移的研究,PCI 介於7-12病人1年與3年的中位存活率為65%及18%,而 PCI 介於13-19則降至35%及0%,因此積極實施 CRS 治療的胃癌病人 PCI 建議 ≦ 123。卵巢癌腹膜轉移病人的 PCI 甚至 ≦ 10,因其5年整體存活率 (overall survival,OS) 為70%,遠較 PCI 介於11-20及 > 20的30%及28%高許多 (P值 = 0.012)4。實施 CRS 後的程度則以減量達成度分數 (Completeness of cytoreduction (CC)score) 來呈現:CC-0是表示清除所有肉眼可見的腫瘤,CC-1殘留腫瘤 < 2.5 mm,CC-2殘留腫瘤介於2.5 mm-2.5 cm,CC-3殘留腫瘤 > 2.5 cm。分數至少要能達到 CC-1,才能讓部分化療藥品完全穿透殘留腫瘤內部,達到積極治療效果。如果能達到 CC-0,則預後會更好,但手術時間會拉長,對於手術團隊及病人負擔更大,能否達成,則是一大考驗。
當作為緩和治療時,也可使用不同方式之腹腔內化療,改善如腹水等症狀,以緩解病人之不適等。
參、腹腔內化療方式
一、 CHPP (continuous hyperthermic peritoneal perfusion;持續腹腔溫熱灌注)
1988年由日本 Koga 等人發表的治療方式,當時將藥品 mitomycin C 64-100 mg 配置成8-12 L溶液,經過機器加熱後利用管路流入腹膜腔,再由其他管路流出至收集袋內,藉此方式預防胃癌術後腹膜的轉移5。
二、 NIPS (neoadjuvant intraperitoneal systemic chemotherapy;前導性腹腔內及全身性化療)
2004年由日本 Yonemura 等人發表的治療方式,屬於新的雙向性化學治療 (bidirectional chemotherapy),其方式是利用腹腔內合併全身性 (包含靜脈及口服) 不同途徑給予化療藥品,利用內外夾攻方式治療腹膜轉移癌,目的是希望消滅 PFCCs,並降低 PCI 的分數,以期後續能實施 CRS6。
Bidirectional intraperitoneal and systemic induction chemotherapy (BISIC,腹腔內及全身性雙向誘導化療) 為廣義雙向性化學治療,臨床應用包含 CRS + HIPEC 術前 NIPS、術中配合 HIPEC 使用的 HIPEC plus 及術後 adjuvant bidirectional chemotherapy (ABS) 等均屬此方式。
三、 EIPL + chemotherapy (extensive intraoperative peritoneal lavage and chemotherapy;術中大量腹腔沖洗合併化療)
術中大量腹腔沖洗是2002年由日本 Shimada 等人發表關於治療胃癌的方式,在執行根除手術之前與之後,以1公升的生理食鹽水沖洗腹腔後再完全抽出,分別重複3次及7次,全部完成後再實施腹腔內化療。其目的是藉由有限稀釋法 (limiting dilution method) 重複沖洗降低 PFCCs,這方法很簡單、不需耗費很多時間及費用,確能有效降低胃癌腹膜之轉移7。
四、 EPIC (early postoperative intraperitoneal chemotherapy;術後早期腹腔內化療)
術後早期腹腔內化療是1990年由 Sugarbaker 等人提出,早期是指 CRS 術後24小時內,連續實施5天的腹腔內化療,目的是希望在傷口癒合前,將術後殘留於縫合處或傷口的 PFCCs 一併消滅,以降低轉移的可能。1998年由 Yu 等人發表 stage III 胃癌病人胃切除手術後加上 EPIC 與單獨手術相比,兩者5年存活率分別為49.1%及18.4%(P值 = 0.011)8。
五、 HIPEC (hyperthermic intraperitoneal chemotherapy;腹腔內溫熱化療)
1980年 Spratt 等人發表對一名患有 PMP 的35歲男性,先靜脈給予 thiotepa 5天後,再以腹腔內方式給予加熱之 methotrexate 作為治療,成為人類腹腔內溫熱化療之首例9。HIPEC 是在 CRS 後執行,依據腹部開放程度分為封閉式 (closed)、開放式 (open) 及半封閉式或半開放式 (semi-closed or semi-open) 等三種10。但無論是何種技術都會利用熱協同作用,將化療藥品升溫至41-43℃,不但可以利用熱毒殺腫瘤,更可以增加藥品穿透組織的能力,達到更佳的療效。
(一) 封閉式腹腔技術 (closed abdominal technique)
在執行 CRS 後腹部尚未縫合前,先放置管路將傷口完全縫合使腹腔成為密閉空間,此方式能增加腹膜腔內壓力,提升藥品穿透組織能力,並可避免藥品外流及揮發,保護操作人員安全,使溫熱效果容易維持10。早期封閉式 HIPEC 只有留藥品進出之管路,醫師無法查看腹膜腔內情況,且有藥品及溫度分布不均或管路阻塞無法立即排除等缺點。近期封閉式技術已改良 (如後面所提 LHIPEC 等),試圖克服上述之缺點。
(二) 開放式腹腔技術 (open abdominal technique)
最早未開發輔助裝具時,在 CRS 後腹部仍未縫合時,即將藥品灌注至腹膜腔。此法容易造成藥品外濺或外溢,傳統化療藥品又都屬於高危害性藥品,嚴重影響操作人員安全。1990年 Fujimura 等人發表使用 peritoneal cavity expander (PCE;腹膜腔擴張器) 裝置,1999年 Sugarbaker 發表 Coliseum technique (開放式技術),均是利用不同加高方式克服藥品外溢的缺點。開放式的優點是醫師能看到治療情況,並可直接對特定部位加強治療,讓溫度及藥品平均接觸各部位,缺點是溫熱效果不易維持及化療藥品經加熱後更容易揮發,進而增加現場人員吸入之風險10。
(三) 半封閉式或半開放式腹腔技術 (semi-closed or semi-open abdominal technique)
此技術保留部分能讓手部穿透的透明裝置,將其覆蓋於原開放的腹部,結合封閉式及開放式的優點,不但阻隔藥品,避免外濺或外溢,也方便醫師瞭解化療執行情況,能伸入攪拌或加強特定部位之處理等10。
六、 LHIPEC (laparoscopic hyperthermic intraperitoneal chemotherapy;腹腔鏡腹腔內溫熱化療)
2006年由 Garofalo 等人發表的治療方式,其利用腹腔鏡實施診斷、摘除、評估 PCI 及處理腹水時,另行鑽開數個小洞置入管路執行封閉式的 HIPEC,此方式可以降低 PCI 的分數及消滅 PFCCs11。LHIPEC 與 HIPEC (含下列所述 LEHIPEC) 最大差異是不需要剖腹,故 LHIPEC 可以在施行 CRS + HIPEC 之前使用,稱為 NLHIPEC (neoadjuvant laparoscopic hyperthermic intraperitoneal chemotherapy;前導性腹腔鏡腹腔內溫熱化療)。LHIPEC 也可以單獨作為緩和性化療使用。
七、 LEHIPEC (laparoscopy-enhanced hyperthermic intraperitoneal chemotherapy;升級版腹腔鏡腹腔內溫熱化療)
2016年由 Lotti 等人發表,在 CRS 後利用能讓內視鏡及藥品進出的特殊裝置實施封閉式 HIPEC,此方式稱為 LEHIPEC12。特色是利用內視鏡進一步攪拌藥品使溫度與藥品得以保持平均分佈,以加強封閉式 HIPEC 的療效。
八、 PIPAC (pressurized intraperitoneal aerosol chemotherapy;腹腔內加壓氣霧化療)
2000年由 Reymond 等人發表利用氣霧化藥品技術實施治療性腹腔積氣 (therapeutic pneumoperitoneum),該技術有可能作為局部腫瘤之治療使用。直到2012年 Solass 等人描述相關儀器並讓該技術用於腹腔內化療。之後的臨床研究證實以氣霧化狀態給予比起液態灌注而言,組織穿透深度更好13。PIPAC 利用二氧化碳將藥品氣霧化,所需藥品劑量僅約為一般全身性治療劑量的10%,並藉由腹腔鏡觀察穿刺套管噴出藥品的治療情況,其優點是不會有明顯的肝、腎毒性及腸胃道症狀。PIPAC 不需要剖腹,可作為 CRS + HIPEC 術前的前導性化療使用,以期降低病人 PCI 的分數,也能做為緩和性治療使用13。
肆、藥品使用
會影響 IPC 治療之因素包含腹膜腔壓力、藥品分子大小及結構、藥品穿透程度、給藥劑量、留滯時間、AUC ratio (腹膜腔內濃度/血液濃度比) 及是否合併加熱或其他藥品等。以 HIPEC 來說,封閉式可以增加腹膜腔內壓力,相對藥品穿透腫瘤深度也能增加。分子大小及脂溶性等會影響 AUC ratio,AUC ratio 越高表示藥品留在腹膜腔內比例越高,而血中濃度較少影響其他部位也較小,故 AUC ratio 較高的藥品如 docetaxel、doxorubicin、5-fluorouracil、gemcitabine 及 paclitaxel 較適合用於 IPC。以穿透程度而言,cisplatin 與 oxaliplatin 穿透腫瘤效果可達1-2 mm 最好,在 CC-1殘留腫瘤 < 2.5 mm 的情況下,較其他藥品更適合作為選擇用藥。有熱協同作用的 cisplatin、mitomycin c 及 oxaliplatin 等用於 HIPEC 時則有加乘效果 (表一)14。
表一 應用於腹腔內化療之藥品14
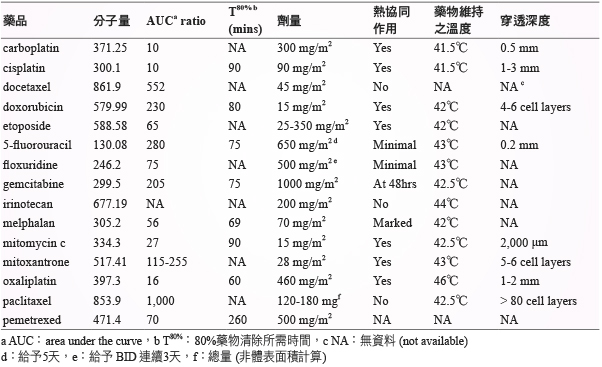
惟各種癌症治療仍須藉由臨床試驗證實其療效,無法統一適用,因此不同腹膜轉移癌在相同的 IPC 方式選擇用藥也會有差異 (表二)。
表二 不同癌症應用於 HIPEC 之藥品選擇建議15

伍、結論
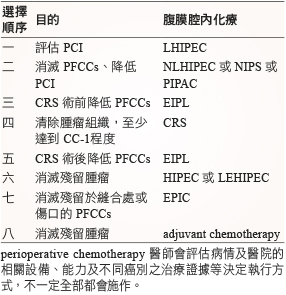
藥師須瞭解使用 IPC 的治療目的及方式 (表三),並掌握病人對治療的反應,如醫師希望藉由前導性化療降低 PCI 的分數,以期後續能執行 CRS,但可能經過多次術前化療仍無法符合執行 CRS 標準,只能轉為緩和治療。如此藥師才能在藥事照顧服務時對病人進行完整的用藥評估 (包含藥品選擇之適當性及劑量等),並於衛教時傳遞給病人最適切的資訊。
表三 腹膜轉移癌治療選擇
Intraperitoneal Chemotherapy
Chien-Cheng Lee, Li-Wen Sun, Chih-Wei Huang, I-Hsun Li
Department of Pharmacy Practice, Tri-Service General Hospital
Abstract
Peritoneal metastasis is a common sign of advanced tumor stage or tumor recurrence in patients with gastric cancer, colorectal cancer and ovarian cancer. Cytoreductive surgery (CRS) and hyperthermic intraperitoneal chemotherapy (HIPEC) can improve overall survival in selected patients, and therefore have become the standard treatment for peritoneal carcinomatosis. Different regimens of intraperitoneal chemotherapy include neoadjuvant intraperitoneal chemotherapy, pressurized intraperitoneal aerosol chemotherapy, HIPEC and early postoperative intraperitoneal chemotherapy. The efficacy of treatment with intraperitoneal chemotherapy is dependent on the multiple factors including the level of hyperthermia, the chosen drugs and its pharmacokinetics and pharmacodynamics. The review will discuss the various intraperitoneal chemotherapy in order to understand its therapeutic strategy.
參考資料:
1.Weisberger AS, Levine B, Storaasli JP: Use of nitrogen mustard in treatment of serous effusions of neoplastic origin. JAMA. 1955; 159:1704-1707.
2. Glehen O, Gilly FN, Boutitie F , et al: Toward Curative Treatment of Peritoneal Carcinomatosis From Nonovarian Origin by Cytoreductive Surgery Combined With Perioperative Intraperitoneal Chemotherapy. Cancer. 2010 Dec 15; 116(24): 5608-18.
3. Coccolini F, Catena F, Glehen O, et al: Complete versus incomplete cytoreduction in peritoneal carcinosis from gastric cancer, with consideration to PCI cut-off. Systematic review and meta-analysis. Eur J Surg Oncol. 2015 Jul; 41(7): 911-9.
4. Llueca A, Escrig J, MUAPOS working group: Prognostic value of peritoneal cancer index in primary advanced ovarian cancer. European Journal of Surgical Oncology. 2018; 44(1): 163-169.
5. Koga S, Hamazoe R, Maeta M, et al: Prophylactic Cancer Therapy for Peritoneal Recurrence of Gastric by Continuous Hyperthermic Peritoneal Perfusion With Mitomycin C. Cancer. 1988; 61: 232-237.
6. Yonemura Y, Elnemr A, Endou Y, et al: Treatment results of peritoneal dissemination from gastric cancer by neoadjuvant intraperitoneal-systemic chemotherapy. Gan To Kagaku Ryoho. 2004 Oct; 31(11): 1723-6.
7. Shimada S, Tanaka E, Marutsuka T, et al. Extensive intraoperative peritoneal lavage and chemotherapy for gastric cancer patients with peritoneal free cancer cells. Gastric Cancer. 2002; 5: 168-172.
8. Yu W, Whang I, Suh I, et al: Prospective Randomized Trial of Early Postoperative Intraperitoneal Chemotherapy as an Adjuvant to Resectable Gastric Cancer. Ann Surg. 1998 Sep; 228(3): 347-54.
9. Spratt JS, Adcock RA, Muskovin M, et al: Clinical Delivery System for Intraperitoneal Hyperthermic Chemotherapy. Cancer Research. 1980; 40: 256-60.
10. Glehen O, Cotte E, Kusamura S, et al: Hyperthermic Intraperitoneal Chemotherapy: Nomenclature and Modalities of Perfusion. J Surg Oncol. 2008 Sep 15; 98(4): 242-6.
11. Garofalo A, Valle M, Garcia J, et al: Laparoscopic intraperitoneal hyperthermic chemotherapy for palliation of debilitating malignant ascites . Eur J Surg Oncol. 2006 Aug;32(6):682-5.
12. Lotti M, Giulii Capponi M, Campanati L, et al: The Onset of Intra-Abdominal Adhesions During Closed-Abdomen Hyperthermic Intraperitoneal Chemotherapy. J Laparoendosc Adv Surg Tech A. 2016 Dec; 26(12): 997-1002.
13. Grass F, Vuagniaux A, Teixeira-Farinha H, et al: Systematic review of pressurized intraperitoneal aerosol chemotherapy for the treatment of advanced peritoneal carcinomatosis. Send to Br J Surg. 2017 May; 104(6): 669-678.
14. Sugarbaker PH, Van der Speeten K: Surgical technology and pharmacology of hyperthermic perioperative chemotherapy. J Gastrointest Oncol. 2016 Feb; 7(1): 29-44.
15. Reese W. Randle , Konstantinos I. Votanopoulos , Perry Shen, et al: Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy. In: Quyen D. Chu, John F. Gibbs, Gazi B. Zibari, eds. Surgical Oncology, 2015th ed. New York, Springer Science+Business Media, 2015: 491-512.
通訊作者:李建澄/通訊地址:台北市內湖區成功路二段325號
服務單位:三軍總醫院臨床藥學部藥師/聯絡電話:(O) 02-87923311 ext 17636

