摘要
根據衛生福利部疾病管制署的最新資料顯示,105年幼兒各項預防接種 (含B型肝炎,五合一疫苗,水痘疫苗等7種常見疫苗) 完成率已高達9成。疫苗的接種已成為台灣國人常見及接受度高的預防疾病的方式。國內也已有本土開發的數種疫苗取得藥品許可證上市,供應公費及自費的疫苗市場。但台灣目前仍多仰賴國外輸入疫苗,故在疫苗的藥品許可證申請及研發上會影響國內疫苗的供應。台灣衛生福利部陸續公告相關法規以銜接國際法規,並於近年公告生物藥品得以一廠多證等新公告,試圖舒緩國內疫苗短缺的現象。本文將綜論國內疫苗法規的發展現況,並另舉流行性疫苗年度病毒株變更的法規要求為例,說明台灣目前疫苗法規規範。
關鍵字: 疫苗、藥品查驗登記、流感疫苗病毒株換株、Drug registration、Strain update
壹、前言
疫苗的發展如新藥般往往花費許多的時間,研發的製造廠多為國際知名大藥廠。疫苗製造廠必須證明他們的疫苗是安全有效且可提供一致且穩定的生產。在藥品的查驗登記部分,臨床前 (pre-clinical) 的資料必須建立疫苗的特性,並確保其潛在的風險性須小於其好處。臨床試驗 (clinical) 的資料必須按照新藥開發的過程,一開始需要先用在較少的受試者身上,偵測疫苗的安全性及免疫性 (Immunogenicity),稱為 phase I study。再來執行更大的臨床試驗,獲得更多的安全性及免疫性的資料。並建立用法用量的範疇,稱為 phase II study。最後再執行大型臨床試驗,定義該疫苗的安全性、免疫性及療效性,稱為 phase III study。此外,疫苗的製造廠在疫苗核准前必須經過查核 (inspection),以確立疫苗的生產狀況。疫苗核准上市後,衛生主管機關也會要求執行相關上市後研究 (Post-marketing safety and efficacy studies),稱為 phase IV study,必須經過後續性的查核,疫苗產品進口以封籤檢驗 (local release) 的程序來確保該疫苗品質符合上市前的研究所設立的參數 (parameters)。國際上主要參考的疫苗法規 (guidance) 乃依照各國自行制定,如美國 FDA、歐洲的 CPMP (the Committee on Proprietary Medicinal Products),或參考國際的法規,如 WHO (World Health Organization) 之要求1-3。
貳、國內疫苗法規總論
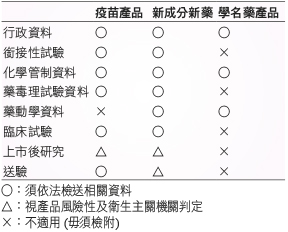
在台灣,早於民國91年1月31日當時的衛生署即針對疫苗產品,公告『藥品查驗登記審查準則-疫苗藥品之查驗登記』4。該法規總論疫苗查驗登記時有關化學管制、藥毒理學、藥動學、封簽檢驗的相關要求。同時,須依照查驗登記審查準則第41條附件六及附件七檢附相關資料進行查驗登記5。有關疫苗的製造廠比照生物藥品的規定,依產品品項及製造項目做管控。疫苗產品於上市前或核准後皆必須經過衛生福利部研究檢驗組進行檢驗。於合格之後才能進行核准或放行至國內醫療院所。在法規的嚴謹度而言,較新成分新藥要求更為嚴謹。表一為疫苗產品,新成分新藥及學名藥在台灣查驗登記法規之比較。表二則為國內研發之國產疫苗產品。
表一 台灣疫苗產品,新成分新藥及學名藥在台灣查驗登記法規之比較
表二 國內已核准的國產疫苗

參、生物藥品一廠多證最新法規
台灣藥品許可證管理,由於審查人力不足及相關系統構置不及。多年來都是一個製造廠核發一張許可證 (一廠一證) 方式進行管理,與歐美各國核准藥品可多廠一證之方式不同。以往的管理方式對於生物藥品而言則是大大的限縮藥品來源。尤其在疫苗產品部份則是影響了國內防疫環境。為了增加生物藥品的生產規模、提高產品供貨的穩定性,台灣衛生福利部於104年10月16日公告”生物藥品許可證得同時刊載一家以上製造廠”,也就是一產品有多製造廠 (multiple sites),未來的生物藥品 (含疫苗) 將不限制一廠一證,這也是台灣藥政的一大改革2。表三列舉新公告後核准多製造廠 (multiple sites) 的疫苗產品。
表三 國內核准多製造廠 (multiple sites) 的疫苗產品

肆、流感疫苗病毒株變更最新進展
季節性流感主要是A型及B型流感病毒所引起的急性呼吸道疾病。由於流感病毒每年都可能發生變異,因此世界各國的衛生單位皆建議每年皆必須接種一次的季節性流感疫苗 (seasonal influenza vaccine, SIV)。每年世界衛生組織 (World Health Organization, WHO) 於二月至三月會召開專家會議,根據前一年流行資料預測北半球下一季可能造成流行的病毒株,並供世界各國法規單位與疫苗廠所使用的病毒株做建議。疫苗廠在經過研發製造階段後,於每年的第二季或第三季提出季節性病毒株變更的申請。國內針對疫苗季節性病毒株變更的法規在查驗登記審查準則第69條,規範疫苗廠必須提供相對應的化學管制標準資料及臨床資料進行申請。因應國內疾病管制署的建議,流感疫苗病毒株變更必須在每年9月之前獲得變更核准,才趕得及於每年入冬前 (10月) 開始供給國人施打,目前公費疫苗的供應,為三價 (三株病毒株) 流感疫苗。另外在自費的流感疫苗則有四價 (四株病毒株) 流感疫苗供民眾選擇6。
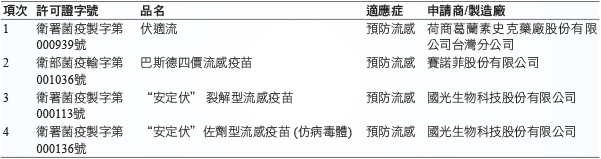
表四 列舉了國內流感疫苗產品
為求及時且兼顧流感疫苗的品質及療效,近年來疫苗病毒株變更的法規,尤其是臨床部分的規範都有更新的闡述。根據歐盟 (EMA) 的法規,公告新的加強安全性監測 (Surveillance) 指引配套來取代流感疫苗上市前須執行小規模臨床試驗的要求,安全性監測包括:一、加強主動性偵測 (enhanced active surveillance ; PASS);二、加強被動性偵測 (enhanced passive surveillance ; PASS);三、數據挖掘及其他電子健康資料庫管理 (data mining or other use of electronic health record data) 等7-9。
國內疫苗法規目前已經逐漸跟上歐美各國,但由於輸入藥廠在國內安全性監測之國內資料取得困難 (需要定期取得藥品不良反應通報中心的資料),並仍須仰賴國外總公司進行台灣及其他世界各國安全性資料的比對。在準備相關資料送件的部份增加了困難度 。
伍、結語
疫苗法規的發展往往與疫苗的製造研發息息相關,台灣的疫苗法規已逐漸與歐美法規接軌,並已公告國內生物藥品得以一廠多證之法規,有效緩解了疫苗供貨短缺之現象。但疫苗產品的封籤檢驗上,目前仍仰賴逐批檢驗,在人力物力及花費的時間仍大,希望衛生主管機關單位未來仍有更多的法規改革以利國人防疫安全。
The Overview and Tendency of Vaccine Regulation in Taiwan
Chien-Hui Weng1, Tsung-Ying Hsieh1, Ichen Su2
Taipei City Hospital1
GlaxoSmithKline Taiwan, Ltd2
Abstract
According to the 2016 database of Taiwan Centers for Disease Control , the completion rate of children vaccination including Hepatitis B , DTPa-IPV+Hib , Varicella vaccines and so on was up to 91%. The vaccination has obviously become one common and acceptable way to prevent diseases in Taiwan. In addition, there are several vaccines manufactured in Taiwan. However, we still rely on the imported vaccine for Tawian’s vaccination. Therefore, the vaccine regulation is so important to impact the vaccine supply to Taiwan. Taiwan FDA has published several regulation to catch up the regulation worldwide in the past years. This article will introduce the vaccine regulation in Taiwan and also indicate the latest regulation of strain update of influenza vaccine.
參考資料:
1.CDC網站: 2016年預防接種率 http://www.cdc.gov.tw/page.aspx?treeid=D78DE698C2E70A89&nowtreeid=9DCE2BAFDE5FC23D
2. 一廠多證生物藥品法規:中華民國104年10月16日FDA藥字第1041409729號公告
3. Valerie Marshall, MPH, and Norman W. Baylor, PhD: Food and Drug Administration Regulation and Evaluation of Vaccines. Pediatrics 2011;127:S23–S30.
4. 藥品查驗登記審查準則-疫苗藥品之查驗登記
5. 藥品查驗登記審查準則
6. 徐千惠:流感疫苗法規沿革. RegMed 2017 Vol.80 page 1-8.
7. Interim guidance on enhanced safety surveillance for seasonal influenza vaccines in the EU (EMA/PRAC/222346/2014)
8. Guideline on influenza vaccines – submission and procedural requirements (EMA/56793/2014 Rev.1)
9. Guideline on Influenza Vaccines Non-clinical and Clinical Module (EMA/CHMP/VWP/457259/2014)
通訊作者:蘇圯蓁/通訊地址:台北市中正區忠孝西路一段66號
服務單位:荷商葛蘭素史克藥廠股份有限公司藥師/聯絡電話:(O) 02-23126801

