摘要
停經後骨質疏鬆症為系統性之骨骼疾病,其成因為雌性激素不足所致,造成骨質代謝的不平衡,即蝕骨作用大於造骨作用之高骨更新現象,使骨質含量、骨質密度降低,造成容易骨折之風險。深究停經後骨質疏鬆之細部病生理致病機轉可知曉蝕骨細胞的生成需經由 RANKL- RANK 訊息傳遞路徑且與造骨細胞密切相關,而造骨細胞之成熟則需仰賴 Wnt/β-catenin 訊息傳遞路徑,此兩種訊息路徑皆可受到雌性激素的調控,並由於兩大訊息傳遞途徑的揭露,有助於我們對現行治療藥物的認識,以其作為未來治療藥物的基石。
關鍵字: 停經後骨質疏鬆症、蝕骨作用、骨折、RANKL- RANK訊息傳遞路、Wnt/β-catenin訊息傳遞路徑
壹、前言
骨頭鬆鬆,人生空空!!骨質疏鬆症 (osteoporosis) 為一系統性骨骼疾病,係由於蝕骨作用 (bone resorption) 與造骨作用 (bone formation) 不平衡所引起,即蝕骨細胞 (osteoclasts) 的活性遠大於造骨細胞 (osteoblasts),骨質疏鬆症特徵是骨組織之骨質含量降低 (low bone mass) 及其微結構 (micro-architecture) 的破壞,骨質疏鬆的危險性在於骨頭之易碎性 (fragility) 上升與骨折 (fracture) 之潛在風險性亦提高,骨質疏鬆所致之骨折容易發生於髖關節 (hip)、手腕 (wrist) 及脊椎 (spinal)1,2,若將上述三處骨折易發生區域做骨密度掃描,根據衛生福利部國民健康署的研究調查指出241位年齡大於50歲之受試者中,僅股骨頸部位,即髖關節部位發生骨質疏鬆現象的男性有10.7%,女性則有12.1%,前臂部位顯示有骨質疏鬆的男性為11.6%,女性則為25%,腰椎單一部位有骨質疏鬆現象,男性受試者有4.3%而女性則有12.6%,股骨頸、前臂與腰椎三處中有任一處呈現骨質疏鬆者,男性為22.6%,女性則為41.2%3,此結果顯示女性發生骨質疏鬆的比率高於男性將近一倍。
骨質疏鬆症較常發生於較高年齡之女性,尤其是停經後的女性,主因為雌性激素 (estrogen 或有學者稱 oestrogen) 的降低,使蝕骨細胞活性上升,因此,本文將著重探討停經後之女性所引起之骨質疏鬆症1,2。
貳、 停經後骨質疏鬆症的病生理學及致病機轉
停經後骨質疏鬆之女性的骨質流失 (bone loss) 會經歷兩階段,第一階段為女性獨有之階段,係由於雌性激素缺乏而造成以骨小樑 (trabecular bone) 為主的大量骨質流失,此階段亦可稱為停經相關之骨質流失 (menopause-related bone loss),第二階段為男性與女性皆擁有的階段,此階段為皮質骨 (cortical bone) 與骨小樑共同骨質慢速流失,此階段又稱為年齡相關之骨質流失 (age-related bone loss),脊椎骨以骨小樑為主 (約80%),因此,脊椎骨之骨折相較於髖關節與手腕的骨折發生時間較早1。
停經後骨質疏鬆症的特色是蝕骨作用與造骨作用同時增加,也就是高骨更新 (bone turnover),在細胞層級可見到蝕骨現象遠高於造骨現象之不平衡1,負責蝕骨作用的蝕骨細胞源自於造血幹細胞 (hematopoietic stem cell),其成熟需仰賴由造骨細胞所表現的核因子κB 受體活化因子 (receptor activator of nuclear factor kappa-B;RANK) 配體 (ligand) 與蝕骨細胞之核因子-κB 受體活化因子結合4,當核因子κB 受體活化因子與配體結合後會經由腫瘤壞死因子受體結合因子6 (tumor necrosis factor receptor associated factor 6;TRAF 6) 使κB 激酶抑制因子 (inhibitor of kappa-B kinase;IKK) 複合體磷酸化,該複合體是由 IKKα、IKKβ、IKKγ所構成,其中的 IKKβ 會再磷酸化下游的κB 抑制因子 (inhibitor of kappa-B;IκB),使 p65/p50異二聚體 (heterodimer) 進一步移位 (translocation) 至細胞核內調控細胞之分化及存活5,而雌性激素會干擾上述之蝕骨細胞 RANKL- RANK 訊息傳遞路徑,來降低蝕骨細胞之分化與增加其凋亡 (圖一)1。
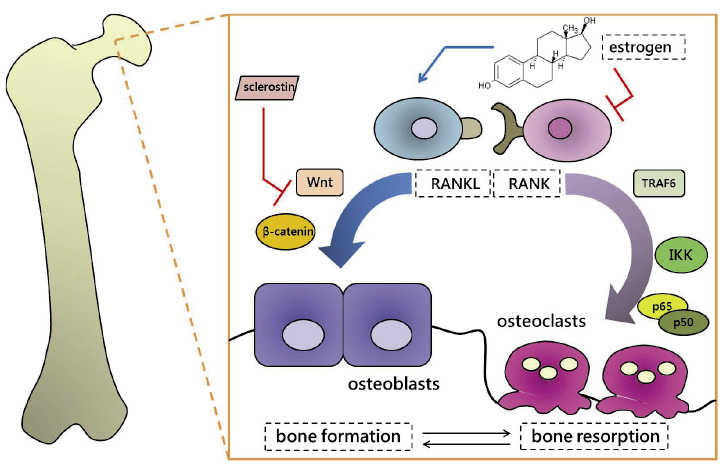
圖一 雌性激素調控骨質代謝 (bone metabolism) 反應機轉圖 (繪圖:郭廷濠)
雌性激素可干擾蝕骨細胞之 RANKL- RANK 訊息傳遞路徑,進而影響蝕骨作用,雌性激素可藉由 Wnt/β-catenin 訊息傳遞路徑,增加造骨作用,而硬化素 (sclerostin) 則可抑制 Wnt 傳遞路徑。
造骨細胞則源自於間葉系幹細胞 (mesenchymal stem cell),其可藉由雌性激素調控生成,增加造骨細胞的分化及抑制其凋亡以延長存活1,在造骨作用方面主要是活化典型的 (canonical) Wnt/β-連環蛋白 (β-catenin) 訊息傳遞路徑,當 Wnt 蛋白結合受體後藉由阻斷低密度脂蛋白受體相關蛋白 (low density lipoprotein receptor-related protein;LRP) 複合體與抑制肝醣合成酶激酶 3 (glycogen synthase kinase 3; GSK 3) 降解β-連環蛋白之功能,使β-連環蛋白足以蓄積,進而移位至細胞核內調控造骨細胞之分化及存活 (圖一)6。另外,硬化素 (sclerostin) 可抑制造骨細胞之 Wnt/β-catenin 訊息傳遞路徑 (圖一),當雌性激素缺乏時,會造成硬化素的量上升1。
綜合上述,停經後之女性,由於雌性激素缺乏會使蝕骨細胞之分化及凋亡無法被順利抑制,造成蝕骨作用大大提高,連帶影響到造骨作用,使造骨作用些微上升,因此有高骨更新之現象,但其中的蝕骨作用遠高於造骨作用而造成停經後骨質疏鬆1。
參、停經後骨質疏鬆症的診斷與預防
世界衛生組織 (world health organization;WHO) 定義骨質疏鬆症為骨質密度 (bone mineral density;BMD) 之數值與年輕成人女性之平均值相比,差異等於或小於2.5個標準差,即T-score 等於或小於-2.5,而 T-score 在-1到-2.5之間時,則稱為骨量稀少 (osteopenia),其中,T-score 等於0時表示與年輕成人女性之平均值相比無差異2。前述骨質密度之測量主要是藉由雙能量X射線吸收測量法 (dual energy x-ray absorptiometry;DXA) 來量測,其係利用兩種不同能量之X射線照射受測區域,藉由X射線穿透組織時的能量衰減來獲得骨質密度之數值,由於此技術十分精確 (precise)、迅速且使受試者暴露極少量之輻射,因此,量測骨質密度,以及使用雙能量X射線吸收測量法測量被視為主流1。
在停經後骨質疏鬆的預防方面,以營養補充,如:鈣質與維生素D最常被提及,充足的鈣質及維生素D與骨骼之健康有關2,其他方面則有戒菸,因為吸菸會造成骨質流失,使骨折之風險提高、維持適當之身體質量指數 (body mass index;BMI),BMI 過低或體重過輕容易導致骨折風險上升、身體活動 (physical activity),有助於增加骨質密度1,2、預防跌倒,停經後骨質疏鬆症最常見之併發症為骨折,而跌倒為非脊椎骨及髖關節骨折之危險因子1。
肆、停經後骨質疏鬆症的治療
一、雙磷酸鹽類藥物(bisphosphonates)
雙磷酸鹽類藥物為治療骨質疏鬆症之首選藥物,例如:alendronate、risedronate、ibandronate、etidronate、clodronate 與 zoledronic acid 等,雙磷酸鹽類藥物可藉由結合骨質後被蝕骨細胞攝取,進而抑制蝕骨作用,並可增加骨小樑之骨質密度1,2,7,雙磷酸鹽類藥物能有效減少停經後骨質疏鬆女性之脊椎骨、非脊椎骨及髖關節骨折7。
雙磷酸鹽類藥物之副作用有上消化道之症狀,如吞嚥困難 (dysphagia) 和食道炎 (esophagitis) 等、非典型股骨骨折 (atypical femoral fractures)、顎骨壞死 (osteonecrosis of the jaw)、低血鈣 (hypocalcemia)、類流感症狀 (influenza-like symptoms)、葡萄膜炎 (uveitis) 與上鞏膜炎 (episcleritis) 等7。
二、單株抗體藥物 (monoclonal antibody)
如上述,造骨細胞所表現之 RANKL 與蝕骨細胞之 RANK 結合後,可活化 RANKL- RANK 訊息傳遞路徑而增加蝕骨細胞之分化及存活,而單株抗體類藥物 denosumab 以皮下注射給予,可結合 RANKL 進而抑制蝕骨細胞之活化,減少蝕骨作用,亦可增加骨質,減少停經後女性之脊椎骨、非脊椎骨及髖關節之骨折1,7。
Denosumab 之副作用類似雙磷酸鹽類藥物,有消化道之症狀、非典型股骨骨折 (atypical femoral fractures)、顎骨壞死 (osteonecrosis of the jaw) 等,另外,更有增加感染之風險、皮疹 (rash) 及溼疹 (eczema) 等副作用7。
三、 副甲狀腺素類藥物(parathyroid hormone;PTH)
Teriparatide 為副甲狀腺素N端之34個胺基酸,以每日或每周皮下注射方式給予,可使用於雙磷酸鹽類藥物為禁忌 (contraindication) 之患者或骨質密度較低 (T-score 小於-3.5) 之未曾治療之患者,其可有效降低停經後骨質疏鬆女性之脊椎骨與非脊椎骨之骨折,副作用有上消化道症狀、噁心 (nausea)、四肢疼痛、頭暈 (dizziness)、頭痛、高血鈣、高鈣尿症 (hypercalciuria) 及低血壓等,另外,由於臨床前動物實驗測試可能發生骨肉瘤 (osteosarcoma),因此,使用上建議不超過兩年1,7。
四、 選擇性雌性激素受體調節藥物(selective estrogen receptor modulator;SERM)
SERM 類藥物有 raloxifene、bazedoxifene 及 lasofoxifene,但僅有 raloxifene 被美國食品藥物管理局 (food and drug administration;FDA) 核准用於停經後骨質疏鬆之治療,其對於不同組織之雌性激素受體不同之致效或拮抗作用,其可減少停經後女性之脊椎骨骨折風險,但對於非脊椎骨及髖關節骨折無效果1,7,因此,raloxifene 並非治療停經後骨質疏鬆之一線用藥,其亦有增加靜脈栓塞之風險7。
五、 雌性激素替代療法(estrogen replacement therapy)
由於停經後骨質疏鬆症與雌性激素之減少相關,因此,雌性激素替代療法被認為可以預防停經後骨質疏鬆,但不建議當作一線藥物使用,因其會增加冠狀動脈疾病 (coronary heart disease)、乳癌、中風與失智症之風險7。
六、其他未被 FDA 核准之新穎藥物
(一)Romosozumab
Romosozumab 為硬化素 (sclerostin) 之單株抗體類藥物,硬化素在造骨細胞之 Wnt 訊息傳遞路徑中扮演著負向調節之角色,即硬化素可抑制 Wnt 訊息傳遞路徑而影響到造骨細胞的分化,romosozumab 可增加造骨作用、骨質密度及強化多處骨骼強度7。
(二)Strontium ranelate
Strontium ranelate 為鍶鹽化合物類藥物,由於其化學性質與生物性質類似鈣,因此被用於治療骨質疏鬆症,每日服用其粉劑,可同時增加造骨細胞之分化與抑制蝕骨細胞的生成,增加骨質密度,可減少停經後骨質疏鬆症患者脊椎骨、非脊椎骨及髖關節之骨折1,7。
Strontium ranelate 的副作用有副作用有心血管、靜脈栓塞與心肌梗塞之風險、胃腸道不適、頭痛、癲癇等神經系統症狀,因此,strontium ranelate 不建議使用於嚴重腎功能不良之患者 (severe renal impairment)、曾發生靜脈栓塞或有缺血性心臟疾病之患者等7。
伍、結語
停經後骨質疏鬆係由於雌性激素缺乏所致,造成高骨更新的現象,因對蝕骨細胞之 RANKL- RANK 訊息傳遞路徑有更深層的認識,雙磷酸鹽類藥物與 denosumab 藥物之作用機轉能更清楚;造骨細胞之 Wnt/β-catenin 訊息傳遞路徑的認識則使 romosozumab 之作用方式能更為明瞭,由於兩大訊息路徑之揭露,可提供更多未來新穎藥物發展的基石,來有效改善停經後女性之骨質疏鬆症。
Postmenopausal Osteoporosis
Ting-Hao KuoMeiga Pharmacy
Abstract
Postmenopausal osteoporosis is a systemic bone disease due to estrogen insufficiency, bone resorption rate increase much higher than bone formation is the main reason for imbalance bone metabolism. Imbalance action between bone resorption and formation cause low bone mass, low bone mineral density and risk in fracture. To date, there is more understanding about the pathophysiology of postmenopausal osteoporosis, RANKL- RANK signaling pathway in osteoclast and Wnt/β-catenin signaling in osteoblast, thus, current treatment agents’ reaction is more clearly.
參考資料:
1.Eastell R, O'Neill TW, Hofbauer LC, et al: Postmenopausal osteoporosis. Nat Rev Dis Primers. 2016; 2:16069.
2. Das S, Crockett JC: Osteoporosis - a current view of pharmacological prevention and treatment. Drug Des Devel Ther. 2013;7:435-48.
3. 衛生福利部國民健康署:台灣地區19歲以上成人骨密度狀況初探 2007-2008之狀況。臺北:衛生福利部,2008。
4. Kuo TH, Lin TH, Yang RS, et al: Novel Pyrazole Derivatives Effectively Inhibit Osteoclastogenesis, a Potential Target for Treating Osteoporosis. J Med Chem. 2015; 58(12):4954-63.
5. Xiu Y, Xu H, Zhao C, et al: Chloroquine reduces osteoclastogenesis in murine osteoporosis by preventing TRAF3 degradation.J Clin Invest. 2014;124(1):297-310
6. Zuo C, Huang Y, Bajis R, et al: Osteoblastogenesis regulation signals in bone remodeling. Osteoporos Int. 2012; 23(6):1653-63.
7. Akkawi I, Zmerly H: Osteoporosis: Current Concepts. Joints. 2018; 6(2):122-127.
通訊作者:郭廷濠/通訊地址:台北市文山區保儀路23號
服務單位:美迦藥局藥師/聯絡電話:(O) 02-29362815

