摘要
藥品品質攸關國民健康,為維護國民用藥安全,並建構西藥製造業持續競爭優勢,臺灣製藥業持續配合政府法規提升品質管控水準,自民國71年起,國內西藥製劑工廠實施 GMP (Good Manufacturing Practice) 歷經4大階段,包括:一、民國66至77年之推動 GMP (品質經由檢驗而來)。二、民國84至94年推動 cGMP 確效作業 (品質經由製造及設計而來)。三、民國96年起之推動國際 GMP 標準,104年1月1日起全面符合 PIC/S GMP (品質經由系統管控)。四、民國104~105年藥品之運銷作業 (GDP, Good Distribution Practice))」涉及藥品儲存 (Storage)、運輸 (Transportation) 與配送 (Distribution) 運銷業者,皆需遵循 GDP 規範,透過法規標準提升,臺灣製藥已臻至國際品質水準。
關鍵字: 確效作業、藥品運銷作業、運輸、配送、PIC/S GMP、ICH
壹、前言1-4
“It is not about what you do, it's about what you control” 品質不是你做了什麼,是你管控了什麼…。這是一位 FDA 稽核員對品質所下的註解,生技醫藥產業為一具有高成本及高風險特性的產業,由研發、生產技術、製程設備、潔淨廠房到各項支援系統之建置,皆須符合 PIC/S 法規 (Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme 國際醫藥品稽查協約組織,用以確保藥廠生產的藥品品質,而藥品品質是甚麼?它絕不是一種感覺,或只有一個面相,它是個廣泛的概念,涵蓋單獨或共同影響品質的所有事項,也涵蓋藥品整個生命週期。而藥品的品質要如何控制,這就是大多數藥廠人員在忙碌的事。
貳、品質是檢驗出來 (70年代)
這是 GMP 階段,檢驗結果符合規格,產品就可以放行,然在國際上爆發了嚴重的敗血症,經發現是由在歐美等地製造的靜脈注射藥劑所引起,在同一期間美國 FDA 對美國境內之主要大型輸液藥廠作一系列的查核,發現有嚴重違反優良製造規範之事件,導致藥品全面回收及藥廠停工,由輸液污染所引發之重大公共衛生事件造成災害,無菌標準的製造能力及信賴度,不能夠單靠成品檢驗來確定,因此 FDA 於1978年公告一套全新現行優良製造規範,謂之 Current GMP (cGMP),藉由「確效作業」之落實執行來降低對病人生命威脅的健康風險。
參、品質是製造出來 (80 年代)
80年代也就是 cGMP 時代,藥品的生產製造,需確認其正確性和有效性的,即所說的「確效」,從原物料的品質控管與放行、生產的設備及檢驗儀器的驗證,到藥品製程、檢驗的流程確認等,這些層層關卡都是需要建立『書面證據』確保恆定的製造出符合既訂規格及品質表現的產品,而最主要的核心目標,就是維持藥廠每一批藥的品質都一致,因此確效作業就不只限於藥品的製程,它擴及與製程有關之要素,包括支援系統 (水系統/空調系統)、原料、生產設備/檢驗儀器、分析方法、製程,最後還有清潔方法,每個環節的確認都再次確保了藥物的品質穩定,例如:生產環境的空調通風 (HVAC, heating vertilation and air conditioning) 系統,在藥物製造品質上就扮演著重要的角色,它所供應的溫度、溼度、壓差和空氣潔淨度扮演著「產品的保護」、「操作人員的保護」及「周遭環境的保護」三個層面的防護角色,因溫溼度太高,藥品可能吸濕變質,無法確保符合原料及產品的要求,無法提供作業人員一個舒適的環境,若壓差太低 (設計維持住較高的正壓,至少大於10 Pa 壓差),可能造成外界污染物流入製造區,而製造區每間作業房間為達防護的目的,須維持負壓,使製造廠裡面的物質不致流出污染環境,造成公共安全危害。如果空氣潔淨度不夠,大部分的細菌或濾過性病菌等,會附著在空氣中的浮游微粒子,也會造成產品污染,怎麼讓這個空調通風系統有效且適當的粉塵管理以及環境保護?如何提高製造現場的潔淨度,維持產品品質、保護操作人員的安全與健康,將受污染的可能性降到最低,並且避免有害排放物污染環境,造成公共安全危害?藥廠人員就須每天監控的工作,包括溫溼度控制、風速及風量、壓差、換氣數、濾器過濾效率、空氣流動型態等,並以確效試驗及相關文件來呈現系統之適當性。在參與 cGMP 規範及驗證平台後,藥品品質已可踏入國際高階藥品市場之門。
肆、品質是設計出來
隨著科技進步與環境及品質管理的需求,藥品 GMP 內容歷經修正,導入新觀念進行動態管理模式,藥品 GMP 發展到了90年代,已從單純防止交叉汙染及防止混淆誤用 (mixed up) 要求,進ㄧ步對品質要求精益求精,不斷導入新的品質觀念,早期因為對製程了解少,所以需要大量的產品檢驗,當對製程有高度了解與管制,將可減少最終產品檢驗,亦即,品質不能單以測試產品來確認,它必須是被設計在產品裡 (Quality by design)。這時新的觀念是品質是設計出來 (Quality by Design, QbD),國際醫藥法規協和會 (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH) 對 QbD 的定義為「以可靠的科學知識作為基石,對藥品品質的風險進行科學合理的評估和控制,並強調對產品與製程的深刻理解,最終達到理想的品質目標」,研發的程序是系統性的,簡單來說就是藥品從研發開始就要考慮最終產品的品質,在處方設計、製造程序確定、製程參數選擇、原料控制等各個方面都要進行深入的研究,累積詳實的數據,確定最佳的產品處方和生產製程。而從技術面而言,QbD 應用包括:設計符合患者需求的藥品;設計始終符合關鍵質量屬性 (CQA, critical quality attvibute) 的製程;通過品質體系整合開發過程中獲取的產品及製程知識;了解處方成分及製程參數對產品品質的影響;鑑別和控制關鍵製程變異;根據操作條件的設定所產生變異範圍會有多大、決定變異能造成影響的嚴重性及選擇不同操作步驟及條件來進行確效測試,以幫助掌握與品質相關之關鍵點。
伍、品質經由系統而來
製藥業經歷了 GMP、cGMP、PIC/S 的淬鍊,至今品質已進化成是由系統整合出來的,如品質系統、原料源頭管理、上市後管理、風險管理…等。品質系統四大要素涵蓋了製程性能與藥品品質監測系統、矯正預防系統、變更管理系統及產品品質的管理回顧。在產品週期的各階段 (藥物研發、技術轉移、商業化生產和產品停產) 均需要貫徹實施這4大要素。而原料源頭管理,則須掌握原料之原始製造廠與供應商之品質,以確保廠內使用之原料與包裝材料在合理安全情況下製造符合優良製造規範,避免原料藥問題導致藥品品質不良案例,甚至用藥人致死等事件發生 (如2008年中國製造的抗凝血藥肝素因受“過硫酸化硫酸軟骨素”(Over-Sulfated Chondroitin Sulfate, OSCS) 污染,在美國造成350名使用患者出現過敏反應,至少導致4人死亡)。又因藥品的風險是無可避免且無法被完全排除,因此必須要充分瞭解且適當的管理風險。風險管理的兩個重要原則為:一、風險評估應該基於科學並用於最終保護患者利益;二、風險管理的投入應該與風險等級對應,風險等級越高,管理投入應越大。透過對藥品品質風險之評價、管制、溝通及檢討的系統過程、製程的經驗,才能保護病人確保病人用藥安全。而近年來品質管理制度更從製造面延伸至運銷面,強化藥品運銷鏈之管控,藥品優良運銷規範即係延續 GMP 品質管理的精神,為健全藥品供應鏈品質管理,跟著世界醫藥先進國的腳步,國內開始推動藥品 GDP 管理規範,以確保所有交付病人之藥品,在製造、儲存、運輸及配送過程中均有一致的品質保證。
陸、結論
品質是一條不歸路,因持續改善品質永遠沒有終點,品質的管控標準只有樓地板,沒有天花板,台灣製藥70年來,肩負著給予民眾更好品質醫藥的價值與承諾,製藥品質已順利與國際接軌,且在食品藥物管理署 (TFDA) 的帶領下,從 cGMP 到 PIC/S GMP 到 GDP 製藥品質具備歐盟規格 (圖一),藥品品質已具國際水準,對病人與藥廠均是雙贏。
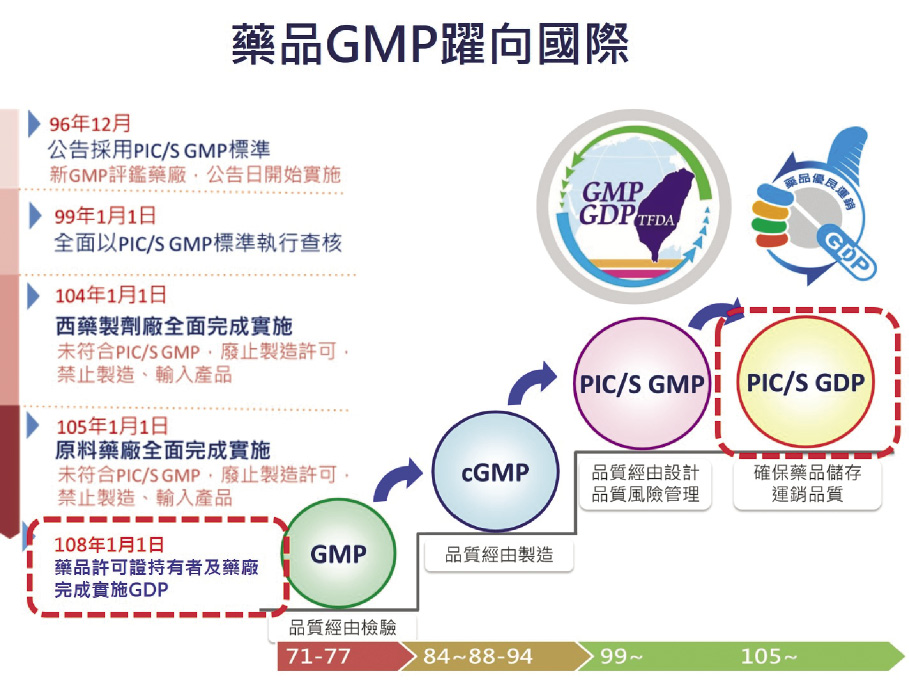
圖一 TFDA 藥品 GDP 管理與實務現況
Quality Is Not What You Do But What You Control
Chih-Lin Chen
Chairperson, Western Medicine Business Development Committee, Taiwan Pharmaceutical Manufacturer’s Association
Abstract
The quality of medicines is closely related to national health. To safeguard the medication safety, we lay the foundation for pharmaceutical manufacturers to keep up the pace of competition advantages for better quality. Taiwan pharmaceutical manufacturers comply with the government’s regulations to improve better quality. Since 1982, the implementation of Good Manufacturing Practices (GMP) was proceeded through four main transformation stages. 1) Promotion of GMP from the year 1977 to 1988 (quality by examination). 2) Pushing current GMP (cGMP) validation process from 1995 to 2005 (quality by manufacturing and design). 3) Applying international GMP standards since 2007 and fully complying with PIC/S GMP since Jan. 1st 2015 (quality by system control). 4) Good Distribution Practices (GDP) from 2015 to 2016, involving industries in storage, transportation, and distribution. Standards are upgraded through regulation transforming and MIT (made in Taiwan) pharmaceuticals have now reached international quality standards.
參考資料:
1.PIC/S :Guide to Good Manufacturing Practice for Medicinal Products PIC/S January 2017
2. ICH HARMONISED TRIPARTITE GUIDELINE Pharmaceutical Development Q8
3. ICH HARMONISED TRIPARTITE GUIDELINE Quality Risk Management Q9
4. ICH HARMONISED TRIPARTITE GUIDELINE Pharmaceutical Quality Systems Q10
5. 衛福部食品藥物管理署網站-藥廠GMP發展與管理
通訊作者:陳志麟/通訊地址:台北市大安區敦化南路二段267號3樓
服務單位:臺灣製藥工業同業公會西藥經營發展委員會主任委員/聯絡電話:(O) 02-27365838

