摘要
B型肝炎是一種病毒性疾病,現今全球感染人口約2.5億人,會導致急性和慢性併發症,引起慢性肝炎、肝硬化和肝細胞癌而死亡,為全球重大的健康問題。研究指出,接種B型肝炎疫苗 (Hepatitis B vaccine) 可以降低B型肝炎病毒 (Hepatitis B virus, HBV) 感染的風險,也顯著的減少了慢性B型肝炎帶原率和肝細胞癌發生率。目前市面上在使用的B肝疫苗對老年人、男性、糖尿病患者、肥胖者和吸煙者的免疫反應較差,但新型B肝疫苗對這些族群可提供較好的血清保護率。而 Heplisav-B 就是一種新型的B肝疫苗,已經被美國 FDA 核准上市,只需要在1個月內施打兩次劑量即可。臨床試驗結果顯示,Heplisav-B 在安全性和療效方面優於目前正在使用的B肝疫苗 Engerix-B。本文將綜合敘述 Heplisav-B 疫苗的藥理學、安全性、臨床試驗和適應症,提供大家參考。
關鍵字:Hepatitis B virus(HBV)、HBV vaccines、Heplisav-B、B肝疫苗
壹、前言
現今B型肝炎病毒 (Hepatitis B virus, HBV) 感染仍然是全球主要的公共衛生問題。根據世界衛生組織 (WHO) 估計,全球B型肝炎病毒慢性感染盛行人口約2億5千萬人1,每年超過78萬名患者因慢性B型肝炎所引起的肝硬化和肝細胞癌而死亡,為全球重大健康議題之一。臺灣地區為B型肝炎高感染地區,盛行率約9.4%,帶原人數約2,185,000人,治療比例約28%2。要如何預防B型肝炎病毒的感染呢?透過完整的B型肝炎疫苗 (Hepatitis B vaccine,常簡稱B肝疫苗) 接種注射能有效預防B型肝炎的感染。自1986年7月起政府全面推動新生兒B肝疫苗預防接種後,兒童B肝帶原率 (5歲感染比例:0.3%) 及罹患率已顯著下降2。
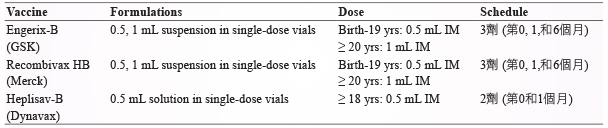
目前市面上在使用的B肝疫苗有兩種,分別是葛蘭素史克的 Engerix-B 和默沙東的Recombivax HB (表一)3,需要在6個月內注射三次才算完成,由於需要時間較長,有近一半的成年人未能在1年內完成全部疫苗注射。而完成接種的成年人裡,也有近半數的人,B型肝炎表面抗原抗體 (anti-HBs) 會隨著時間消失或測不到。另外,對老年人、男性、糖尿病患者、肥胖者和吸煙者的免疫反應較差。因此,我們需要有新的B肝疫苗,提供更方便的注射行程和更好的保護力,特別是罹患糖尿病患者、老年人,肥胖者和吸煙者。
Heplisav-B (HBV-ISS, HBsAg-1018) 是新開發的B型肝炎疫苗,是用一種用新型佐劑製備的疫苗,可縮短接種的時間,方便B肝疫苗的接種。本篇將綜述此藥物的臨床治療資訊。
表一 目前市面上的B型肝炎疫苗製劑3
貳、適應症和用法劑量3
美國食品藥物管理局 (FDA) 於2017年11月9日核准 Heplisav-B 預防成人B型肝炎。是近25年來新款B型肝炎疫苗在美國獲得批准上市,有望給那些曾經接種過疫苗,但表面抗體消失的民眾帶來新的福音。
FDA 核准適應症是用於18歲以上成人預防所有已知B肝病毒所引起的感染。此疫苗為雙劑量B肝疫苗,建議接種方式為第一劑0.5 mL 肌肉注射,間隔一個月後施打第二劑。能在更短時間內以更少的次數完成B肝疫苗接種。美國疫苗接種諮詢委員會 (Advisory Committee on Immunization Practices, ACIP) 也推薦 Heplisav-B 用於 ≥ 18歲的成人,是預防 HBV 的重要選擇4。
參、臨床藥理學3,4
此疫苗含有重組酵母菌來源的B型肝炎表面抗原 (HBsAg) 和免疫刺激佐劑 (adjuvant)。現行的B肝疫苗都是使用氫氧化鋁 (Al (OH)3) 作為佐劑,Heplisav-B 是用一種用新型佐劑製備的疫苗,此新型佐劑是使用來自細菌 DNA 的合成胞嘧啶磷酸鳥嘌呤寡核苷酸 (cytidine-phosphate-guanosine oligodeoxynucleotide;CpG 1018)。CpG 1018是短單鏈 (22-mer,7.15kDa) 包含 CpG 的寡脫氧核苷酸序列 (5'-TGACTGTGAACGTTCGAGATGA-3') 5。微生物的未甲基化 CpG 模體 (另稱免疫激活序列, immunostimulator sequence,ISS) 會強烈活化「類鐸受體-9」(toll-like receptor 9;TLR-9),通過激活 TLR-9途徑刺激先天性免疫系統,促使產生細胞激素,如白細胞介素12 (interleukin-12) 和干擾素 (interferon-α)3,誘發免疫反應,達到提昇疫苗效力。
肆、臨床研究及安全性3
FDA 基於 Heplisav-B 三項第3期非劣效性 (noninferiority) 的臨床試驗數據 (表二)5-8,所以批准它用於18歲以上成人預防所有已知B肝病毒所引起的感染。此三項試驗設計都屬於隨機、成年參與者盲、主動控制、多中心研究。三項試驗都是 Heplisav-B 與 Engerix-B 進行頭對頭 (head-to-head) 比較。試驗組在第0和1個月時接受兩劑 Heplisav-B,在第6個月給予安慰劑,對照組在第0、1和6個月時接受標準的三劑 Engerix-B。比較兩組誘導的血清保護率 (seroprotection rate, SPR)。SPR 定義是B型肝炎表面抗原抗體 (anti-HBs) ≥ 10 mIU/mL,則視為具有長期保護力,以後毋須檢測抗體或加強接種。下面將跟大家詳述這些臨床試驗的結果。
表二 Results of Heplisav-B Seroprotection Studies5-8
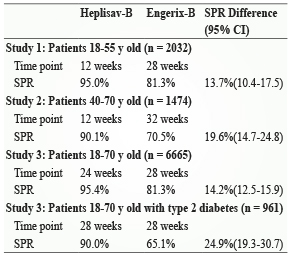
第一個第3期試驗在德國與加拿大進行,參與者是18至55歲健康成人的血清保護作用研究。試驗組有1151位和對照組有521位進行頭對頭比較,兩組平均年齡為40歲9。初步免疫抗原性分析 (Primary immunogenicity analyses) 比較 Heplisav-B 在第一劑注射後第12週血清保護率與 Engerix-B 在第28週血清保護率,結果 Heplisav-B 組以95.0%優於對照組 Engerix-B 的81.3%3,6,展現出優於 Engerix-B 的實力。在局部和全身不良反應中,Heplisav-B 組的注射部位反應的比例較高 (38.5%vs. 33.6%),但兩種疫苗均獲得良好的耐受性。
第二個第3期試驗在美國與加拿大研究進行,參與者是40至70歲健康成人。試驗組有1121位和對照組有353位進行頭對頭比較,兩組平均年齡為54歲9。初步免疫抗原性分析比較 Heplisav-B 在第一劑注射後第12週血清保護率與 Engerix-B 在第32週血清保護率,結果顯示 Heplisav-B 組以90.1%優於對照組 Engerix-B 的70.5%3,7。在不良反應方面,兩組疫苗的安全性相似。
而最後一個第3期試驗則是2018年初發表於 Vaccine 期刊,全在美國收集參與者,主要為18至70歲健康成人。收案人數更多,試驗組共有4376位與對照組2289位進行比較,兩組平均年齡為51歲9。初步免疫抗原性分析比較 Heplisav-B 在第一劑注射後第24週血清保護率與 Engerix-B 在第32週血清保護率,結果顯示 Heplisav-B 能夠對95.4%的患者提供保護,這一保護率顯著高於現有的標準疫苗 Engerix-B (81.3%)3,8。在不良反應方面,兩組疫苗的安全性相似。
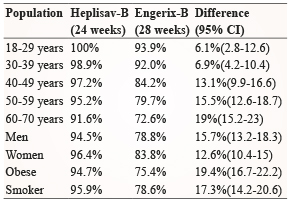
而第3個試驗另外有針對不同年齡組、性別、糖尿病患者、肥胖者以及吸煙者等不同組群進行血清保護率的分析 (表三)6-8。在評估年齡血清保護率方面,患者被分為五個不同的年齡組別,在第一組 (年齡範圍是18-29歲) 中,顯示 Heplisav-B 組 (174位) 有100%的 SPR 和 Engerix-B 組 (99位) 有93.9%的 SPR。在第二組 (年齡範圍是30-39歲) 中,顯示 Heplisav-B 組 (632位) 有98.9%的 SPR 和 Engerix-B 組 (326位) 有92%的 SPR。在第三組 (年齡範圍是40-49歲) 中,顯示 Heplisav-B 組 (974位) 有97.2%的 SPR 和 Engerix-B 組 (518位) 有84.%的 SPR。在第四組 (年齡範圍是50-59歲) 中,顯示 Heplisav-B 組 (1439位) 有95.2%的 SPR 和 Engerix-B 組 (758位) 有79.7%的 SPR。在第五組 (年齡範圍是60-70歲) 中,顯示 Heplisav-B 組 (1157位) 有91.6%的 SPR 和 Engerix-B 組 (588位) 有72.6%的 SPR。試驗組及對照組兩組皆有隨著注射年齡的增加而血清保護率下降的趨勢,但在所有年齡分組中,也發現試驗組的血清保護率還是高於對照組。在性別方面,對照組男性的血清保護率明顯比女性差 (78.8%和83.8%),而在試驗組部分,男女兩組在血清保護率皆有提高,針對男性部分,新型B肝疫苗更能提供好的保護效果。在糖尿病患者方面,其中14%(961人) 的受試者有罹患第2型糖尿病,在第28週時,試驗組的血清保護率為90.0%,而對照組為65.1%,差異為24.9%(95%CI:19.3%,30.7%)。而對於肥胖者和是否吸煙者,Heplisav-B 一樣證明了優於 Engerix-B 的保護力。
表三 Seroprotection Rate (Study 3)5-8
伍、不良反應與注意事項3,4
關於安全性方面,Heplisav-B 在臨床上常見的副作用有:注射部位疼痛 (23-39%)、疲勞 (11-17%)、頭痛 (8-17%) 和全身乏力 (6-9%)。在臨床試驗期間,試驗組約有55.3%參與者有發生任何類型 (any kind) 的不良事件,而對照組則有58.1%。常見不良事件有上呼吸道感染、支氣管炎及鼻竇炎。在嚴重不良事件 (serious adverse event, SAE) 方面,兩組是相同的 (4.8%),常見的 SAE 有肺炎、骨關節炎、急性心肌梗塞和非心源性胸痛5,10。
因為無相關安全數據可提供 Heplisav-B 是否可以與其他免疫球蛋白製劑併用,如需併用時,應採取不同注射器和不同部位給藥。Heplisav-B 本身已經含有 HBsAg,所以在接種疫苗後,也可在血液中偵測到 HBsAg,可能會干擾血清學實驗室數值,所以在 Heplisav-B 接種後28天內的數值不具有診斷價值5,9。關於疫苗對孕婦或胎兒的影響,目前沒有相關研究數據,所以不建議使用。在心血管方面的副作用和長期安全問題,Heplisav-B 仍有待更多的研究才能確定10。
陸、總結
Heplisav-B 是一款將B肝表面抗原與新型佐劑 CpG 1018相結合的成人B肝疫苗,只需要在1個月內注射兩次,縮短了接種的時間,提供更便捷的B肝疫苗接種,有利於防疫的推廣與執行,有效提高接種率。在臨床試驗中注射兩劑的 Heplisav-B 成人比三劑 Engerix-B 更具血清保護率。對於血清中表面抗原抗體 (anti-HBs) 下降的患者也適用,擴大了患者的使用範圍。美國肝臟疾病研究協會 (AASLD) 在2018版B肝治療指南中也指出,B肝疫苗有非常好的安全數據,可有效預防B肝病毒的感染,也提到 Heplisav-B 獲得了批准上市,是可以接種的疫苗。但台灣何時上市,或許仍需要一段時間。希望這個新型的B肝疫苗能夠盡早在台灣上市,造福更多人。
The Introduction of New Hepatitis B vaccine (Heplisav-B)
Chun-Nan Wu1, Chun-Pai Hsiao2, Chien-Ying Lee3
Department of Pharmacy, Chung-Shan Medical University Hospital1
Department of Pharmacy, Jen-Ai Hospital Tali Taichung2
Department of Pharmacology, Chung-Shan Medical University3
Abstract
Hepatitis B virus (HBV) infection is a viral illness that chronically infects 250 million people worldwide, leads to both acute and chronic complications, and increases risk of hepatocellular carcinoma. Hepatitis B virus infection remains an important global public health problem. The HBV vaccination has decreased HBV infection. Despite the effectiveness of the HBV vaccine, some populations do not develop protective responses. In addition, immunological hyporesponsiveness in elderly, men, patients with diabetes mellitus, obesity, and smokers. Heplisav-B, A new hepatitis B vaccine, has been approved for adults in the United States and requires only two doses over 1 month. Results from clinical trials showed that Heplisav-B is superior to Engerix-B in safety and efficacy profiles. This paper provides a review of Heplisav-B vaccine in the pharmacology, safety, clinical trials and indications.
參考資料:
1. Anna SF Lok, MD. Hepatitis B virus: Overview of management. UpToDate.This topic last updated: Sep 29, 2017.
2. Polaris Observatory Collaborators. Global prevalence, treatment, and prevention of hepatitis B virus infection in 2016: a modelling study. Lancet Gastroenterol Hepatol. 2018; 3(6):383-403.
3. A Two-Dose Hepatitis B Vaccine for Adults (Heplisav-B). JAMA. 2018; 319(8):822-823.
4. Schillie S, Harris A, Link-Gelles R, et al: Recommendations of the Advisory Committee on Immunization Practices for Use of a Hepatitis B Vaccine with a Novel Adjuvans. MMWR Morb Mortal Wkly Rep. 2018; 67(15):455-458.
5. Splawn LM, Bailey CA, Medina JP, Cho JC. Heplisav-B vaccination for the prevention of hepatitis B virus infection in adults in the United States. Drugs Today(Barc). 2018; 54(7):399-405.
6. Halperin SA, Ward B, Cooper C, et al: Comparison of safety and immunogenicity of two doses of investigational hepatitis B virus surface antigen co-administered with an immunostimulatory phosphorothioate oligodeoxyribonucleotide and three doses of a licensed hepatitis B vaccine in healthy adults 18-55 years of age. Vaccine. 2012; 30(15): 2556-2563.
7. Heyward WL, Kyle M, Blumenau J, et al: Immunogenicity and safety of an investigational hepatitis B vaccine with a Toll-like receptor 9 agonist adjuvant (HBsAg-1018) compared to a licensed hepatitis B vaccine in healthy adults 40-70 years of age. Vaccine. 2013; 31(46):5300-5305.
8. Jackson S, Lentino J, Kopp J, et al: Immunogenicity of a two-dose investigational hepatitis B vaccine, HBsAg-1018, using a toll-like receptor 9 agonist adjuvant compared with a licensed hepatitis B vaccine in adults. Vaccine. 2018; 36(5): 668-674.
9. 藥品仿單
10. Hyer R, McGuire DK, Xing B, et al: Safety of a two-dose investigational hepatitis B vaccine, HBsAg-1018, using a toll-like receptor 9 agonist adjuvant in adults. Vaccine. 2018; 36(19):2604-2611.
通訊作者:李建瑩/通訊地址:台中市南區建國北路一段110號
服務單位:中山醫學大學藥理學科副教授/聯絡電話:(O) 04-24730022 ext 11664

