GLP-1RA 之概述與臨床試驗結果
林口長庚紀念醫院藥劑部藥師 吳昇曄、張凱程
長庚醫療財團法人行政中心藥材管理部副組長 陳玉瑩
摘要
第一型類升糖素胜肽受體致效劑 (Glucagon-like peptide-1 receptor
agonist (以下簡稱 GLP-1RA))
是近年來新型的糖尿病藥物之一,其優點除了較不容易發生低血糖之外,臨床效益如:體重下降及減少心血管的死亡率更是受到重視。但,此類藥物目前只有皮下注射劑型上市,使其一直無法更普遍地運用在糖尿病患者。不過,令人期待的是,口服
GLP-1RA 已經通過第三期臨床試驗,有望問世。本文將討論目前台灣上市的 GLP-1RA
皮下注射劑型,以及 GLP-1RA 口服劑型的第二期、第三期臨床試驗結果。
關鍵字:糖尿病、Glucagon-like peptide-1 receptor
agonist、口服GLP-1RA
壹、前言
隨著國人飲食習慣的變化,糖尿病早已成為台灣十大死因中、耳熟能詳的疾病1,不僅糖尿病的人口數增加,相關併發症如:高血壓、高血脂、心血管病變、視神經病變、腎病變也伴隨而來。所以,治療糖尿病的藥物隨著時間的推移,除了降血糖的效果之外,越來越重視其長期的臨床附加效果。目前,在臨床上已證實能夠幫助降低心血管疾病死亡率的新型糖尿病藥物如:鈉-葡萄糖共同輸送器-2抑制劑 (sodium-glucose cotransporter-2 inhibitors (以下簡稱 SGLT2i)) 和 GLP-1RA 嶄露頭角2-6,但 SGLT2i 的作用機轉對於嚴重腎功能不全、末期腎病或透析的患者卻是一大阻礙,更因此視為禁忌。GLP-1RA 雖然沒有明顯受到腎功能影響的問題,不過,此類型藥物的口服劑型容易被胃液分解而失效,因此目前只有皮下注射劑型,而皮下注射的不便性,容易造成病人的依順性下降,所以,為了要讓服藥更方便、更安全,口服的 GLP-1RA 成為未來糖尿病藥物的進展之一。
貳、GLP-1的作用方式
第1型類升糖素胜肽 (glucagon-like peptide-1) 是由30個胺基酸所組成7,由遠端迴腸 (distal ileum) 及部分大腸細胞所分泌的腸道荷爾蒙,屬於腸泌素 (incretin)。GLP-1會經由食物刺激腸道而被分泌,隨著血糖升高促使β細胞作用釋出胰島素,並抑制α細胞分泌升糖素,是葡萄糖依賴型胰島素分泌作用 (glucose-dependent insulin secretion)。
除此之外,GLP-1作用在胃腸道時,會延緩胃排空並促使下視丘產生飽足感,所以會有抑制食慾和體重下降的效果。但內生性的 GLP-1會迅速被體內各種細胞及肝、胰、腎等組織中的雙基胜肽酶-4(dipeptidyl peptidase -4 (DPP-4)) 分解而失效,所以半衰期很短,只有1-2分鐘,為了使其不因此受到限制,出現了能對 DPP-4產生阻抗性、不易被分解的 GLP-1RA,能維持較長的時間作用。
參、目前台灣健保給付的 GLP-1RA
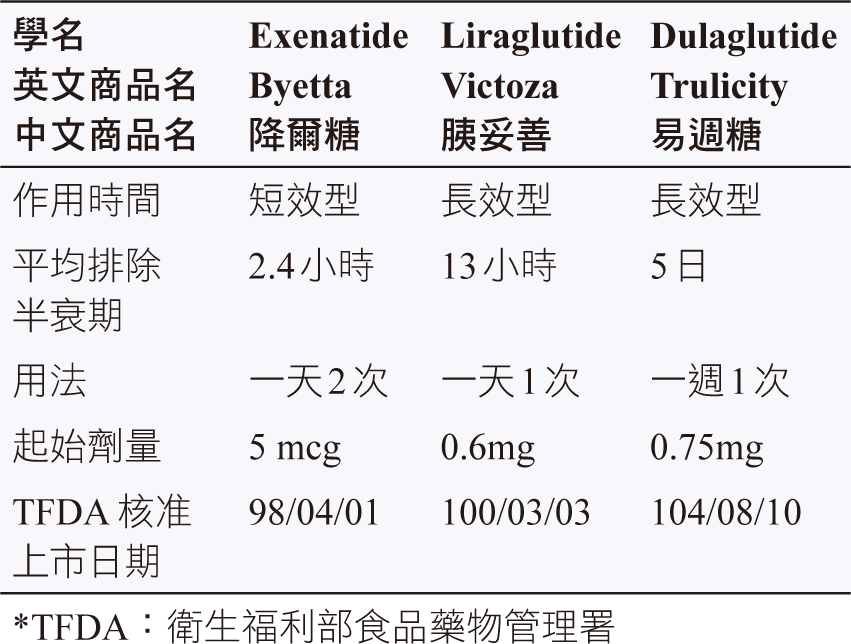
現在台灣健保給付的 GLP-1RA有3種,劑型均為皮下注射,分別是短效型的 exenatide (Byetta) 及長效型的 liraglutide (Victoza)、dulaglutide (Trulicity)。
一、Exenatide (Byetta)8
Exenatide 是由墨西哥希拉毒蜥蜴 (heloderma suspectum) 唾液分離而合成出來的 exendin-4片段,其與人體的 GLP-1胺基酸排序非常相似,具有刺激葡萄糖依賴型胰島素分泌作用,故當血糖偏低時,促進胰島素的分泌作用也會趨緩,較不會有低血糖的副作用發生,且對 DPP-4分解具有抗性,能延長在體內的作用時間,平均排除半衰期約為2.4小時,主要經腎絲球過後經蛋白質降解。建議用法為起始劑量每次5 mcg,一天二次,於早餐及晚餐餐前60分鐘內之任何時間注射 (或於每日主要的二餐餐前60分鐘內之任何時間注射,但需間隔約6小時或以上),切勿於餐後注射。依臨床上的反應,在起始劑量治療一個月後,可增加劑量至維持劑量10 mcg,一天二次。主要的副作用以腸胃道症狀 (例如:胃脹氣、噁心、嘔吐、腹瀉等) 較容易發生,其發生機率與劑量相關,但頻率及強度會隨時間而趨緩,可透過從低劑量開始來避免 (表一)。
二、Liraglutide (Victoza)9
Liraglutide 是利用釀酒酵母 (accharomyces cerevisiae) 經重組 DNA 技術而得的胜肽前驅物,其在前驅肽第26個胺基酸離胺酸 (lysine) 上,用麩胺酸 (glutamic acid) 接上一個C-16脂肪酸 (棕櫚酸),第34個胺基酸由離胺酸置換成精胺酸 (arginine) 而製得,與人類的內生性 GLP-1有高達97%的相似度。能刺激葡萄糖依賴型胰島素分泌、降低升糖素分泌及延遲胃排空,平均排除半衰期約為13小時,以類似大型蛋白質的形式進行內生性代謝,並沒有特定的器官為主要排除的途徑。建議用法為起始劑量每日0.6 mg,可在任何時間每日投予一次,以皮下注射方式注射在腹部、大腿或上臂,無需根據進餐時間給藥。使用一星期後,如果血糖控制未達理想,可增加劑量至每日1.2 mg,再經一週後,如血糖控制仍未達理想,則可增加至每日1.8 mg。使用低的起始劑量,可減少在調整劑量過程中所造成的腸胃不適症狀。主要副作用為噁心、嘔吐及腹瀉而造成的脫水 (表一)。
三、Dulaglutide (Trulicity)10
Dulaglutide 是由哺乳類細胞培養生產之融合蛋白,由2條相同的蛋白經雙硫鍵鍵結組成,每條蛋白含有一個N端 GLP-1類似物序列,並與被小型胜肽連結體修飾後的人類免疫球蛋白 G4 (IgG4) 重鏈上的 fc protein 進行共價連結。其胺基酸序列與人類的內生性 GLP-1 (7-37) 有90%同源。能夠增加β細胞內的環磷酸腺苷 (cAMP) 量,導致葡萄糖依賴型胰島素的釋放,也會減少升糖素分泌及延遲胃部排空,平均排除半衰期約為5日,推測會經由一般的蛋白質分解途徑,降解成本身的胺基酸組成。建議用法為起始劑量0.75 mg、每週一次,如果血糖控制未達理想或為更佳的血糖控制,可增加劑量至1.5 mg 每週一次。其可在一天當中的任何時間給藥,不須考慮進食與否,以皮下注射方式注射在腹部、大腿或上臂,若有需要,可以改變每週給藥的日子,但前後兩劑需間隔3日以上。常見副作用為噁心、腹瀉、嘔吐、食慾不振、消化不良 (表一)。
表一 GLP-1RA 的比較8-10
肆、台灣使用 GLP-1RA 之療效與安全性評估
台灣的一篇 GLP-1RA 回溯性世代研究發現11,25位使用口服降血糖藥品、胰島素的第二型糖尿病患者同時併用 GLP-1RA,Exenatide,治療6個月後,體重及身體質量指數皆明顯降低,分別為-4.72 ± 3.66 kg 及-1.81 ± 1.39 kg/m2,且隨著使用的期間增加,平均 HbA1c 值降低1.10 ± 4.78%,但病人的飯前血糖值並無顯著改善。不良反應方面與大多數研究結果相同,噁心最為常見,其次為嘔吐、打嗝等胃腸道方面副作用。
另外一篇台灣的回溯性世代研究12,利用北台灣的4間醫院隨機抽樣300位新使用 GLP-1 RA 的糖尿病患,包括 Liraglutide 或 Dulaglutide,並觀察治療6個月後,其 HbA1c 和身體質量指數相較於使用前的變化。在使用前時,平均身體質量指數和 HbA1c 分別為28.7 ± 4.7 kg/m2 和9.6 ± 1.7%,經過6個月 GLP-1 RA 治療後,平均身體質量指數和 HbA1c 的平均變化為-0.4 kg/m2 (95% CI:-0.2 ∼-0.6) 和-1.0%(95% CI:-0.8 ∼-1.2),兩組均有顯著降低。
除此之外,在台灣的一篇案例討論中13,一位原住民糖尿病患者因為體重過重所苦惱,因此,醫師在原本治療糖尿病藥物 NovoMix 30 penifill 100U/mL 3 mL/pc 和 metformin 500 mg/tab 中額外加入 Liraglutide,病人從2014年6月10日,體重85 kg,HbA1c 9.5%,到2016年2月2日,體重下降至74 kg,而 HbA1c 下降至7.2%,並且病人在使用 Liraglutide 期間並無反映有任何不適狀況發生。
GLP-1RA 雖然很早就於美國上市,但相關研究幾乎以白種人居多,台灣受限於樣本數及醫師處方型態差異,療效及安全性研究結果主要局限於單一醫療機構之證據等級,對於 GLP-1RA 長期的使用療效和安全性仍需要較大規模的研究世代追蹤觀察。
伍、口服 semaglutide 的臨床進展
英國一篇臨床系統回顧指出14,糖尿病病患對於口服降血糖藥物和施打胰島素及任何針劑型藥物時有著不同觀點,此觀點會影響到用藥的依順性,研究結果指出,相較於使用針劑的病患,使用口服藥品的糖尿病病患,有較好的血糖控制,所以發展口服劑型為糖尿病藥品的研發趨勢。
一、第二期臨床試驗結果
第二期試驗起始於以病人進行療效探索為主要目標,通常會以嚴格條件先篩選出一群同性質高的病患族群,並進行嚴密監測作業。此階段的另一個重要目的為決定第三期試驗所使用之劑量及治療方法。
在2017年 JAMA 發表之臨床試驗15,是以比較口服 semaglutide
相較於安慰劑及對於皮下注射 semaglutide
在第二型糖尿病患者之血糖控制效果而所做的第二期試驗。隨機納入之632位患者中,538位
(92%) 完成了試驗,經過26週試驗,結果顯示,HbA1c 方面相較於開始用藥物前,口服
semaglutide 隨著劑量增加,HbA1c 平均下降0.7%-1.9%,皮下注射
semaglutide 平均下降1.9%,安慰劑則是下降0.3%。在體重變化方面,口服
semaglutide 隨著劑量增加,體重減少2.1 kg-6.9 kg,皮下注射
semaglutide 減少6.4 kg,安慰劑則是減少1.2 kg。不管是在降低 HbA1c
或者是減少體重方面,口服 semaglutide
相較於安慰劑在臨床上都呈現了統計顯著意義的結果。在不良反應發生方面,口服 semaglutide
為63%-86%,而皮下注射 semaglutide
為81%,安慰劑則為68%,以輕度到中度的胃腸道不適最為常見。經過26週的試驗,相較於安慰劑,口服
semaglutide 對於病患的血糖控制更有效,並支持第三期試驗評估長期臨床結果及其安全性。
二、第三期臨床試驗結果
第三期試驗目的在於顯示或確認治療效益,確認第二期臨床試驗中所得藥品用於目標適應症及受試驗者是安全及有效的初步證據,提供核准藥品上市之適當依據。在某些情況下,第三期試驗又可分為3a 和3b 的階段,3a 主要是進行藥效評估,在呈請新藥上市許可申請 (new drug application (NDA)) 之前進行,3b 則是在呈請 NDA 之後一直到正式上市之間的這段時間進行,主要是完成較早期研究中沒有研究到的項目。
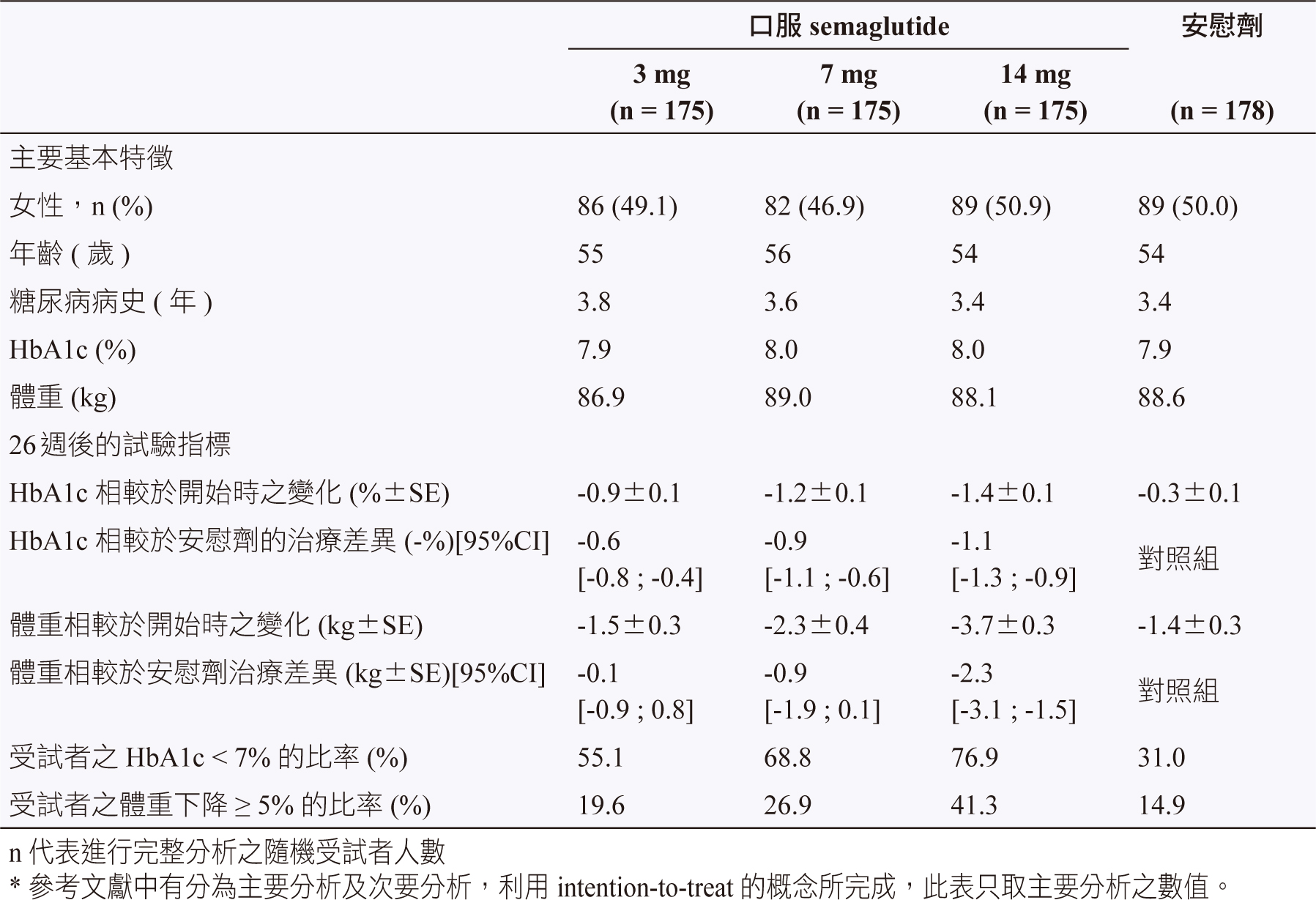
在2018年7月美國糖尿病學會所發表的3a試驗 (PIONEER 1)16,目的是評估口服 semaglutide (3 mg,7 mg,14 mg、每日一次) 對於未接受過飲食和運動控制的第二型糖尿病患者相較於安慰劑的療效與安全性,而主要試驗指標是 HbA1c 第26週對照於開始使用前的變化。結果顯示,口服 semaglutide 降低 HbA1c (所有劑量組) 和減少體重 (在14 mg 組) 方面具有臨床意義,表現出優於安慰劑的優勢,在未接受過飲食和運動控制的第二型糖尿病患者中具有良好的耐受性。不良事件發生比率方面,3 mg,7 mg,14 mg 分別為58%,53%,57%,而安慰劑則是56%,以短暫輕度或中度噁心最為常見 (表二)。
表二 第三期臨床試驗 (PIONEER 1) 病人基本特質及26週後試驗結果16
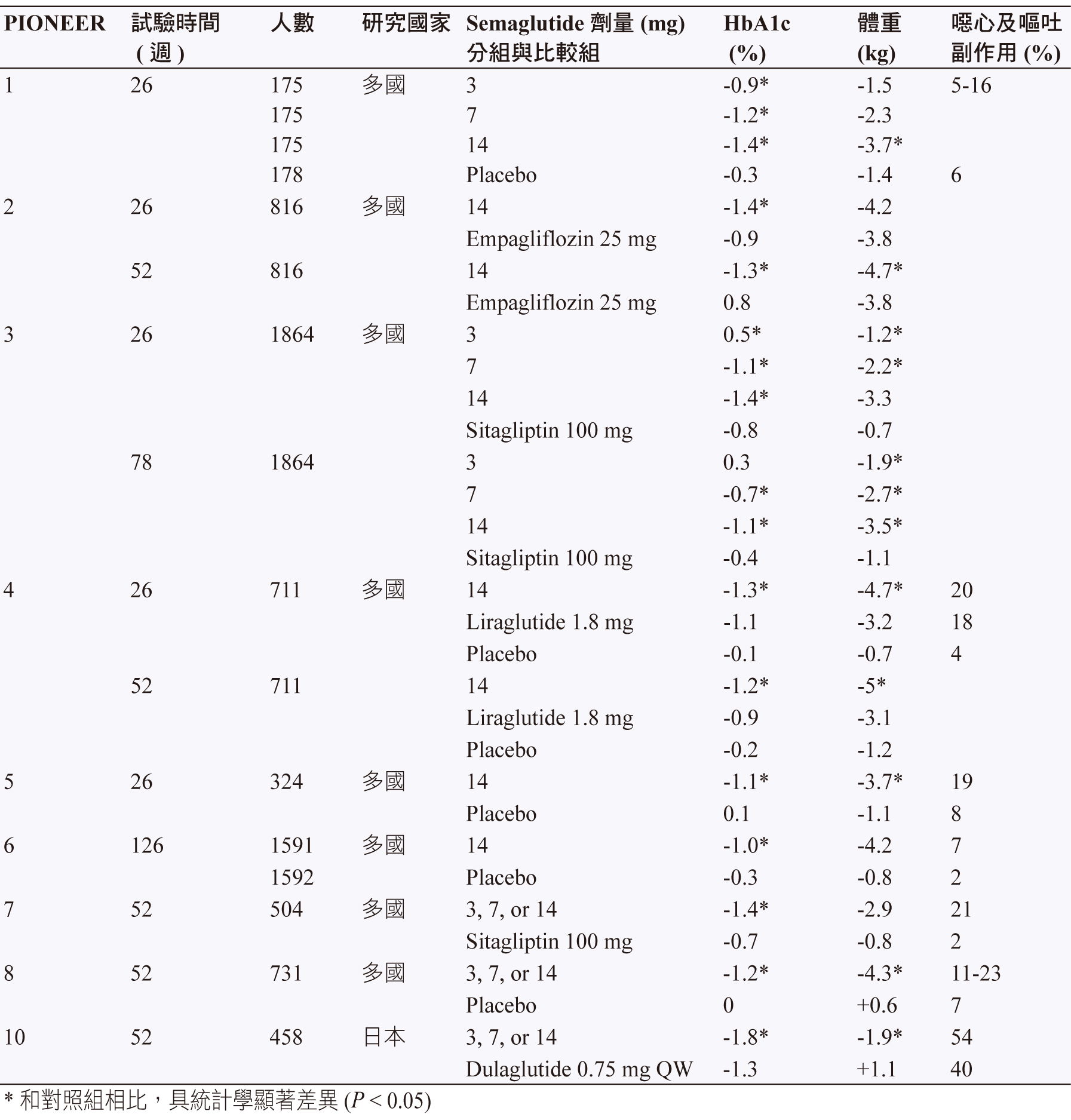
而口服的 semaglutide 除了 PIONEER 1,還做了其他9項的臨床試驗 (PIONEER 2-10) 7,其中 PIONEER 2和 PIONEER 3分別將口服 semaglutide 和糖尿病第二線藥物 sodium-glucose cotransporter type 2 (SGLT2) 的 empagliflozin 及 dipeptidyl peptidase-4 inhibitor (DPP-4i) 的 sitagliptin 做比較,在降低 HbA1c 和體重下降方面具有統計上的意義。而 PIONEER 5和 PIONEER 8則是分別對中度腎臟損傷的病患及對額外加上胰島素的病患做安全性、有效性上的評估(表三)。
最近才宣佈結果的 PIONEER 4和 PIONEER 7,PIONEER 4主要比較口服14 mg semaglutide 和皮下注射1.8 mg liraglutide,在26週和52週,相較於皮下注射 liraglutide 和安慰劑,口服 semaglutide都表現出較好的降低 HbA1c 和體重的臨床效益;PIONEER 7則是研究口服 semaglutide 在52週治療中根據病患臨床症狀調整劑量與每日使用100 mg sitagliptin 的糖尿病病患比較,最後結果顯示,相較於100 mg sitagliptin,口服 semaglutide 在降低 HbA1c有較好的效果 (0.7% vs. 1.4%),在下降體重方面有相同的趨勢 (0.8 kg vs. 2.9 kg)。在最新2019年 PIONEER 6的口服 semaglutide 非劣性臨床試驗中,探討心血管的安全性17,結果顯示,口服 semaglutide 發生心血管事件的風險,相較於安慰劑,兩組風險相似 ( 風險比:0.79,95%,信賴區間0.57-1.11 )(表三)。
表三 PIONEER 系列研究整理7,17
PIONEER 9和10都是在日本進行臨床試驗,PIONEER 9研究3 mg、7 mg及14 mg 口服 semaglutide 在隨機、雙盲、平行設計、活性組中對照安慰劑的安全性及有效性;PIONEER 10 主要比較使用3 mg、7 mg、14 mg口服 semaglutide 相較於皮下注射0.75 mg dulaglutide 每週一次治療之不良事件的數量 (表三)。
因為口服的關係,可能會與其他藥物發生交互作用或者與原本該有的血糖藥互相影響,例如:氫離子幫浦抑制劑
(proton pump inhibitors
(PPI)),常使用於消化道潰瘍在第二型糖尿病患者身上,因此,在一試驗中,將一種PPI
(omeprazole) 與口服 semaglutide 搭配使用,雖然 PPI
會增加胃部酸鹼值,但與沒有搭配 PPI
的患者比較,並沒有在統計學達到顯著的差異,因此,搭配治療時不需要做劑量上的調整18。除了 PPI
之外,也測試口服避孕藥 (ethinylestradiol (0.03
mg)/levonorgestrel (0.15 mg)),結果顯示口服 semaglutide
也不影響其生體可用率。而原本使用 metformin 患者,口服 semaglutide
不影響其血漿濃度高峰值 (Cmax)。而其他測試藥物如心衰竭藥物 (digoxin)、利尿劑
(furosemide)、降血脂藥物 (rosuvastatin)、抗凝血劑
(warfarin) 合併口服 semaglutide
時,皆不影響原本藥物的生體可用率,在統計學上都沒有達到顯著差異。
陸、展望未來
隨著國人健康知識水準的提升,糖尿病已經是家喻戶曉的慢性疾病,治療糖尿病的藥物也不斷推陳出新,想要改善糖尿病,病患必須有正確的觀念和心態之外,服藥的依順性也是慢性疾病當中非常重視的一環。可惜的是,病患常常會因為心裡因素而排斥注射藥物,GLP-1RA 注射劑型即為一例,儘管在和其他血糖藥物比較之下,擁有降低心血管疾病、減輕體重、較少低血糖風險等等好處,但只因目前只有注射劑型而被許多病患拒之千里,實在可惜。不過,隨著時代的進步,GLP-1RA 口服劑型 已進行長期安全性的臨床試驗,未來可望以接受度較高的口服劑型問世,上市後將可能為糖尿病患者帶來更多選擇及益處。
Overview of Glucagon-like Peptide 1 Receptor Agonist And Clinical Trial Results
Sheng-Yeh Wu1, Kai-Cheng Chang1, Yuk-Ying Chan2
Department of Pharmacy, Chang Gung Memorial
Hospital, Linkou1
Department of Pharmaceutical Materials
Management, Chang Gung Memorial Hospital2
Abstract
Glucagon-like peptide 1 receptor agonist (GLP-1RA) is one of the new class of antidiabetes drugs in recent years. These kind of drugs not only have lower risk of hypoglycemia but also value to many people because of the weight loss and cardiovascular mortality reduction effects. However, GLP-1RA only has the subcutaneous injection formulation now, which has made it difficult to use more commonly in diabetes patients. Fortunately, it is expected that oral GLP-1RA has passed the third phase clinical trials and will be available in the near future. We will discuss GLP-1RA subcutaneous injection formulation approved in Taiwan and the current clinical trial results of the second and the third phases of the oral form of GLP-1RA.
參考資料:
1. 衛生福利部統計處. https://dep.mohw.gov.tw/DOS/lp4472-113.html. 瀏覽日期: 2019/07/01.
2. Zinman B, Wanner C, Lachin JM, et al: Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. The New England journal of medicine 2015; 373(22): 2117-28.
3. Wiviott SD, Raz I, Bonaca MP, et al: Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. The New England journal of medicine 2019; 380(4): 347-57.
4. Neal B, Perkovic V, Mahaffey KW, et al: Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. New England Journal of Medicine 2017; 377(7): 644-57.
5. Marso SP, Daniels GH, Brown-Frandsen K, et al: Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. The New England journal of medicine 2016; 375(4): 31122.
6. Marso SP, Bain SC, Consoli A, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. New England Journal of Medicine 2016; 375(19): 1834-44.
7. Hedrington MS, Davis SN. Oral semaglutide for the treatment of type 2 diabetes. Expert opinion on pharmacotherapy 2018: 1-9.
8. Exenatide drug label. https://www.accessdata.fda.gov/ drugsatfda_docs/label/2018/021773s041lbl.pdf# 瀏覽日 期: 2019/07/01.
9. Liraglutide drug label. https://www.accessdata.fda.gov/ drugsatfda_docs/label/2019/022341s031lbl.pdf# 瀏覽日 期: 2019/07/01.
10. Dulagiutide drug label. https://www.accessdata.fda.gov/ drugsatfda_docs/label/2019/125469s023lbl.pdf# 瀏覽日 期: 2019/07/01.
11. 林麗梅、陳立偉、羅嘉盈、陳玉瑩 第二型糖尿病病人使用Exenatide之療效與安全性評估. 臺灣臨床藥學 雜誌 2013; 21(4): 313-20.
12. Chen YH, Lin KW, Shao SC, Chan YY , Chen HY . The real-world effectiveness of glucagon-like peptide-1 receptor agonist treatment in patients with type 2 diabetes mellitus: Multi-institutional cohort study in taiwan. JACCP Journal of the American College of Clinical Pharmacy 2018; 1(2): 255-6.
13. Su-Chen Niu F-SL, Chi-Hua Chen. Diabetic Mellitus with Liraglutide Treatment: A Case Report. The Journal of Taiwan Pharmacy 2017; 33(2).
14. Psarou A, Cooper H, Wilding JPH. Patients' Perspectives of Oral and Injectable Type 2 Diabetes Medicines, Their Body Weight and Medicine-Taking Behavior in the UK: A Systematic Review and Meta-Ethnography. Diabetes therapy : research, treatment and education of diabetes and related disorders 2018; 9(5): 1791-810.
15. Davies M, Pieber TR, Hartoft-Nielsen ML, Hansen OKH, Jabbour S, Rosenstock J. Effect of Oral Semaglutide Compared With Placebo and Subcutaneous Semaglutide on Glycemic Control in Patients With Type 2 Diabetes: A Randomized Clinical Trial. JAMA 2017; 318(15): 146070.
16. Aroda VR, Rosenstock J, Terauchi Y, et al. Effect and Safety of Oral Semaglutide Monotherapy in Type 2 Diabetes—PIONEER 1 Trial. Diabetes 2018; 67(Supplement 1): 2-LB.
17. Husain M, Birkenfeld AL, Donsmark M, et al. Oral Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. New England Journal of Medicine 2019.
18. Baekdal TA, Breitschaft A, Navarria A, Hansen CW. A randomized study investigating the effect of omeprazole on the pharmacokinetics of oral semaglutide. Expert opinion on drug metabolism & toxicology 2018; 14(8): 86977.
通訊作者:吳昇曄/通訊地址:桃園市龜山區復興街5號
服務單位:林口長庚紀念醫院藥劑部藥師/聯絡電話:(O) 03-3281200 ext 2770