嗜鉻細胞瘤危象之藥物治療
林口長庚紀念醫院藥劑部藥師 李淨芬
林口長庚紀念醫院藥劑部藥師、新生醫護管理專科學校長期照護科兼任講師 蔡慈貞
摘要
嗜鉻細胞 (chromaffin cells) 分佈在人體的腎上腺髓質 (adrenal medulla) 以及交感神經節等部位,負責分泌腎上腺素 (epinephrine) 和正腎上腺素 (norepinephrine) 等兒茶酚胺 (catecholamine) 激素,而嗜鉻細胞瘤 (pheochromocytoma) 為嗜鉻細胞不正常增生,多數發生於腎上腺髓質,少數發生於腎上腺之外,稱為副神經節瘤 (paraganglioma),兒茶酚胺分泌不正常時會造成繼發性高血壓 (secondary hypertension),血壓升高可能是突發性或陣發性。嗜鉻細胞瘤危象 (pheochromocytoma crisis, PCC) 是危及生命的兒茶酚胺分泌過多的內分泌急症,臨床表現包括:嚴重血液動力學不穩定而引起昏倒、多重器官損傷、體溫過高以及腦病變。保持高度的懷疑有助於及早診斷嗜鉻細胞瘤危象,初期以支持性療法和藥物治療為病人提供最大的存活機會。手術切除可以根治,然而在危象時期必須先給予藥物控制,以達到術前的血壓穩定,α-受體阻斷劑 (α-blockers) 為首選的血壓穩定劑。
關鍵字:嗜鉻細胞瘤、副神經節瘤、兒茶酚胺、嗜鉻細胞瘤危象、α-受體阻斷劑
壹、前言2,3
嗜鉻細胞瘤會引起兒茶酚胺的不正常分泌,嗜鉻細胞除了分佈於腎上腺髓質,也分佈於交感神經節,腎上腺之外的嗜鉻細胞瘤,也稱為副神經節瘤 (paraganglioma),其臨床表現典型的三聯症 (classic triad):盜汗、頭痛和心悸。嗜鉻細胞瘤危象 (pheochromocytoma crisis, PCC) 或稱嗜鉻細胞瘤多系統危象 (pheochromocytoma multisystem crisis, PMC) 是危及生命的兒茶酚胺分泌過多的內分泌急症,臨床表現四聯症 (classic tetrad):嚴重血液動力學不穩定引起昏倒、多重器官損傷、體溫過高和腦病變。病人血壓非常不穩定,範圍可以從嚴重的低血壓到嚴重的高血壓 (如:收縮壓範圍60-250 mmHg),如果沒有及時治療,有顯著的死亡率。手術治療是目前根治嗜鉻細胞瘤危象的方法,為避免發生手術中相關的併發症,病人通常先接受10-14天的抗高血壓藥物治療,待血壓穩定後再擇期住院手術,而抗高血壓藥物以α-受體阻斷劑為首選。
貳、嗜鉻細胞瘤危象介紹
一、流行病學1
多數患者之嗜鉻細胞瘤位於腎上腺 (85-90%),腎上腺之外的嗜鉻細胞瘤患者佔少數,該腫瘤位於交感神經內分泌系統,沿著脊柱旁和腹主動脈旁分佈軸。嗜鉻細胞瘤在美國的年發生率大約是每百萬人口中有2至8位,佔高血壓患者0.2-0.4%。此病確診時大多在20至40多歲左右,但也可能出現在幼兒和老年人。大約25%至33%的嗜鉻細胞瘤或副神經節瘤的人屬於遺傳症候群。一項回溯性研究,137名接受病理組織檢查確診的嗜鉻細胞瘤患者,有25名 (18%) 曾經發生嗜鉻細胞瘤危象;另一研究顯示,81名接受腹腔鏡腎上腺切除術的嗜鉻細胞瘤患者,有8名 (10%) 曾經發生危象情形。
二、病理學2,3
嗜鉻細胞瘤合成兒茶酚胺的能力是一般嗜鉻細胞的27倍,而腫瘤大小與兒茶酚胺分泌量相關,大量產生的腎上腺素與正腎上腺素直接作用α1接受器,引起血管收縮,另外也作用於突觸前α2接受器,抑制正腎上腺素的釋放,減少週邊血管阻力,降低血壓和心跳,引起低血壓;此外,兒茶酚胺也作用於心肌細胞上的β1接受器,引起強心作用,升高血壓。需注意 epinephrine 也作用於β2接受器,引起平滑肌鬆弛而影響血壓。
由於兒茶酚胺大量釋放,引起極度的血管收縮,相對地導致血管內容量減少,影響終端器官 (end-organ) 血液灌流,最後多重器官因缺血而受損。另外,兒茶酚胺對心肌細胞可能有直接毒性,引起心肌病變 (cardiomyopathy) 或冠狀動脈血管痙攣。
三、誘發因子3
嗜鉻細胞瘤發作可能與兒茶酚胺釋放突然增加有關,引起廣泛的全身性作用,導致器官損傷。誘發因子包括:自發性原因、身體的移動、手術、藥物以及含酪胺 (tyramine) 的食物,相關誘發因子 (表一)。
表一 引起嗜鉻細胞瘤危象的原因3
四、臨床表現2-4
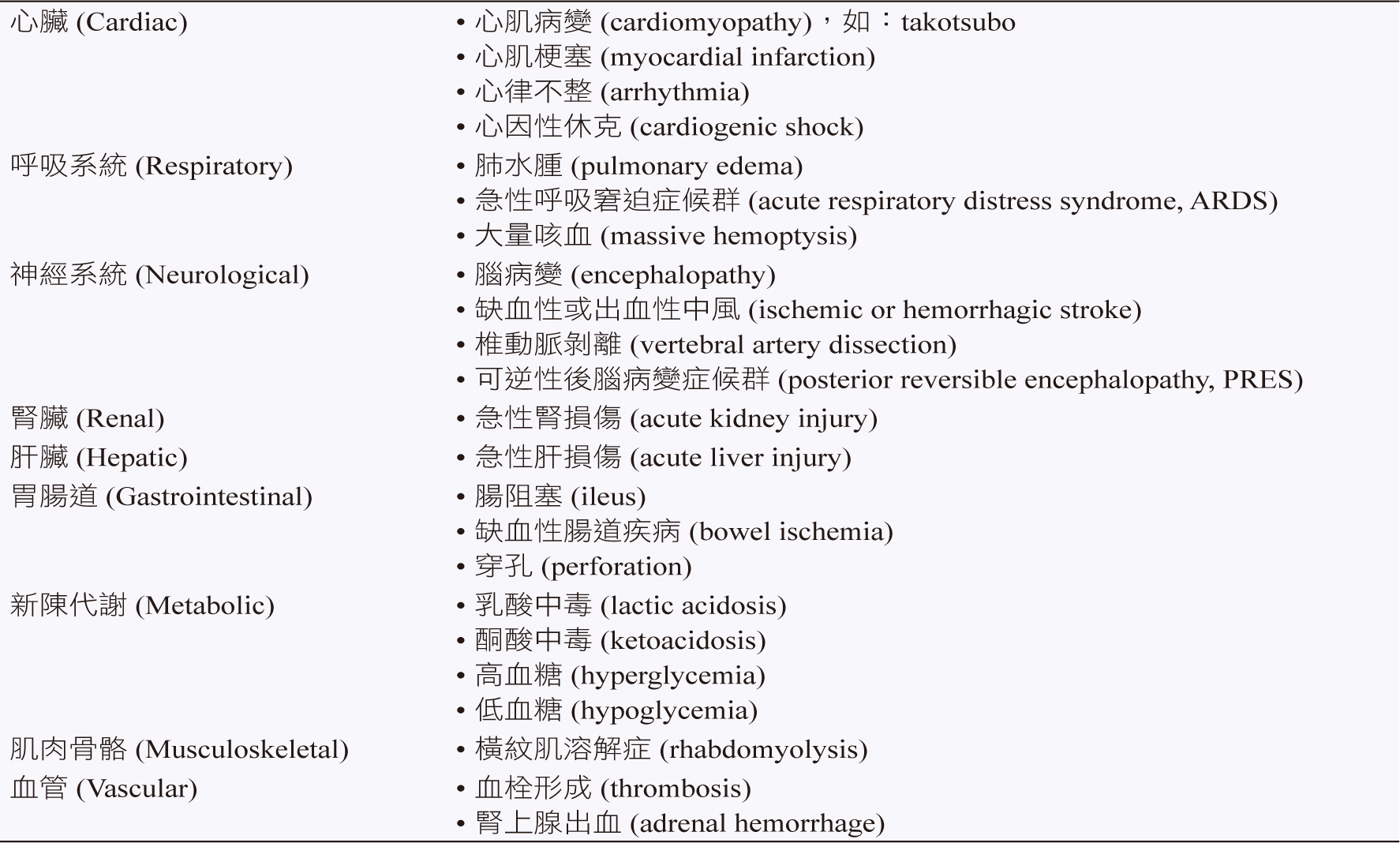
嗜鉻細胞瘤發作時會表現典型的三聯症:盜汗、頭痛和心悸;而嚴重的嗜鉻細胞瘤危象臨床表現四聯症:嚴重血液動力學不穩定引起昏倒、多重器官損傷、體溫過高 (> 40°C) 以及腦病變。由於過量的兒茶酚胺分泌,引起極度的血管收縮,而相對地引起血容量不足 (intravascular volume contraction),導致終端器官因缺血而灌流不足,引起器官損傷,表二為嗜鉻細胞瘤危象引起器官功能障礙可能的臨床表現。
表二 嗜鉻細胞瘤危象引起器官功能障礙之臨床表現2
表四 嗜鉻細胞瘤危象之抗高血壓藥物2
五、診斷2,5,6
不明原因的高血壓危象引起休克、左心室衰竭或多重器官損傷都應考慮可能是嗜鉻細胞瘤危象,及時確診並治療可以提高存活率,初步檢查包括24小時尿液收集,檢測catecholamines、metanephrines、vanillylmandelic acid (VMA),或抽血檢查 catecholamines 和 metanephrines,需注意採血時間與併用藥物可能影響判讀,研究顯示 catecholamines 檢驗值平均高於正常上限值23倍。影像學檢查例如:電腦斷層掃瞄 (computed tomography, CT)、核磁共振顯影 (magnetic resonance imaging, MRI) 或 MIBG 腎上腺髓質掃描 (adrenal medulla scintigraphy),此造影所使用的 MIBG (Metaiodo Benzylguanidine) 為類似正腎上腺素的藥劑,MIBG 會聚積在儲有 catecholamine 的腎上腺髓質嗜鉻細胞或是交感神經末鞘內,對於診斷嗜鉻細胞瘤有較高的敏感度,如此透過全身掃瞄的技術能尋找異位或轉移的嗜鉻細胞瘤。經手術切除的腫瘤在病理組織切片下可知細胞分化情形,藉以評估腫瘤良性或惡性。
參、嗜鉻細胞瘤危象之處置2,3
對於沒有轉移的嗜鉻細胞瘤,手術切除原發病灶是明確的方法,然而緊急的嗜鉻細胞瘤危象,在手術前應努力控制不穩定的血壓,待門診治療血壓穩定後再擇期住院治療,以確保術中安全。有關術前嗜鉻細胞瘤危象的處置,除了臨床環境監測及輸液復甦 (fluid resuscitation),使用不同機轉的抗高血壓藥物是必要的,而對於極度血液動力學不穩定的病人,可能需要主動脈內氣球幫浦 (intra-aortic balloon pump, IABP) 或是葉克膜 (extracorporeal membrane oxygenation, ECMO) 等機械性輔助循環系統,以幫助病人脫離險境,相關術前處置介紹如下:
一、臨床環境監測2
由於不穩定的血液動力學,嗜鉻細胞瘤危象患者必須住進加護病房,密切監測生命徵象,及時給予循環支持與護理照護。
二、輸液復甦2
嗜鉻細胞瘤危象患者因遭受極度的血管收縮,導致血管內相對的低血容量,臨床表現一開始雖不明顯,但是當給予具有血管舒張的降壓藥物時,則可能發生明顯的低血容,導致低血壓,因此在給予α受體阻斷劑或其它抗高血壓藥物之前,應先給予晶體輸液 (crystalloid fluid infusion),以預防嚴重的低血壓,然而病人若有嚴重的左心室衰竭,則需要謹慎給予輸液。
三、藥物治療2,3,6
嗜鉻細胞瘤發作時應使用不同機轉的藥物控制危急的高血壓和心跳過快,α-受體阻斷劑為第一線治療藥物,可作為手術前的血壓穩定劑,相關藥物整理如表四,介紹如下:
(一)α-受體阻斷劑 (α-blockers)
1.非選擇性α-受體阻斷劑
Phenoxybenzamine (POB) 是具有較長半衰期的非選擇性不可逆的α-blocker,除了阻斷α1受體,也阻斷α2受體,引起神經末梢釋放正腎上腺素,因而刺激心臟的β1受體,引起心跳加快,所以 POB 雖然減少血壓升高風險,但也可能引起心跳過快。POB 口服起始劑量為10 mg 一天兩次,每隔2-3日慢慢增加劑量到20-40 mg,一天二次或三次,手術前使用10-14天,血壓控制目標為130/80 mmHg。Phentolamine 為短效的非選擇性可逆的α-blocker,可控制手術中的高血壓,副作用為反射性心搏過速、鼻充血和姿勢性低血壓。
2.選擇性α1受體阻斷劑
選擇性α1-受體阻斷劑 (如:doxazosin),發生反射性心跳過快之機率較非選擇性α-受體阻斷劑低。研究顯示,關於手術前嗜鉻細胞瘤的血壓控制,非選擇性α-受體阻斷劑和選擇性α1受體阻斷劑效果相當,然而使用選擇性α1-受體阻斷劑者手術中發生短暫低血壓機會較高,血壓波動也較明顯,但並不會因此延長病人住院時間或增加併發症7。
(二)β受體阻斷劑 (β-blockers)
β受體阻斷劑用於嗜鉻細胞瘤心搏過速的病人,治療持續性的心跳過快,通常在α受體阻斷劑後給予,因β2受體具有血管平滑肌鬆弛作用,如果給予β受體阻斷劑,會抑制了血管擴張作用而加重血液動力學不穩定,惡化高血壓危象,即使隨後加上α受體阻斷劑也發揮不了明顯作用。此外,嗜鉻細胞瘤危象病人,因血管內低血容量,若給予β阻斷劑會阻斷反射性心跳增加作用,發生低血壓,故臨床上應先給予α受體阻斷劑以及輸液治療,待2至3天α受體阻斷劑發揮作用後,再給予β受體阻斷劑。Labetalol 因為β受體阻斷作用大於α受體,可能惡化高血壓危象,應避免使用。如果臨床需要,建議使用短效低劑量的β受體阻斷劑,如:esmolol、propranolol,臨床需密切監測心跳。
(三)鈣離子通道阻斷劑 (calcium-channel blockers, CCB)
單獨使用 phenoxybenzamine 無法控制血壓時,可加上短效的鈣離子通道阻斷劑,如:nifedipine、verapamil 或 diltiazem,或超短效的 nicardipine,雖然病人較能夠耐受 CCB 的副作用,然而效果不及α受體阻斷劑,故通常不作為第一線藥物治療。
(四)Metyrosine (α-methyl-para-tyrosine)
Metyrosine 可抑制酪氨酸羥化酶(tyrosine hydroxylase),阻斷兒茶酚胺合成的第一步驟,然而,metyrosine 有嚴重的不良反應,包括精神障礙、錐體外症狀和鎮靜。
(五)硝普鈉 (sodium nitroprusside)
Sodium nitroprusside 為強有力的血管擴張劑,作用迅速持續時間短,用於術中控制高血壓發作,以0.3-2 mcg/kg/min 靜脈輸注給藥,為了避免發生氰化物中毒,輸注速率應小於2 mcg/kg/min。
(六)硫酸鎂 (Magnesium sulfate)
由於鎂離子可以減少細胞內鈣離子的濃度,故硫酸鎂可作為鈣離子拮抗劑,抑制嗜鉻細胞釋放兒茶酚胺,也可引起小動脈血管擴張,校正高血壓,促進手術中血壓的穩定,預防或改善心律不整。
四、手術治療5,8
手術切除腫瘤是根治嗜鉻細胞瘤危象的方法,手術前先接受藥物治療,待血壓穩定後擇期住院手術,倘若在血液動力學不穩定時切除腫瘤,可能增加死亡率及併發症風險。Anouk Scholten 作者等人回溯性研究嗜鉻細胞瘤切除手術之最佳時機,分析1993至2011年手術切除嗜鉻細胞瘤患者之預後,共有25名為嗜鉻細胞瘤危象患者,其中15人住院中藥物治療穩定後出院,另外擇期住院手術,10人於住院中藥物治療後緊急手術切除,結果顯示,相較於緊急手術者,非緊急手術的嗜鉻細胞瘤危象患者之術後住院天數較短、住進加護病房人數較少且手術併發症發生機率較低。作者另外回顧1944-2011年有關嗜鉻細胞瘤危象患者在不同時機下之手術預後相關文獻,結果顯示,不論是手術中或手術後,非緊急手術患者併發症較少且死亡率較低。由以上證據,患者先接受藥物控制,待血壓穩定後再擇期住院手術,可以有效降低手術死亡率及併發症。
肆、結論
危及生命的嗜鉻細胞瘤危象是兒茶酚胺分泌過多的內分泌急症,如果沒有及時治療,有顯著的死亡率,手術治療是根治的方法,術前接受10-14天的α-blocker,待血壓穩定後,另外擇期住院手術。在危象時期,藥物治療先給予α-blocker,待2至3天α-blocker 發揮作用後再給予β-blocker,若病人血液動力學不穩定,可以使用短效β-blocker 和短效 calcium-channel blocker 以控制心跳和血壓,而 labetalol 應避免使用,如果能及時發現並治療,嗜鉻細胞瘤危象經過適當的治療一般是可逆的。
Medication Therapy for Pheochromocytoma Crisis
Ching-Fen Lee1, Tzu-Cheng Tsai1,2
Department of Pharmacy, Chang-Gung Memorial
Hospital, Linkou1
Department of Long Term Care, Hsin Sheng College
of Medical Care and Management2
Abstract
Chromaffin cells are distributed in the adrenal medulla and sympathetic ganglia, and responsible for the secretion of catecholamine hormones such as epinephrine and norepinephrine. Pheochromocytoma is the abnormal proliferation of chromaffin cells and most of which occurs in the adrenal medulla. Moreover, extra-adrenal chromaffin tumors are called paraganglioma. Abnormal catecholamine secretion may cause secondary hypertension and elevate blood pressure. The pheochromocytoma crisis (PCC) is a life-threatening endocrine emergency with excessive secretion of catecholamines. The clinical presentation is often paroxysmal and some present with characteristic symptoms such as severe hemodynamic instability, multi-organ dysfunction, hyperthermia and encephalopathy. Maintaining a high degree of clinical suspicion will facilitate prompt diagnosis of PCC, and utilizing the best available supportive treatments will give the patient the best chance of survival. Emergency surgery should be discouraged as an initial treatment of PCC. Medication therapy and elective surgery should be the preferred management. Furthermore, α-blockers are the drug of choice for blood pressure control.
參考資料:
1. Guerrero, M.A, Schreinemakers JM, Vriens MR, et al: Clinical spectrum of pheochromocytoma. J Am Coll Surg 2009; 209(6):727-32.
2. Whitelaw BC, Prague JK, Mustafa OG, et al: Phaeochromocytoma crisis. Clin Endocrinolf 2014;80(1):13-22.
3. Castelino T and Mitmaker E: Pheochromocytoma Crisis. Clinical Management of Adrenal Tumors 2017;103-114.
4. Wu R, Tong N, Chen X, et al: Pheochromocytoma crisis presenting with hypotension, hemoptysis, and abnormal liver function. Medicine 2018; 97(25):e11054-e11057.
5. Scholten A, Cisco RM, Vriens MR, et al: Pheochromocytoma crisis is not a surgical emergency. The Journal of Clinical Endocrinology & Metabolism 2013; 98(2):581-591.
6. Lenders J and Eisenhofer G: Update on modern management of pheochromocytoma and paraganglioma. Endocrinology and Metabolism 2017; 32(2).152-161.
7. Randle RW, Balentine CJ, Pitt SC, et al: Selective versus non-selective alpha-blockade prior to laparoscopic adrenalectomy for pheochromocytoma. Ann Surg Oncol 2017; 24(1):244-250.
8. Ramakrishna H: Pheochromocytoma resection: Current concepts in anesthetic management. J Anaesthesiol Clin Pharmacol 2015; 31(3):317-23.
通訊作者:李淨芬/通訊地址:桃園市龜山區舊路里頂湖路123號
服務單位:桃園長庚紀念醫院行政中心藥材管理部藥師/聯絡電話:(O) 03-3196200 ext 3424