RA病患使用Immunosuppressants
造成HBVr之探討
林口長庚紀念醫院藥劑部藥師 呂慧煖、蕭旋玲
林口長庚紀念醫院藥劑部藥師、新生醫護管理專科學校兼任講師 蔡慈貞
摘要
B型肝炎病毒復發(hepatitis B virus reactivation, HBVr)常被討論於接受化學治療或是器官移植後使用免疫抑制劑的病人族群,隨著免疫抑制劑在過去20年間蓬勃發展,有許多文獻探討抗腫瘤壞死因子(tumor necrosis factor inhibitor, TNF inhibitor)使用於發炎性關節疾病,如風濕性關節炎(rheumatic arthritis, RA)及乾癬性關節炎(psoriasis arthritis),皆與B型肝炎病毒復發有關。對於使用其他非抗腫瘤壞死因子的生物製劑(biologics)如abatacept及tocilizumab,也有發生B型肝炎病毒復發的案例報告。本文將針對風濕性關節炎病人使用免疫抑制劑與B型肝炎病毒復發相關的發生率、藥品風險等級、治療與預防及預後等相關範疇作進一步探討。
關鍵字:免疫抑制劑、B型肝炎病毒復發、風濕性關節炎
壹、 前言
B 型肝炎病毒感染是造成慢性肝臟發炎、肝硬化甚至是肝癌的主要原因。全球約有2.48億的人口遭受B型肝炎病毒感染1。據WHO統計,從西元1990-2005年,B型肝炎帶原者的人口從2.23億上升至2.4億。台灣屬於中高度流行區域,盛行率大約為5-7%2,3。
B型肝炎病毒復發(hepatitis B virus reactivation, HBVr)對於長期使用免疫抑制劑的族群來說,是個潛在且嚴重的疾病,較可能發生於B型肝炎病毒表面抗原陽性/核心抗原抗體陽性(HBsAg(+)/Anti-HBc(+))之族群4,5。B型肝炎病毒表面抗原陽性並接受免疫抑制劑或是化學治療藥物的病人約有20至50%的機率會發生病毒復發6。B肝表面抗原陽性(HBsAg(+))相較於接受治療後血清陽轉陰(seroconversion) 之B型肝炎(HBsAg(-))患者的病毒復發率增加約5-8倍的機率7。HBVr的機率在接受抗腫瘤壞死因子(TNF inhibitor)治療的HBsAg(+)風濕性關節炎患者中約15-39%,若為HBsAg(-)者則約3-5%8。
B型肝炎病毒復發可能引起嚴重的肝臟發炎甚至造成肝衰竭而死亡,用於風濕科的免疫抑制劑,需長期使用且病人族群廣泛,治療療程常合併疾病修飾抗風濕病藥物(disease modified antirheumatic drugs, DMARDs)及類固醇,此兩類藥物本身即有引起病毒復發的風險,藥物併用也會使風險提高,因此B型肝炎病毒復發在需長期使用免疫抑制劑的風濕性關節炎病人是值得被關注的。
貳、 B型肝炎病毒復發定義
B型肝炎病毒復發通常是指以下情況之一:
一、與基礎值相比,DNA病毒量突然上升大於10倍以上
二、病毒DNA由陰性轉為可測得
三、有無合併HBV DNA>10,0000 copies/mL (20,000 IU/mL)4,6
四、表面抗原出現陰性轉陽性5
預測病毒復發的最好指標為HBV DNA病毒量4。若短暫時間內HBV DNA病毒量上升且合併丙胺酸轉胺酶(alanine transaminase, ALT)上升3倍以上,並且出現肝炎症狀則為肝炎復發4。病人表徵可能從沒有症狀、肝指數上升到有症狀的黃疸、倦怠、肝炎發作、甚至是肝衰竭4,5,7。
參、 DMARDs藥品定義及治療指引9
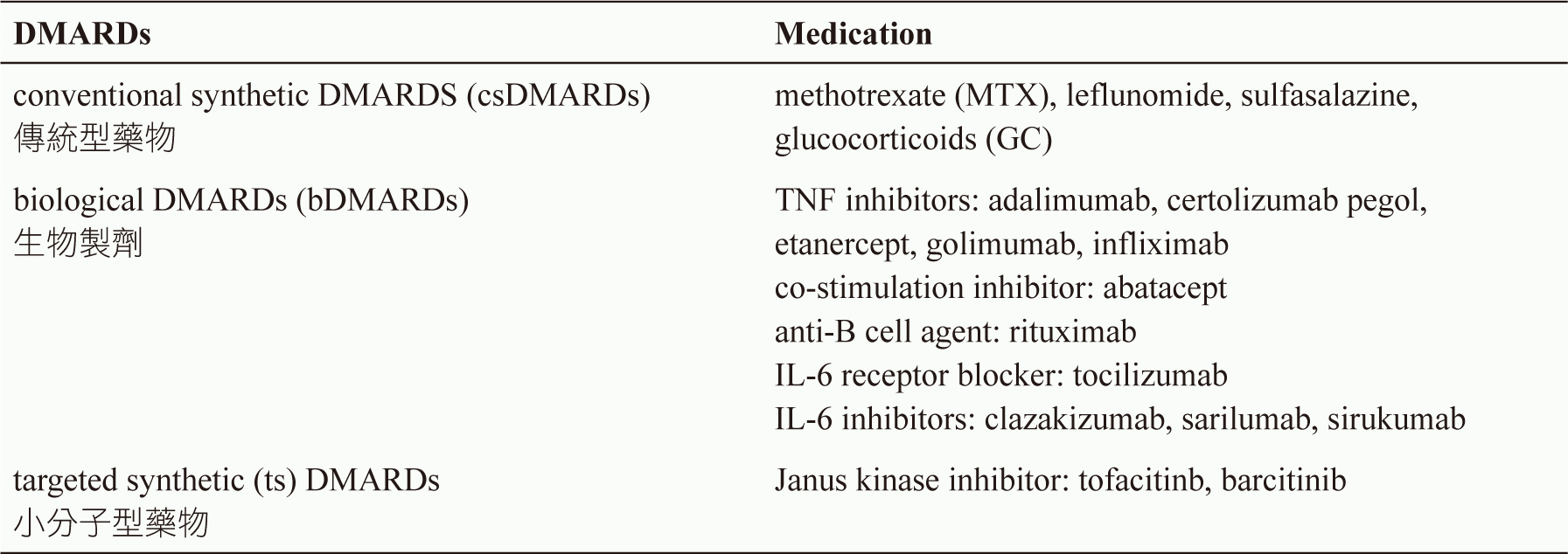
2016歐洲抗風濕聯盟(European League Against Rheumatism, EULAR)在風濕性關節炎治療中將DMARDs分為三類(表一)9:
表一 DMARDs的藥物分類
在風濕性關節炎治療中,依照疾病的嚴重程度不同,DMARDs單一療法或是合併治療是相當常見的,疾病治療以達到低疾病活動程度為目標9,10。
肆、 討論
一、 DMARDs與B型肝炎病毒復發的文獻探討
2017年由Ming-Han Chen等人所發表的台灣單中心回溯性研究中6,試驗總收錄2,334位風濕性關節炎並使用DMARDs病人,其中有123位為HBsAg(+)帶原者,平均一位病人追蹤28.1個月,有30位病人(24.4%)發生了B肝病毒復發,使用免疫抑制劑到發生HBVr的平均時間為13.6+ 11.5月。接受DMARDs治療與發生HBVr具統計學意義 (p= 0.002)。接受類固醇治療增加2.29倍病毒復發的風險(p= 0.03),使用生物製劑增加1.81倍的風險,但未達到統計意義(p= 0.11),類固醇合併DMARDs及生物製劑的三種藥物合併治療與單一使用DMARDs相比, HBVr風險增加5倍 (p= 0.0009)。三種藥物的合併治療與生物製劑合併DMARDs治療相比,多了類固醇使用提高B肝病毒復發達6.6倍(p= 0.005)。在生物製劑中rituximab為 B 肝病毒復發機率最高的藥物(RR= 16.51, p= 0.01)。研究發現B肝病毒復發的病人基礎B肝病毒量皆較高(p= 0.03),代表病人基礎病毒量與B肝病毒復發有顯著相關。在病毒復發的預後部分,發生病毒復發的病患皆給予抗病毒藥物治療,包括entecavir、lamivudine、telbivudine或adefovir;其中43.3%病患發生嚴重肝炎,16.7%病患因為延遲了抗病毒藥物給予而發生肝臟代償功能失調,10%病患因肝衰竭而死亡。在死亡率部分,B肝病毒復發組有增加死亡率的趨勢(adjusted HR= 8.33; p= 0.09) 6。
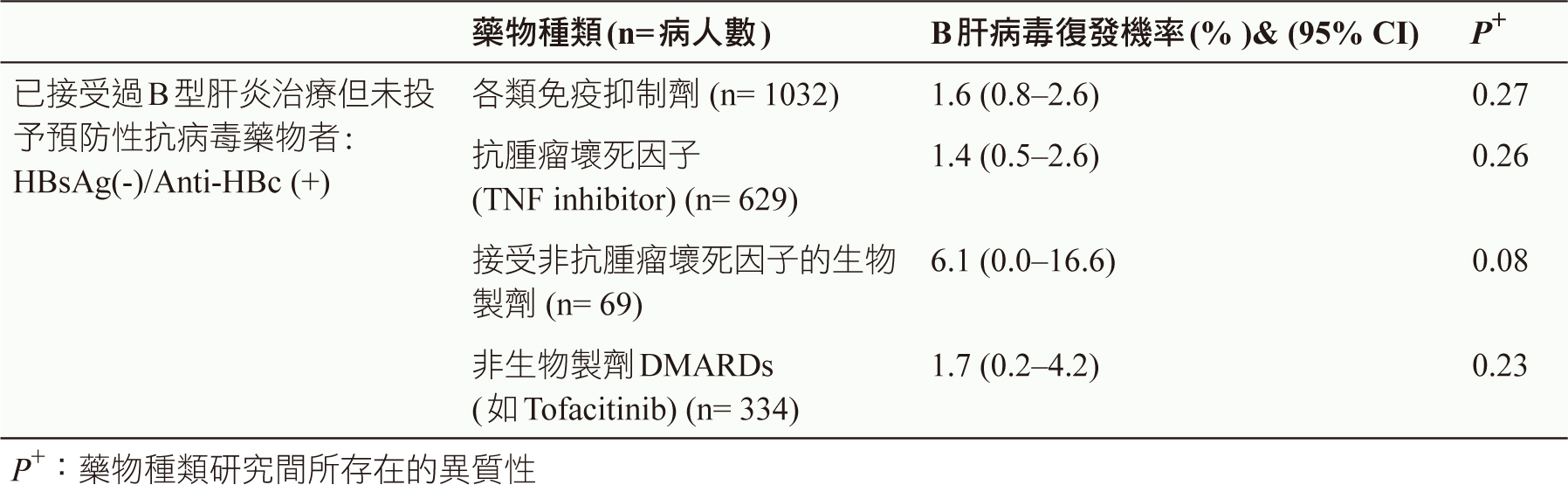
2018年LIN所發表的統合分析,研究目的為探討發炎性關節炎病人接受DMARDs的B肝病毒復發機率,分析了25篇研究(共1032位病人),其結果如(表二)所示:
表二 接受B肝治療的發炎性關節炎病人使用免疫抑制劑發生病毒復發機率7
合併使用低劑量類固醇(每天5-10毫克prednisolone)及傳統DMARDs在已接受B型肝炎治療的病患中,發生病毒復發機率為1.6%,此與2015年美國腸胃道學會(AGA, American Gastroenterologic Association Institute)所發表的治療指引中所提到:單用傳統DMARD或低劑量類固醇而發生B肝病毒復發率<1%相比來的高,顯示合併用藥可能提高了病毒復發風險。
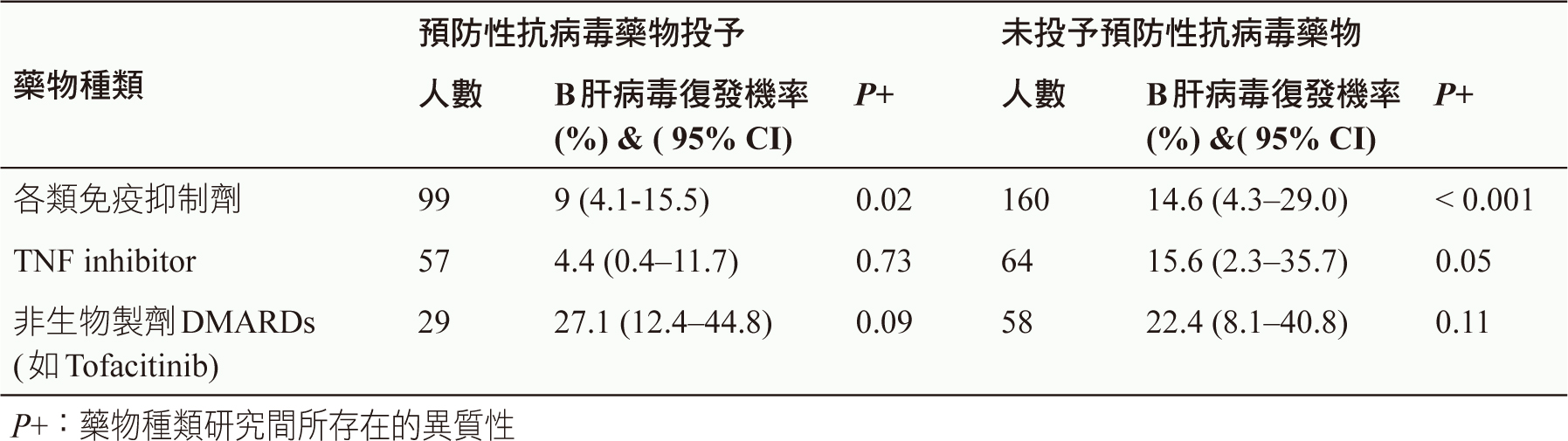
在預防性病毒藥物的投予結果(表三),結論為慢性B肝患者接受預防性抗病毒藥物,發生B肝病毒復發風險皆小於沒有投予抗病毒藥物者,可見抗病毒藥物下降B肝病毒復發風險7。
表三 慢性B肝(HBsAg+)發炎性關節炎病人接受預防性抗病毒藥物的復發機率7
二、 免疫抑制劑引起的B肝病毒復發風險等級
許多研究都已經證實給予預防性抗病毒藥物可以降低免疫抑制劑所帶來的病毒復發風險4,5。目前使用免疫抑制劑前篩檢HBsAg和Anti HBc具一致共識4。
2015年美國腸胃道學會在探討B肝病毒復發的預防與治療指引中,將可能引起B肝病毒復發的免疫抑制劑作了排名 (證據等級分ABCD)(表四),其中以rituximab風險最高(>10%)。
表四 免疫抑制劑可能引起的B肝病毒復發風險4
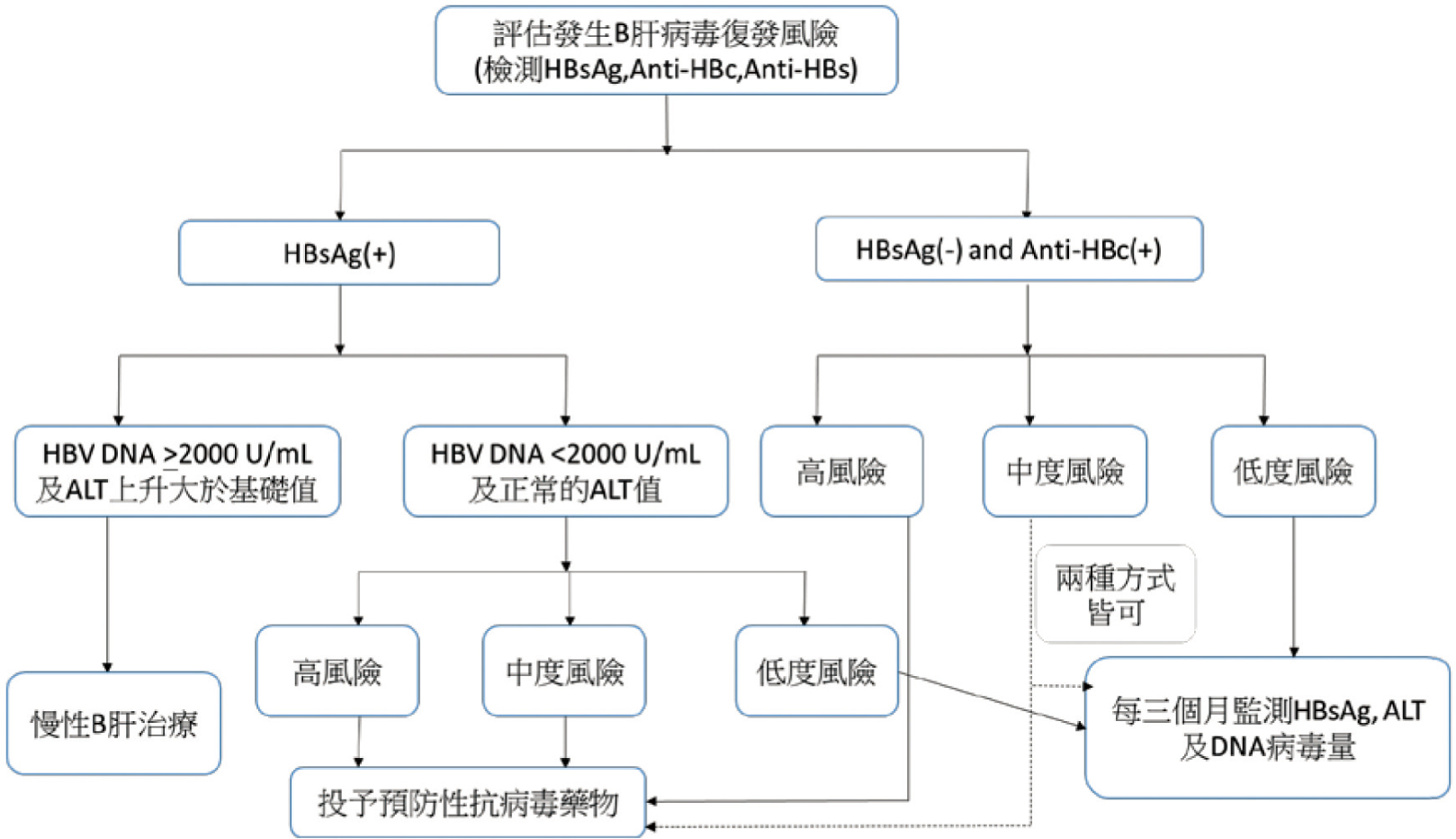
由於HBVr與(1)病患基礎的血清指標,(2)免疫抑制劑種類,及(3)病患本身疾病狀態有關,因此在使用免疫抑制劑之前,應先評估上述因素後,再決定是否需要給予抗病毒藥物作為預防或是進行監測即可(圖一)4,5。
圖一 免疫抑制劑與B肝病毒風險的處理
三、 篩檢、監測及抗病毒藥物給予之探討
(一) 進行免疫抑制劑治療前預防性抗病毒藥物的給藥時機
AGA建議對於HBsAg(-)/Anti-HBc(+)者,但有檢測到HBV DNA者,或是使用高風險藥物治療如rituximab者,應比照HBsAg(+)病人給予預防性抗病毒藥物,2017年的歐洲肝病研究協會(European Association for the Study of Liver Disease, EASL)也做出相同建議4,11。
(二) 預防性抗病毒藥物的療程與監測
對於HBsAg(+)病人投予預防性抗病毒藥物,可以在使用免疫抑制劑前2-4週開始給予至停止免疫抑制劑治療的6個月後;若是使用高風險藥品如rituximab,則可以持續使用至停止免疫抑制劑治療的12個月後 4,5。在給予抗病毒藥物期間,應每3-6個月監測肝功能及HBV DNA至停止免疫抑制劑治療的12個月後4,5。
若是曾經接受B肝治療(HBsAg(-)/Anti-HBc(+)),但檢測出HBV DNA者,則建議比照HBsAg(+)者給予預防性藥物4,5。若是接受中度風險藥品者,可以考慮給予預防性抗病毒藥物,或是與接受低風險藥品相同,每1-3個月監測HBsAg、HBV DNA及ALT值,若一旦驗出HBV DNA上升或是B型肝炎表面抗原陰轉陽性,再給予抗病毒藥物治療5,11。
(三) 預防性抗病毒藥物的選擇
lamivudine使用超過一年以上有較高機率出現抗藥性,第一年約20%,第2年為30%, lamivudine鮮少在使用6-9個月即發生抗藥性,若作為預防性抗病毒藥物是有效的,且具有價格優勢,特別是在醫療資源相對匱乏的地區4,5,11;但若是有可能使用一年以上之療程,則lamivudine就不適合使用5。Entecavir與 tenofovir,藥物療效與lamivudine相當且出現抗藥性的機率更低,因此目前預防性給藥已不再建議使用lamivudine,且一旦出現抗藥性,再使用其他藥物治療效果也會受到影響4,5,11,12。Telbivudine及adefovir也可作為預防性用藥,其抗藥性還是比entecavir及tenofovir稍差5,12。對於醫療資源匱乏的地區,或是帶有HBsAg(+),但沒有驗到HBV DNA病毒量者,lamivudine、telbivudine,或adefovir是仍可列入預防性抗病毒藥物的選項5。
(四) 治療B肝病毒復發的抗病毒藥物選擇
AGA認為,免疫抑制劑所引起的B肝病毒復發需要較長時間的治療,通常會超過6-9個月,而免疫抑制劑本身會增加lamivudine的抗藥性,因此治療B肝病毒復發,entecavir會比lamivudine更適合4,12。Entecavir 及tenofovir的抗藥性機率較低,tenofovir更有持續使用六年以上沒有出現抗藥性的研究報告4。因此,一旦發生B肝病毒復發則應該要儘速的給予entecavir 或tenofovir4,12
(五) B型肝炎的病毒量監測
定期監測HBV DNA可以提早發現B肝病毒復發,儘早投予治療藥物,可以有效減少肝臟損害;但發生B肝病毒復發的機率不高,且投予預防性抗病毒藥物亦能有效減少病毒復發,而且HBV DNA基因檢測費用高昂,目前文獻對於如何進行HBV DNA監測尚未有一致結論4。
(六) 使用免疫抑制劑前的B肝篩檢
AGA建議免疫抑制劑的HBVr風險在中度 (1-10%)至高度(> 10%),可以篩檢HBsAg及Anti-Hbc4,13;若為HBsAg(+)或是帶有Anti-HBc(+)者,可以篩檢HBV DNA。在低流行區域(<2%)接受低至中度風險的免疫抑制劑者,建議可以只進行HBsAg的篩檢14。美國風濕病學院(American College of Rheumatology, ACR)在2012年風濕性關節炎的治療指引中指出,不應對沒有執行B型肝炎篩檢的病人進行生物製劑治療14。歐洲肝病協會則建議給予免疫抑制劑治療前應檢測HBsAg、Anti-HBs及Anti-HBc5,11,對於HBsAg(-)且Anti-HBc(+)者,可以再驗檢HBV DNA病毒量13。2012年亞洲肝病研究協會則建議使用免疫抑制前皆應做HBsAg篩檢,使用生物製劑者可再篩檢Anti-HBc13。因此使用免疫抑制劑之前仍應該做B肝血清學檢測,HBsAg及Anti-HBc是基本項目5,13。
(七) B型肝炎疫苗
因風濕性關節炎病人本身自身免疫的問題,對於疫苗的抗體反應普遍不佳,疫苗施打尚未有一致建議15。歐洲肝病協會在2017年的B型肝炎感染治療指引中提到,若病人HBV血清學為陰性反應,建議應在給予免疫抑制劑前施打B型肝炎疫苗,若是抗體效價偏低的病人也建議追加疫苗施打11。
綜合上述討論歸納出(表五)。
表五 抗病毒藥物的選擇與B肝病毒監測、篩檢及疫苗注射建議
伍、 結論
B型肝炎病毒復發在風濕性關節炎病人中雖然機率不高但仍不可輕忽,延遲給予抗病毒藥物治療,嚴重者可能會造成病人肝衰竭甚至死亡。本文目的在提醒使用免疫抑制劑於風濕性關節炎患者中可能引起B肝病毒復發的重要性,並提供預防、監測及治療藥物的相關建議。
Risk of Hepatitis B Virus Reactivation in RA Patients under Immunosuppressants
Department of Pharmacy, Chang
Gung Memorial Hospital1
Hsin Sheng College of Medical Care and
Management2
Hui-Hsuan Lu1, Hsuan-Ling Hsiao1, Tzu-Cheng Tsai1,2
Abstract
Hepatitis B virus reactivation (HBVr) has been commonly reported in patients receiving chemotherapy or immunosuppressants for organ transplantation.
In recent 20 years, immunosuppressants such as biologics for rheumatic diseases have been increasingly developed and tremendous safety data have been published accordingly. Tumor necrosis factor (TNF) inhibitors play a pivotal role in HBV reactivation. Not only TNF inhibitors, but also non-TNF inhibitor biologics, such as abatacept, tocilizumab have been reported as the causes of HBVr.
In this review article, we summarize the incidence of HBVr, risk of HBVr in immunosuppressants, the treatment and prevention of HBVr and the prognosis of HBVr induced by immunosuppressants in rheumatic arthritis patients.
參考資料:
1. Lee YH, Bae SC, Song GG. Hepatitis B virus reactivation in HBsAg-positive patients with rheumatic diseases undergoing anti-tumor necrosis factor therapy or DMARDs. International journal of rheumatic diseases. 2013;16(5):527-531.
2. Ott JJ, Stevens GA, Groeger J, et al. Global epidemiology of hepatitis B virus infection: new estimates of agespecific HBsAg seroprevalence and endemicity. Vaccine. 2012;30(12):2212-2219.
3. Sarin SK, Kumar M, Lau GK, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update. Hepatol Int. 2016;10(1):1-98.
4. Perrillo RP, Gish R, Falck-Ytter YT. American Gastroenterological Association Institute technical review on prevention and treatment of hepatitis B virus reactivation during immunosuppressive drug therapy. Gastroenterology. 2015;148(1):221-244 e223.
5. Loomba R, Liang TJ. Hepatitis B Reactivation Associated With Immune Suppressive and Biological Modifier Therapies: Current Concepts, Management Strategies, and Future Directions. Gastroenterology. 2017;152(6):12971309.
6. Chen MH, Chen MH, Liu CY, et al. Hepatitis B Virus Reactivation in Rheumatoid Arthritis Patients Undergoing Biologics Treatment. J Infect Dis. 2017;215(4):566-573.
7. Lin TC, Yoshida K, Tedeschi SK,et al. Risk of Hepatitis B Virus Reactivation in Patients With Inflammatory Arthritis Receiving Disease-Modifying Antirheumatic Drugs: A Systematic Review and Meta-Analysis. Arthritis Care Res (Hoboken). 2018;70(5):724-731.
8. Lin TC, Hashemi N, Kim SC, et al. Practice Pattern of Hepatitis B Testing in Rheumatoid Arthritis Patients: A Cross-National Comparison Between the US and Taiwan. Arthritis Care Res (Hoboken). 2018;70(1):30-38.
9. Smolen JS, Landewe R, Bijlsma J, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis. 2017;76(6):960-977.
10. Singh JA, Saag KG, Bridges SL, et al. 2015 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Care Res (Hoboken). 2016;68(1):1-25.
11. European Association for the Study of the Liver. Electronic address eee, European Association for the Study of the L. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67(2):370-398.
12. Aygen B, Demir AM, Gumus M, et al. Immunosuppressive therapy and the risk of hepatitis B reactivation: Consensus report. Turk J Gastroenterol. 2018;29(3):259-269.
13. Gonzalez SA, Perrillo RP. Hepatitis B Virus Reactivation in the Setting of Cancer Chemotherapy and Other Immunosuppressive Drug Therapy. Clin Infect Dis. 2016;62 Suppl 4:S306-313.
14. Perrillo RP, Martin P, Lok AS. Preventing hepatitis B reactivation due to immunosuppressive drug treatments. JAMA. 2015;313(16):1617-1618.
15. Ferreira I, Isenberg D. Vaccines and biologics. Ann Rheum Dis. 2014;73(8):1446-1454.
通訊作者:呂慧煖/通訊地址:桃園市龜山區復興街5號
服務單位:林口長庚紀念醫院藥劑部/聯絡電話:(O) 03-3281200 ext 3539