摘要
DNA-damage responses (DDR)扮演著基因修復的功能,因此當DDR修復途徑失去功能時,將導致基因的不穩定性以及迫使基因大量依賴殘餘的DDR途徑。也因如此,合成致死(synthetic lethality)的概念被提出用於臨床癌症治療。將合成致死的概念應用在癌症患者,最知名的莫過於BRCA (Breast Cancer)基因突變與PARP (poly ADP-ribose polymerase)抑制劑(PARP inhibitor)的臨床應用。Olaparib為第一個被美國FDA核准用於治療轉移性乳癌的PARP抑制劑,相較一般化療藥物具有較低的疾病進展或死亡風險。透過文獻回顧以瞭解PARP抑制劑在BRCA基因突變之轉移性乳癌角色與機制。
關鍵字: 合成致死(Synthetic lethality)、PARP抑制劑(poly ADP-ribose polymerase inhibitor)、轉移性乳癌(Metastatic breast cancer)、乳癌基因突變(BRCA mutation)
壹、前言
遺傳物質的隨機突變,推動了生命演化。儘管生物多樣性對於演化具有明顯優勢,但基因組的不穩定性在大多數情況下,對於生物體將產生不利影響。生命的主要目標是將完整且未改變的遺傳物質傳遞給下一代,為了達成此目標,生命已經發展了幾種系統來檢測DNA損傷,並發出信號確認損傷位置以進行修復,進而預防多種人類疾病發生。我們透過DNA-damage responses (DDR)的認識,為癌症治療提供新的途徑。例如傳統的放射線以及化學治療,可透過破壞DNA以達到治療腫瘤的目的,然而在此過程中,連帶影響正常細胞的功能而導致顯著的副作用發生。為了減少正常細胞的影響程度以及治療所導致的副作用,針對癌細胞特有的突變基因進行治療則應運而生。例如染色體轉位產生的BCR-ABL融合基因於慢性骨髓性白血病 (chronic myeloid leukemia, CML),imatinib則是BCR-ABL tyrosine kinase抑制劑。例如ERBB2/HER2基因突變導致HER2蛋白質過量表現的乳癌病人,也因為HER2蛋白的單株抗體trastuzumab的研發,大大改善這一型乳癌病人的預後以及降低傳統治療相關副作用。
貳、合成致死(synthetic lethality)的概念
DNA-damage responses扮演著基因修復的功能,因此當DDR修復途徑失去功能時,將導致基因的不穩定性以及迫使基因大量依賴殘餘的DDR途徑。也因如此,合成致死(synthetic lethality)的概念被提出用於臨床癌症治療。合成致死是指兩個非致死基因同時被抑制而導致細胞死亡的現象。因此若發現腫瘤中存在特定基因被抑制,那麼使用藥物抑制另一個相對應的合成致死途徑,將可以特異性殺死癌細胞而不危害正常細胞1。目前,將合成致死的概念應用在癌症患者,最知名的莫過於是BRCA基因突變與PARP抑制劑的臨床應用。
參、BRCA mutation與乳癌相關性
BRCA1基因位於染色體17q21,有24個exon(外顯子),轉譯而成的BRCA1蛋白質共有1863個胺基酸;BRCA2基因則位於染色體13q12-13,有27個exon,轉譯而成的BRCA2蛋白質共有3418個胺基酸。當細胞內雙股DNA損壞,BRCA1與BRCA2將參與DNA修復。因此,若兩個基因其中之一發生突變,便無法將DNA正確修復,當細胞內DNA損壞累積至一定程度時,細胞將會產生癌變。因此帶有BRCA1基因突變的女性,終其一生罹患乳癌或卵巢癌的機率約65%以及39%;帶有BRCA2基因突變的女性則為45%及11%;此風險皆高於未突變者的12.4%以及1.3%2。根據流行病學研究,BRCA1/2基因突變約佔全體乳癌患者的5%3,且具有乳癌或卵巢癌家族史的患者中,約有24%患者具有BRCA1/2基因突變。另外BRCA1/2基因突變也常見於triple negative breast cancer (TNBC,雌性素接受器不表現/黃體素接受器不表現/HER2蛋白不表現)患者,約佔17%;此比例大於賀爾蒙接受器表現型(HR+)患者的6%4,5。亞洲國家也針對此基因進行研究,證實BRCA1與BRCA2在早發性乳癌佔為重要角色。根據台灣乳癌致病性基因的調查資料,13.5%受試病人含有致病性遺傳基因變異,其中以BRCA基因突變8.3%佔比最多6。
乳癌患者平均診斷年齡為62歲,然而根據近期研究,BRCA1基因突變者,平均乳癌診斷年齡為40至44歲,且有很高風險於35歲前發展為TNBC;BRCA2基因突變者平均乳癌診斷則為43至45歲,且癌細胞有較高風險侵襲淋巴腺。BRCA基因突變具有六項臨床風險指標,包括:有乳癌或卵巢癌家族史者、小於40歲乳癌患者、雙側乳癌患者、三陰性乳癌患者、同時患有乳癌及卵巢癌者以及男性乳癌患者6。因此目前National Comprehensive Cancer Network (NCCN)指引建議上述風險狀況,依照不同年齡族群應檢測BRCA基因是否具有突變。然而BRCA基因的突變是否會影響乳癌患者預後,目前各研究結果並不一致,因此仍有待商榷。
肆、PARP抑制劑與轉移性乳癌治療
PARP為BRCA相對應的合成致死途徑。PARP是一種DNA修復酶,負責單股DNA斷裂修復,它會使用nicotinamide adenine dinucleotide (NAD+) 做為受質形成修復複合體,並將ADP-核醣轉移至靶蛋白以促進DNA修復。待DNA修復完成後,PARP與修復複合體便會從DNA解離出來。當PARP活性受到抑制時,會使PRAP與修復複合體無法從DNA上解離出來,導致DNA複製時發生停滯,此停滯效應需BRCA進行修復。假使停滯效應沒有經過BRCA修復,DNA將進一步崩壞而造成雙股DNA破損。因此,如果在BRCA基因突變的細胞給予PRAP抑制劑,便可能使細胞大量堆積損傷的DNA,最後導致細胞凋亡7,8 (圖一)。
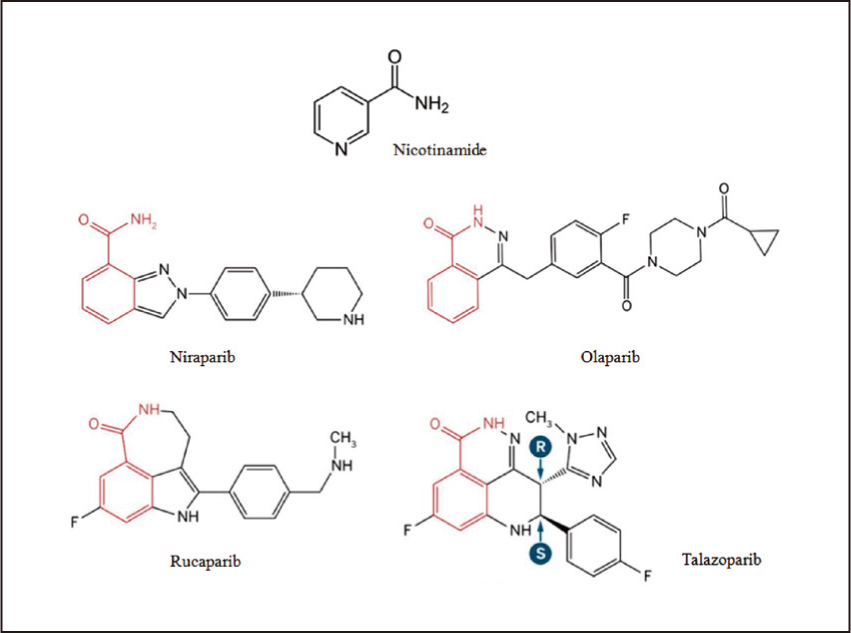
PARP抑制劑藥物設計通常是基於NAD+的nicotinamide部分,模擬NAD+與PARP的作用,因此PARP抑制劑之結構皆含有nicotinamide的骨架9 (圖二)。早期PARP抑制劑開發並不順利,其中iniparib於第三期試驗以失敗告終,但事後發現iniparib並不是一個真正的PARP抑制劑10。PARP抑制劑目前包括:olaparib, niraparib, rucaparib以及talazoparib,主要用於治療卵巢癌。然而olaparib為第一個被美國FDA核准用於治療乳癌的PARP抑制劑。
圖一 PARP抑制劑與BRCA突變的合成致死機制8
圖二 PAPR抑制劑結構骨架11
Olaparib使用於乳癌患者,主要是根據第三期臨床試驗OlympiAD的結果12,研究主要收錄轉移性乳癌且具有下列條件者,包括:BRCA基因突變、TNBC、HER2 negative但ER/PR postive、過去使用兩種以下化療方案、過去接受過anthracycline及taxane類藥物。研究共收錄302位受試者,以2比1的比例隨機分配至olaparib 300 mg口服一天兩次以及標準治療組別。標準治療組別主要是根據醫師的選擇而使用capecitabine或eribulin或vinorelbine。標準治療組別中,42%病患使用capecitabine,35%使用eribulin,17%使用vinorelbine。受試者整體平均年齡為44歲且大多有兩個以上轉移性病變;BRCA基因突變型態約55.6%,屬BRCA1突變,43%屬BRCA2突變;約3成病患過去對於轉移性疾病沒有使用化學治療。研究結果發現olaparib組別對於疾病進展或死亡風險可降低40%以上,progression-free survival中位數為7個月,較標準治療組別4.2個月長,且達統計學上差異。另外,olaparib組別在客觀緩解率(objective response rate, ORR)的部分約6成,高於標準治療組別的3成。
整體存活時間的部分13,olaparib組別為19.3個月,標準治療組別為17.1個月,因研究檢定力不足而無法突顯olaparib的好處。在族群次分析中發現,過去對於轉移性乳癌沒有使用化學治療者,整體存活時間的部分,使用olaparib似乎可以得到額外的好處( HR = 0.51; 95% CI: 0.29–0.90)。Olaparib主要的副作用為腸胃不適,包括:噁心與嘔吐。腸胃道副作用大多在開始使用olaparib一個月內會發生,並且隨著使用時間拉長,副作用發生比例會逐漸降低,而且大多可經過症狀治療而達到緩解。根據統計,開始使用後三個月內噁心感的盛行率約20-30%,爾後隨著時間降低至10-20%,更甚至少數持續使用的患者,使用2年後幾乎看不到相關副作用。與標準治療相比而言,olaparib發生grade大於3的副作用比例較低,但在貧血的副作用比例則較標準治療組別高。
伍、結論
合成致死為治療癌症的另一道途徑。透過發現腫瘤中存在特定基因的突變,使用藥物抑制另一個相對應的合成致死途徑,將可以特異性殺死癌細胞而不危害正常細胞。Olaparib為第一個被FDA核准用於治療BRCA mutation轉移性乳癌的PARP抑制劑,相較一般化療藥物具有較低的疾病進展或死亡風險。做為轉移性乳癌的第一線用藥(過去沒有使用過化學治療),olaparib在整體存活時間上似乎可以得到額外的好處。在安全性而言,主要為腸胃道不適以及貧血,於臨床使用上仍需注意。
BRCA mutation and PARP inhibitor in the treatment of metastatic breast cancer
Pin-Yu Wang1, I-Hsun Tsai1,2, Yu-Shih Lin1
1Department of Pharmacy, Chia-Yi Chang Gung
Memorial Hospital
2Department of Nursing, Chang Gung University of
Science and Technology
Abstract
DNA-damage responses (DDR) act as a gene repair function. When the DDR repair pathway loses its function, it leads to genetic instability and forces the gene to rely heavily on residual DDR pathways. The concept of synthetic lethality is applied to cancer patients, the most well-known of which is the clinical application of BRCA gene mutation and PARP (poly ADP-ribose polymerase) inhibitor (PARP inhibitor). Olaparib is the first PARP inhibitor approved by the US FDA for the treatment of metastatic breast cancer, with a lower risk of disease progression or death than general chemotherapy drugs. Through literature review to understand the role and mechanism of PARP inhibitors in the metastatic breast cancer with BRCA gene mutation.
參考資料:
1. Th. Dobzhansky: Genetics of Natural Populations. Xiii. Recombination and Variability in Populations of Drosophila Pseudoobscura, Genetics 1946; 31(3): 269–290.
2. Balmaña J, Díez O, Rubio, et al: BRCA in breast cancer: ESMO Clinical Practice Guidelines, Ann Oncol 2011;22 Suppl 6:vi31-4.
3. Abugattas J, Llacuachaqui M, Allende YS, et al: Prevalence of BRCA1 and BRCA2 mutations in unselected breast cancer patients from Peru, Clin Genet 2015;88(4):371-5.
4. Winter C, Nilsson MP, Olsson E, et al: Targeted sequencing of BRCA1 and BRCA2 across a large unselected breast cancer cohort suggests that one-third of mutations are somatic, Ann Oncol 2016;27(8):1532-8.
5. Aleskandarany M, Caracappa D, Nolan CC, et al: DNA damage response markers are differentially expressed in BRCA-mutated breast cancers, Breast Cancer Res Treat. 2015;150(1):81-90.
6. Wang YA, Jian JW, Hung CF, et al: Germline breast cancer susceptibility gene mutations and breast cancer outcomes, BMC Cancer. 2018;18(1):315.
7. D'Amours D, Desnoyers S, D'Silva I, et al: Poly(ADP-ribosyl) ation reactions in the regulation of nuclear functions, Biochem J 1999;342 ( Pt 2):249-68.
8. Livraghi L, Garber JE: PARP inhibitors in the management of breast cancer: current data and future prospects, BMC Med 2015;13:188.
9. Liang Z, Xu H, Tian Y, et al: Design, Synthesis and Antifungal Activity of Novel Benzofuran-Triazole Hybrids, Molecules 2016;21(6). pii: E732.
10. Patel AG, De Lorenzo SB, Flatten KS, et al: Failure of Iniparib to Inhibit Poly(ADP-ribose) Polymerase in Vitro, Clin Cancer Res 2012;18(6):1655-62.
11. Pommier Y, O'Connor MJ, de Bono J, et al: Laying a trap to kill cancer cells: PARP inhibitors and their mechanisms of action, Sci Transl Med 2016; 26;8(362):362 ps17..
12. Robson M, Im SA, Senkus E, et al: Olaparib for Metastatic Breast Cancer in Patients with a Germline BRCA Mutation, N Engl J Med 2017; 377:523-533.
13. Robson ME, Tung N, Conte P, et al: OlympiAD final overall survival and tolerability results: Olaparib versus chemotherapy treatment of physician's choice in patients with a germline BRCA mutation and HER2-negative metastatic breast cancer, Ann Oncol. 2019;30(4):558-566.
通訊作者:蔡易訓/通訊地址:嘉義縣朴子市嘉朴路西段6號
服務單位:嘉義長庚紀念醫院藥劑科/聯絡電話:(O) 05-3621000 ext 2479