通報藥物不良品回收案件分析
陳立奇
臺北市立聯合醫院教學研究部
摘要
藥品不良品通報案件,若經評估涉及藥品回收者,通常影響用藥安全之風險性高,均須即時配合回收,食品藥物管理署網站會將之公布於藥品回收專區,避免品質不良藥品再使用於其他民眾。
本研究針對近三年食藥署網站公告回收藥品不良品案件進行回溯分析,研究期間藥品回收專區發布「接獲藥品不良品通報」之回收藥品計28件,其回收分級皆為第二級,回收原因近八成(78.6%)為產品發現雜質、變色、變質,回收不良藥品多為注射劑及口服劑等用於臨床常見或重要疾病治療之處方藥物。回收不良藥品分類包括輸注液/電解質/維他命、胃腸/消化道用藥、眼用藥、皮膚用藥、抗過敏/抗發炎/免疫抑制劑、呼吸道用藥/綜合感冒藥、抗微生物製劑等。
醫療人員及民眾一旦疑有藥品品質不良情形,應即時通報以俾主管機關介入調查處理,並配合下架回收作業,避免不良品再流通於市場造成不慎使用,確保民眾用藥品質及安全。
關鍵字: 藥品不良品通報、藥品回收、defective drug product、 drug recall
壹、前言
為確保上市藥品之品質及民眾使用藥物安全,食品藥物管理署建立上市後藥品品質監測機制,除了主動監控稽查即時偵測藥品品質缺失情形,嚴謹落實藥品生命週期的全面稽核管理外,並建立藥品不良品通報系統,當醫療人員、民眾或藥商發現藥品有品質瑕疵時(如有雜質異物、顏色異常等),能於第一時間進行通報。透過通報機制,可協助主管機關即時掌控市售藥品之品質異常情形,快速啟動相關調查及處置,減少藥品不良品再被不慎使用的機會,確保民眾用藥安全品質。
藥物不良品通報之範圍,舉凡藥事法規定之藥物(包括:藥品、醫療器材)發現品質有瑕疵時,皆可進行通報。近年來藥品不良品通報案件趨增,以食品藥物管理署網站(通報及安全監視專區/統計資料)1公告106年度與107年度藥品不良品年報2-3資料為例,年度接獲藥品不良品通報案件分別為895件及1,003件,其相關之風險評估及後續之因應處理,值得重視。
藥品不良品通報案件,若經評估涉及藥品回收者,通常影響用藥安全之風險性高,均須即時配合回收,食品藥物管理署網站亦會將之公布於藥品回收專區4,監督廠商及提醒醫療院所及用藥民眾進行藥品回收作業,避免品質不良藥品再使用於其他民眾。為進一步瞭解此些藥品不良品回收案件之樣態,茲針對近三年食藥署網站公告回收藥品不良品案件之回收分級、回收原因、藥品類別、劑型及治療分類等進行回溯分析,供臨床用藥安全監視追蹤之參考。
貳、材料與方法
一、資料來源
針對食品藥物管理署網站藥品回收專區發布之藥品回收公告4,篩選其中回收原因註記有「接獲藥品不良品通報」案件者,納入本研究分析資料。
二、篩選資料時間
2016年7月至2019年6月,3年期間。
三、研究方法
(一)針對納入研究分析之通報藥品不良品回收案件資料,記錄其:1.回收分級、2.發文字號及日期、3.發布日期、4.產品中英文名稱、5.許可證字號、6.批號、7.許可證持有者、8.回收原因、9.備註其主成分及適應症。
(二)針對納入研究分析藥品不良品回收案件之回收原因進行歸類:1. 雜質變色變質、2.成分含量檢測不符規格、3.產品包裝/標示問題、4.未符PH值檢驗規格。
(三)針對回收不良品之藥品類別進行歸類:1.處方藥 2.非處方藥。
(四)針對回收不良品之藥品劑型進行歸類:1.口服劑(錠劑/膠囊/顆粒/粉)、2.注射劑、3.眼藥膏、4.口服液劑、5.外用液劑、6.外用藥膏、7.洗腎液。
(五)針對回收不良品之藥品治療用途進行歸類:1.輸注液/電解質/維他命、2.眼用藥、3.胃腸/消化道用藥、4.皮膚用藥、5.抗過敏/抗發炎/免疫抑制劑、6.呼吸道用藥/綜合感冒藥、7.抗微生物製劑、8.中樞神經系統用藥。
四、統計分析
納入研究分析資料,經彙整分類後,採單一變數之敘述性統計,並針對相關變項進行交叉分析。
參、結果
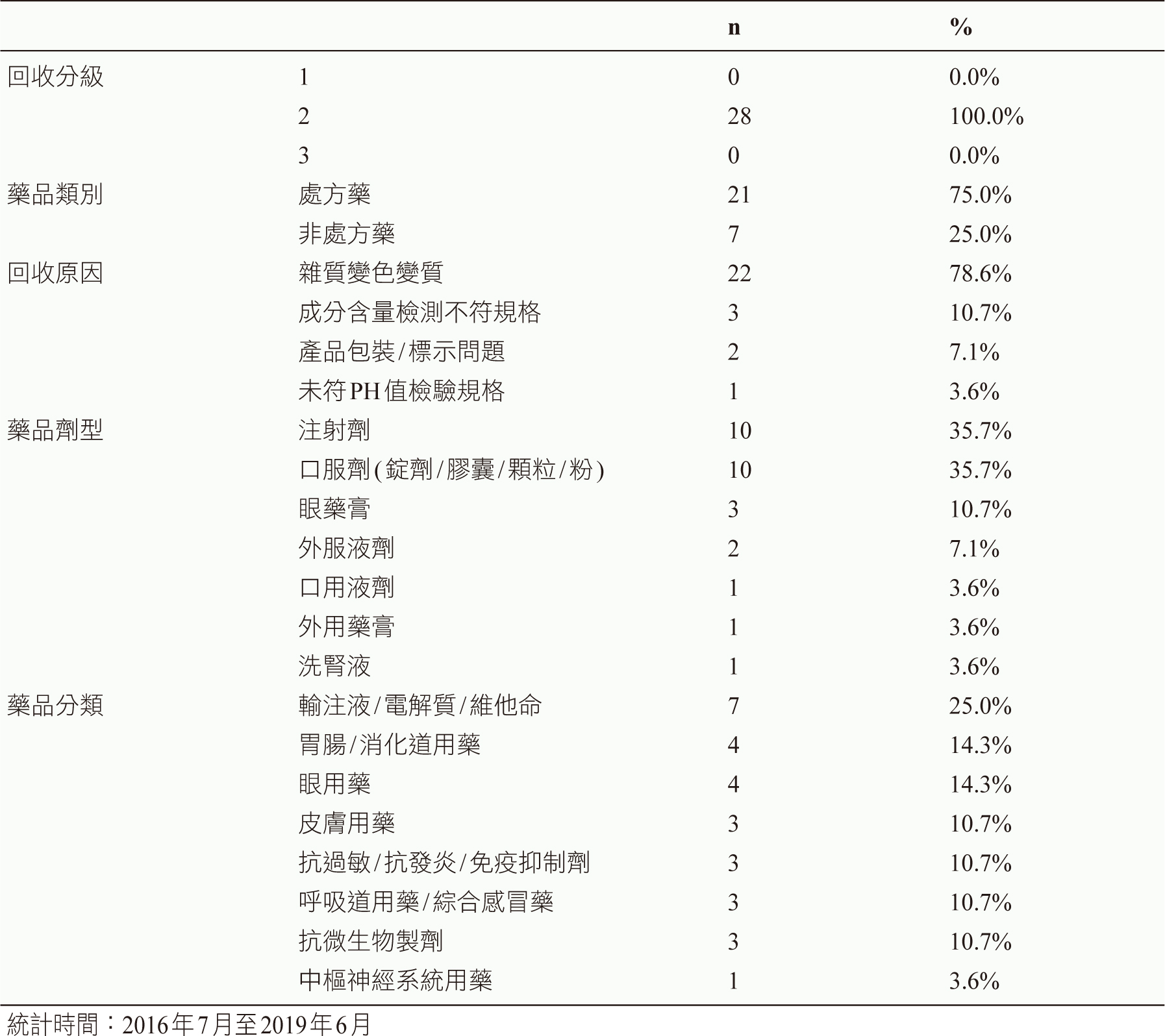
經搜尋2016年7月至2019年6月食品藥物管理署網站藥品回收專區發布之藥品回收公告案件,共計225件,其中篩選回收原因註記有「接獲藥品不良品通報」案件者,計28件,回收分級皆為第二級(100%)。所回收藥品不良品類別處方藥者21件(75.0%),非處方藥7件(25.0%)。藥品不良品之回收原因主要為雜質變色變質22件(78.6%),其次為成分含量檢測不符規格3件(10.7%)、產品包裝/標示問題2件(7.1%)及未符PH值檢驗規格1件(3.6%)(如表一)。
表一 通報藥品不良品之藥品回收案件 (n=28)
所回收藥品不良品劑型主要為注射劑10件(35.7%)及口服劑(錠劑/膠囊/顆粒/粉) 10件(35.7%),其次為眼藥膏3件(10.7%)、外用液劑2件(7.1%)、口服液劑1件(3.6%)、外用藥膏1件(3.6%)、洗腎液1件(3.6%)。藥品分類以輸注液/電解質/維他命7件(25.0%)最多:其次為胃腸/消化道用藥4件(14.3%)、眼用藥4件(14.3%)、皮膚用藥3件(10.7%)、抗過敏/抗發炎/免疫抑制劑3件(10.7%)、呼吸道用藥/綜合感冒藥3件(10.7%)、抗微生物製劑3件(10.7%)、中樞神經系統用藥1件(3.6%) (表一)。
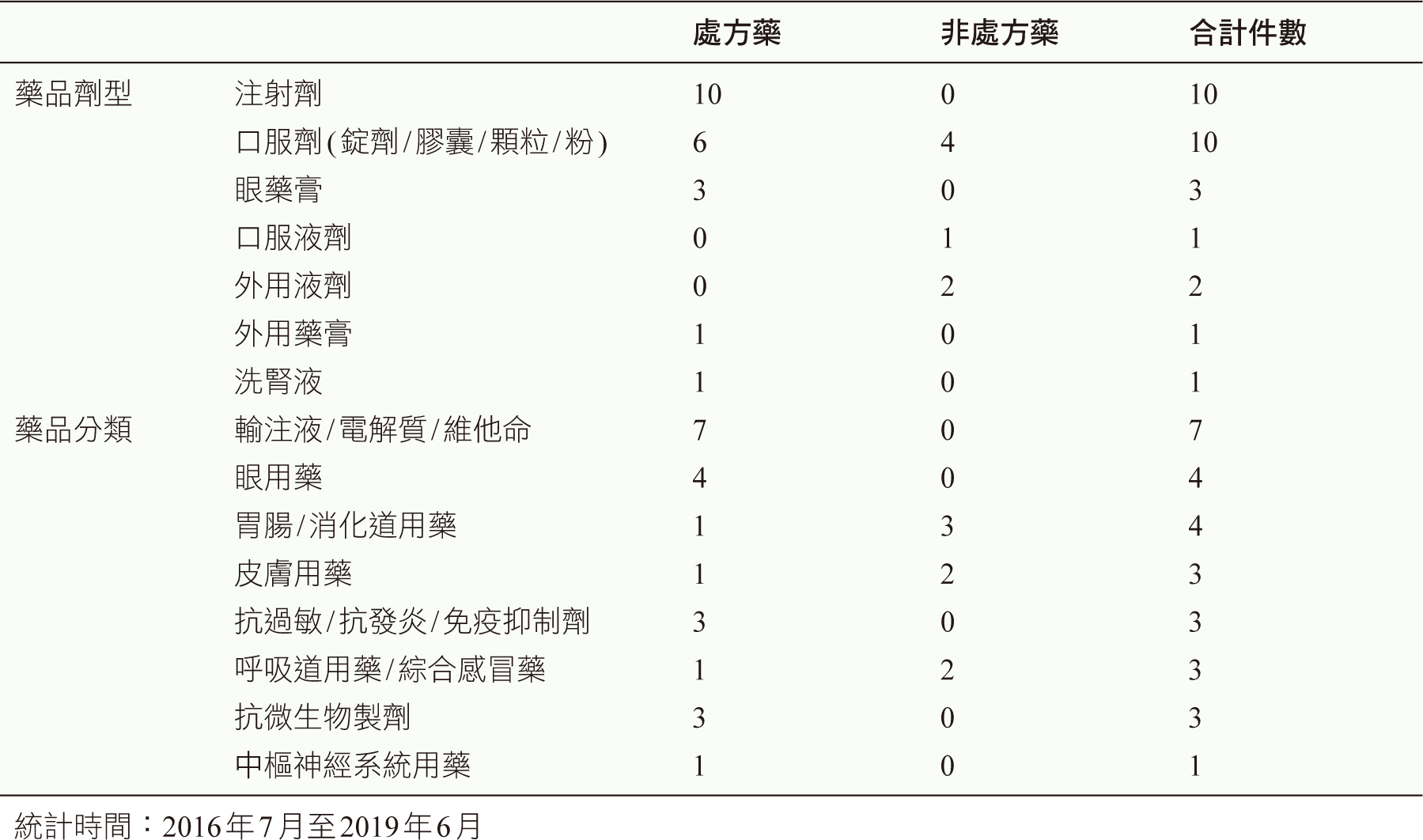
以回收藥物不良品類別進一步分析,所回收藥物不良品3/4為處方藥(21件),劑型包括注射劑(10件)、口服劑(6件)、眼藥膏(3件)、外用藥膏與洗腎液各1件;藥品分類包括輸注液/電解質/維他命(7件)、眼用藥(4件)、抗過敏/抗發炎/免疫抑制劑(3件)、抗微生物製劑(3件)、及胃腸/消化道、皮膚、呼吸道/綜合感冒藥、中樞神經系統用藥各1件。非處方藥(7件)之劑型為口服劑(4件)、外用液劑(2件)及口服液劑(1件);藥品分類為胃腸/消化道用藥(3件)、皮膚用藥(2件)、呼吸道用藥/綜合感冒藥(2件) (表二)。
表二 分析回收藥物不良品之劑型與藥理分類 (n=28)
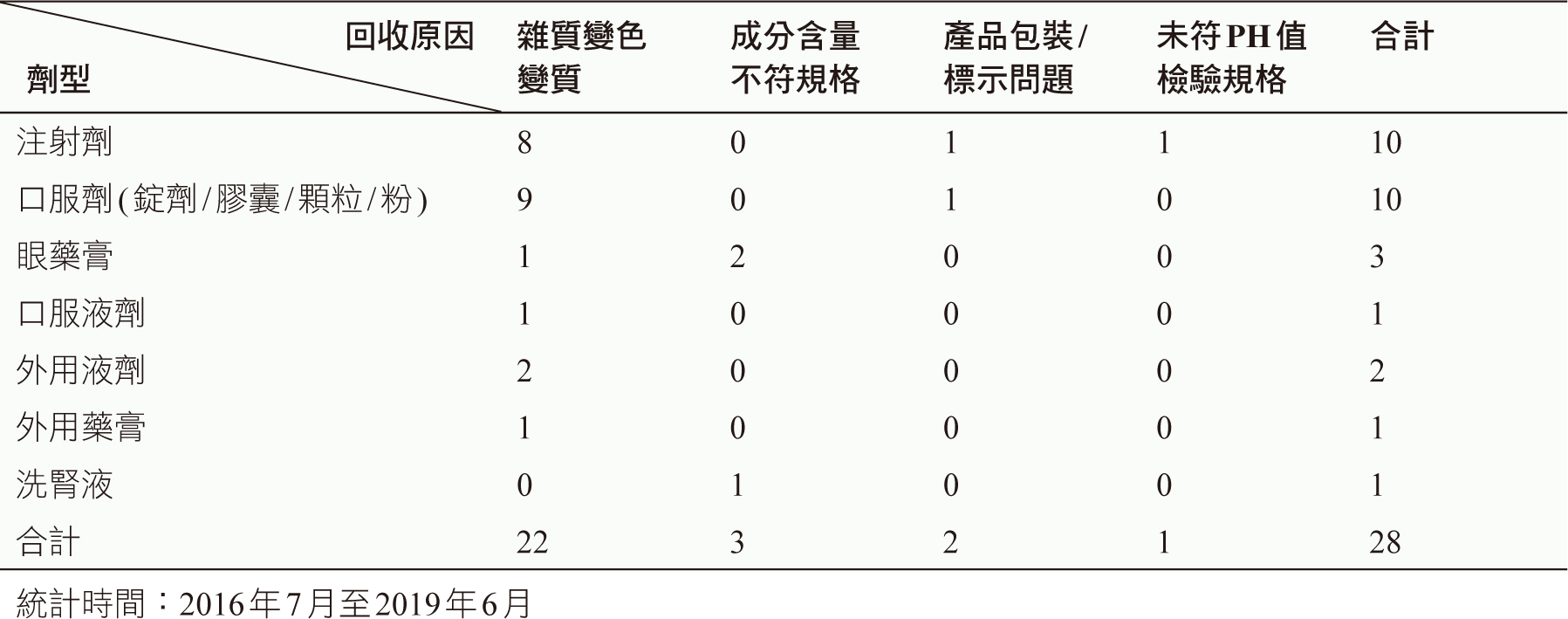
以藥品不良品之回收原因進一步分析,近八成(78.6%)為產品發現有雜質變色變質問題(22件),其劑型為口服劑(9件)、注射劑(8件)、外用液劑(2件)及眼藥膏、口服液劑、外用藥膏各1件(表三)。藥品分類為輸注液/電解質/維他命(5件)、胃腸/消化道用藥(3件)、皮膚用藥(3件)、抗過敏/抗發炎/免疫抑制劑(3件)、呼吸道用藥/綜合感冒藥(3件)、眼用藥(2件)、抗微生物製劑(2件)及中樞神經系統用藥(1件)。(表四)。
表三 藥物不良品回收原因與藥品劑型之分析 (n=28)
表四 藥物不良品回收原因與藥品分類之分析 (n=28)
肆、討論
國內現行針對上市後藥品品質監測機制包括「主動監控」及「被動監視」二個機制5。其中「主動監控」係政府端(中央及地方主管機關)主動進行藥品品質監控及稽查。「被動監視」則是建立藥品不良品通報系統,供醫療院所、藥局及民眾使用端發現疑似藥品不良品時進行通報5。本院除配合主管機關之品質監測機制以外,另已整合建立院內藥品異常事件(不良品、不良反應及給藥疏失)之通報及即時處理線上系統,方便醫護同仁之通報評估及後續之追蹤管理。
藥品不良品之通報,可即時反應藥物不良品於市場流通使用的情形,協助主管機關第一時間掌握動向及介入調查處理。藥品回收作業亦為避免民眾誤用藥物不良品之重要機制,依現行104年8月5日公告「藥物回收處理辦法」6,藥物回收作業依回收藥物對人體健康之風險程度,分為第一、二、三級處理。其中第一級回收之危害風險最高,如偽藥、禁藥或確有損害使用者生命、身體或健康事實之藥物等,第二級回收如劣藥、不良醫療器材等,第三級回收如許可證未展延或包裝、標籤、仿單核准變更登記等。
本研究分析2016年7月至2019年6月食品藥物管理署網站藥品回收專區發布「接獲藥品不良品通報」之回收藥品計28件,其回收分級皆為第二級,無第一級及第三級之回收。回收原因近八成(78.6%)為產品發現雜質變色變質,主要為口服藥品發現有顏色異常、異物混入、受潮及結塊等情形及注射劑有異物混入、顏色異常、懸浮沈澱物等狀況,類似藥品外觀異常問題較容易為醫療人員及民眾觀察發現,此結果與本院同期通報不良品39件中雜質變色外觀異常24件(佔61.5%)及過往文獻報告藥品不良品外觀異常佔53.3%7相當。餘回收原因為廠商自行檢驗成分含量不符規格或發現包裝不良打印錯誤等,主動啟動回收作業。
回收藥品不良品類別多為醫師處方藥(75.0%),其中劑型主要如注射劑,包含抗生物製劑、輸注液、電解質補充液等,多為雜質變色變質問題,此類注射藥品若有雜質異物或變質,影響病人治療療效及用藥安全甚鉅,須特別謹慎留意。口服處方藥如抗過敏/抗發炎劑等亦都為外觀顏色異常問題。眼藥膏3件皆為抗微生物眼藥膏製劑,除1件為外觀顏色異常外,餘2件為廠商自行檢驗後發現藥品主成分含量不符合原核准規格,評估後主動啟動回收。非處方藥全部為指示用藥(無成藥),其回收不良品案件佔率僅1/4,是否可能為民眾自行使用未發覺或未通報,值得注意,將加強宣導衛教民眾藥品不良品通報之觀念。
所回收藥品不良品劑型主要如注射劑及口服劑(錠劑/膠囊/顆粒/粉)各10件,加上口服液劑1件,合計21件(75%)為全身性作用藥品,其不良品質所可能影響為全身性之療效及安全性,均需審慎評估其原因及影響程度,妥適因應處理。另就回收不良藥品分類來看,舉凡輸注液/電解質/維他命、胃腸/消化道用藥、眼用藥、皮膚用藥、抗過敏/抗發炎/免疫抑制劑、呼吸用藥/綜合感冒藥以及抗微生物製劑等,均為臨床常見或重要疾病之治療用藥,使用病人眾多,影響層面廣,在確認不良品質問題後,須盡速啟動回收作業,避免民眾使用到品質不良藥品危害健康。
伍、結語
不良品所造成的傷害風險大部分是可以被預防的。目前上市後藥品之品質監控機制,除了中央及地方主管機關定期及不定期之主動抽驗及稽查外,供應端(廠商)及使用端(醫療人員及民眾)之不良品通報,亦是相當重要的一環。醫療人員及民眾在使用藥物時宜隨時注意,一旦疑有不良品質情形,應即時通報以俾主管機關介入調查處理(食藥署藥品不良品通報網址:https://www.fda.gov.tw/TC/siteContent.aspx?sid=4241),倘經確認不良品質問題啟動回收作業後,須即時配合下架回收作業,避免不良品再流通於市場造成不慎使用,確保民眾用藥品質及安全。
Analysis of drug recalls through defective product report
Lih-Chi Chen
Department of Education and Research, Taipei City Hospital
Abstract
In cases where drug defect notifications are reported, the drug recall will be conducted if the drug safety risk is high. The website of the Food and Drug Administration will announce it in the drug recall web page to prevent the use of poor quality drugs.
This study conducted a retrospective analysis of drug recall cases through defective product reports announced on the FDA website in the past three years. There were 28 defective drug recall cases during the study period. All the recall grade were second-level. Nearly 80% (78.6%) of the recall reasons were discoloration and deterioration of the products. Most of the recall defective drugs were injections and oral agents, which are used in the treatment of common or important diseases. Classification of recall drugs includes infusion solutions/electrolytes/vitamins, gastrointestinal/digestive tract medications, ophthalmic medications, dermatological medications, anti-allergy/anti-inflammatory/immunosuppressive agents, respiratory medications/common cold medicines, antimicrobial agents, etc.
Medical personnel and the publics should immediately report if poor quality drugs were suspected, and cooperate with the recall process to avoid the inadvertent use of defective products in the market to ensure the quality and safety of the drug therapy.
參考資料:
1. 食品藥物管理署: 官網首頁>業務專區>通報及安全監視專區>統計資料>藥品。 [檢索日期2019年10月1日];檢索自:Available from: https://www.fda.gov.tw/TC/siteList.aspx?sid=4229 。
2. 衛生福利部食品藥物管理署:106年度藥品不良品年報 (107年3月13日發布)。台北:食品藥物管理署,2018。
3. 衛生福利部食品藥物管理署:107年度藥品不良品年報 (108年4月1日發布)。台北:食品藥物管理署,2019。
4. 食品藥物管理署: 官網首頁>整合查詢服務>西藥GMP>產品回收。 [檢索日期2019年10月1日];檢索自:Available from: https://consumer.fda.gov.tw/GMP/ProductDetail.aspx?nodeID=420&id=1413 。
5. 楊博文、陳可欣、戴雪詠等:藥品品質監視回收之現況與展望。食品藥物研究年報 2014; 5: 380-6。
6. 衛生福利部:衛生福利部104年8月5日令頒「藥物回收處理辦法」。台北:衛生福利部,2015。
7. 賴威廷、鄭淑文:某精神科醫院藥物不良品通報分析。藥學雜誌 2014; 30: 132-6。
通訊作者:陳立奇/通訊地址:台北市大安區仁愛路4段10號8樓教研部
服務單位:台北市立聯合醫院教學研究部/聯絡電話:(O) 02-27093600 ext 3824