胃癌的分子生物學暨胃癌精準醫療
鄭吉元1、蔡慈貞1,2、張文震3
1林口長庚紀念醫院藥劑部、2新生醫護管理專科學校、3林口長庚紀念醫院腫瘤科
摘要
近年來,根據胃癌的分子生物學特徵,The Cancer Genome Atlas (TCGA) 和Asian Cancer Research Group (ACRG) 兩個組織分別將胃癌分成4個亞型,如此也為胃癌之精準醫療開了道路。本文將說明這兩個分類的內容,以及根據不同的亞型和異常基因相對應的精準醫療。整體來看,TCGA和ACRG分類的臨床應用至今仍有限。Trastuzumab和ramucirumab是目前唯一兩個被核准可用於治療胃癌的標靶藥物。MSI和EBV亞型的胃癌病人,適合使用免疫檢查點抑制劑來治療。對於預後最差的GS或MSS/EMT亞型的胃癌病人,針對CLDN18.2的標靶藥物claudiximab是相當具有潛力的。另外,針對PI3K/Akt/mTOR訊息傳導路徑的標靶藥物也值得期待。
關鍵字: 胃癌、精準醫療、gastric cancer、precision medicine、TCGA、ACRG
壹、現階段胃癌的藥物治療策略
對於無法手術切除之局部晚期、復發或轉移性胃癌的治療是以藥物治療為主。現階段有關胃癌的藥物治療策略如下:
第一線選擇兩個化療藥物的組合:5-fluorouracil或capecitabine併用cisplatin或oxaliplatin,對於HER2過度表現者要再加上對抗HER2的藥物trastuzumab1。
第二線可選擇血管內皮細胞生長因子受體2 (vascular endothelial growth factor receptor 2,VEGFR2) 抑制劑ramucirumab單用或併用化療藥paclitaxel,或是選擇單用化療藥paclitaxel、docetaxel或irinotecan,對於「DNA錯誤配對修復機制有缺陷 (mismatch repair deficiency, dMMR)」或稱為「微衛星不穩定(microsatellite instability,MSI)」者可第二線給予免疫檢查點抑制劑 (immune checkpoint inhibitor,ICI) pembrolizumab1。
第三線可選擇單用化療藥Lonsurf® (trifluridine / tipiracil,TAS-102®) 或免疫檢查點抑制劑pembrolizumab1。臺灣食品藥物管理署 (Taiwan Food and Drug Administration,TFDA) 亦核准另一個免疫檢查點抑制劑nivolumab單獨使用於先前經兩種或兩種以上化療藥物治療無效的晚期或復發性胃癌病人2。
貳、精準醫療
精準醫療 (precision medicine) 一詞源自1990年代人類基因體計畫 (Human Genome Project) 所進行之個人化醫療 (personalized medicine) 的延伸3。「精準醫療」的定義為:利用個人基因型或是基因表現及臨床資料資訊,選擇最適合個人使用之藥物、治療方法或預防方式,以期達到藥品最大療效與最小的副作用。在2005年首次出版的精準醫療期刊 (Journal of Precision Medicine) 中,將精準醫療涵蓋4P:預測性 (Predictive)、預防性 (Preventative)、藥物治療性(Pharmacotherapeutic) ─包括藥物基因學 (pharmacogenetics) 和藥物基因體學(pharmacogenomics)、病人參與性 (Participatory patient),所以「精準醫療」又暱稱為「P醫學」4。2015年初,美國總統歐巴馬提出「精準醫療計畫」(Precision Medicine Initiative),將收集100萬人的基因資料,建立完整的基因資料庫,以標準化步驟實行精準醫療,短期目標是協助癌症病人找到更佳的治療方法,長期目標則是為多種疾病的個人化治療提供有價值的訊息3。
參、胃癌的分子生物學分類
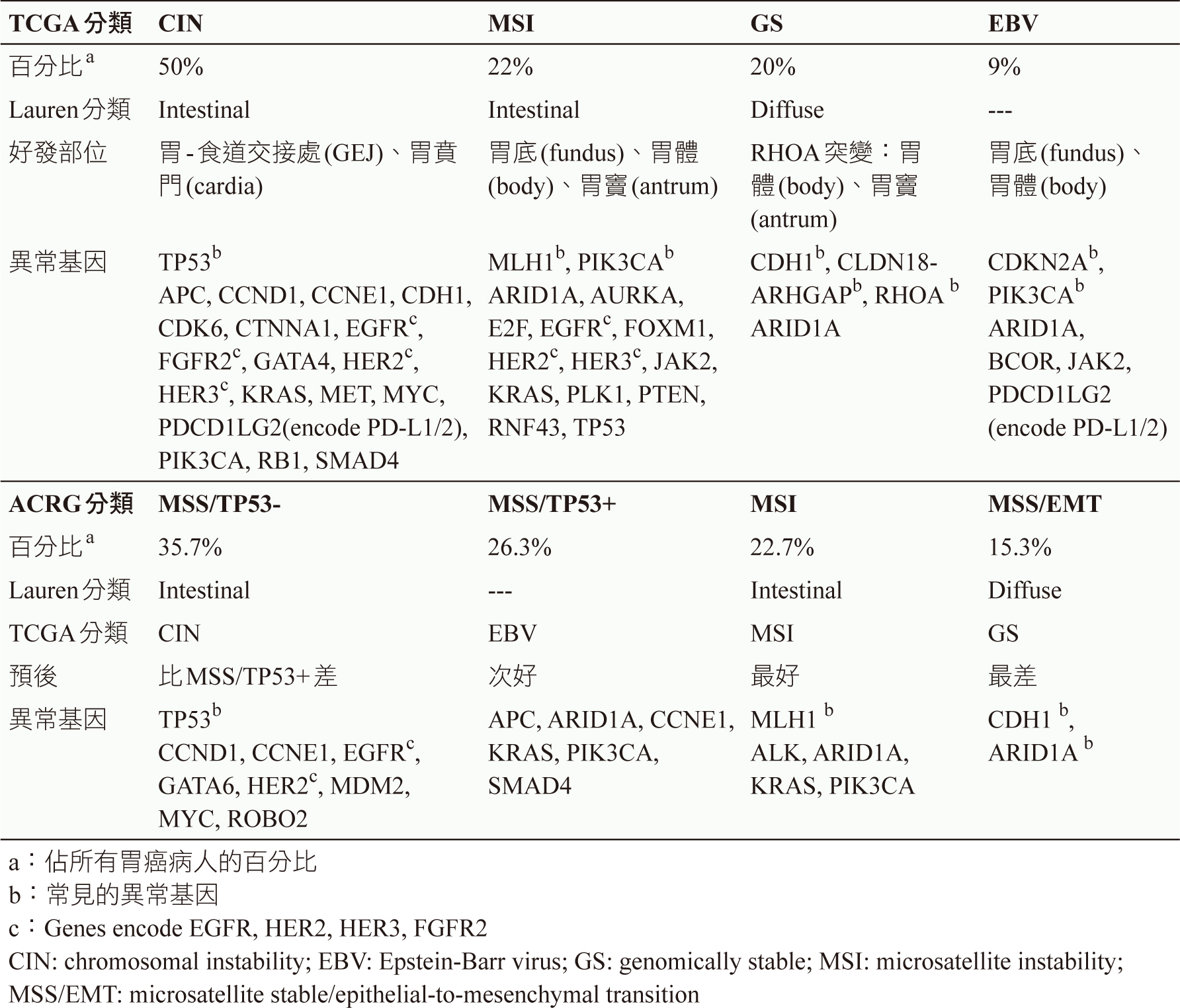
胃癌之精準醫療和胃癌的分子生物學息息相關。根據胃癌的分子生物學特徵,The Cancer Genome Atlas (TCGA) 和Asian Cancer Research Group (ACRG) 兩個組織分別將胃癌分成4個亞型5,6,見表一。基因縮寫的全名見文末。
表一 胃癌的分子生物學分類5-8
一、TCGA分類
依據TCGA將胃癌分成4個亞型:chromosomal instability (CIN)、microsatellite instability (MSI)、genomically stable (GS)、Epstein-Barr virus (EBV)。
CIN佔所有胃癌病人的50%,最主要的異常基因是腫瘤抑制基因TP53突變,其等位基因頻率 (allele frequency) 為71%7,8。TP53突變使得原本抑制腫瘤生長的功能喪失。此外,CIN胃癌之復發患者,發現屬於酪胺酸激酶接受器 (tyrosine kinase receptor) 之EGFR、HER2、HER3、FGFR2和MET常會過度表現7,其中HER2等位基因頻率為24%9。
MSI亞型常見於老年婦女,主要的異常基因是DNA修補基因MLH1過度甲基化 (hypermethylation)7,8。此外,PIK3CA也會出現42%的高突變率,PIK3CA突變會活化PI3K-Akt-mTOR訊息傳導路徑8,9。MSI患者之腫瘤細胞中突變的數量多,也就是說,具有高腫瘤突變負荷(high tumor mutational burden,high TMB),這群病人給予免疫檢查點抑制劑治療效果佳,存活期也長10。
GS胃癌病人常在年輕時就被診斷,其預後最差7。最主要的異常基因是CDH1、CLDN18-ARHGAP及RHOA7。其中cadherin 1 (CDH1) 和細胞黏附 (cell adhesion) 有關(註:cadherin (鈣黏蛋白) 的全名是calcium-dependent adhesion),當CDH1突變會導致細胞之間無法連接10。就存活期而言,出現CDH1突變是一個不好的預後因子10。CLDN18和ARHGAP基因融合 (fusion) 只有在TCGA分類中的GS亞型中被發現,帶有此融合基因的胃癌病人易發生遠端轉移9,10。因為經CLDN18轉譯 (translation) 的蛋白質claudin 18是緊密連接 (tight junction) 的主成分 (註:緊密連接是能將兩個細胞緊密連接的結構),所以此異常的融合基因會引起上皮細胞完整性受損以及影響傷口的癒合7,9,10。RHOA突變也是只出現在GS亞型,RHOA和細胞凋亡相關,一旦突變會導致細胞凋亡受阻7,10。由TCGA的資料也發現RHOA、CDH1突變與CLDN18-ARHGAP基因融合兩者互斥,也就是說,若出現RHOA、CDH1突變則不會發生CLDN18-ARHGAP基因融合,反之亦然9。此外,GS亞型還會呈現較多的血管新生 (angiogenesis)7,8。
EBV相關的胃癌是指腫瘤細胞內有EB病毒DNA存在。 EBV亞型常見於男性,主要的異常基因是CDKN2A過度甲基化7,8。此外,EBV亞型也會出現PIK3CA、ARID1A突變,其等位基因頻率分別為80%、55% 7,8。ARID1A與染色質重塑 (chromatin remodeling) 有關,染色質重塑是一種超越基因的機制,乃是利用修飾染色質方式來控制基因的活性10。一個有趣的發現是ARID1A突變和TP53突變,兩者互呈負相關,ARID1A突變常見於EBV和MSI亞型;然而,TP53突變就很少出現在以上這兩個亞型10。此外,由於EBV相關的胃癌會有PD-L1/2高表現,所以這群病人適合使用ICI藥物 (例如:pembrolizumab) 來治療7。
二、ACRG分類
ACRG的研究對象是針對亞洲族群,依據ACRG將胃癌分成4個亞型:MSS/TP53-、MSS/TP53+、MSI、microsatellite stable/epithelial-to-mesenchymal transition (MSS/EMT)。ACRG相對應的TCGA分類,見表一。其中預後最好的是MSI,依次是TP53未突變仍保有抑制腫瘤生長的MSS/TP53+、MSS/TP53-、MSS/EMT8。
肆、胃癌之精準醫療
截至目前,TCGA和ACRG分類並未實際應用在臨床上,理由是我們並不清楚哪些異常基因真正具有功能表現,以及很多異常基因也無相對應的標靶藥物。雖然,現階段美國和臺灣FDA只有核准兩個標靶藥物trastuzumab和ramucirumab用於治療晚期胃癌10,但是針對胃癌的分子標記已有不少的藥物正在進行臨床試驗,今敘述如下:
針對屬於酪胺酸激酶接受器之EGFR、HER2、HER3、FGFR2和MET過度表現的標靶藥物,其試驗結果很多都看不到療效9,10,其中只有對抗HER2的單株抗體trastuzumab被核准併用化療用於治療HER2過度表現的轉移性胃癌之第一線用藥7。至於對抗HER2的其他藥物lapatinib或T-DM1®(trastuzumab emtansine) 則皆無法明顯延長存活期,pertuzumab併用trastuzumab的療效也和單用trastuzumab相當11。
針對PI3K-Akt-mTOR訊息傳導路徑過度活化的標靶藥物,其中mTOR抑制劑everolimus單用或併用化療用於晚期胃癌患者的研究已證實失敗7。目前,PIK3CA抑制劑alpelisib以及Akt抑制劑ipatasertib用於治療晚期胃癌的試驗仍正在進行中7。
針對TP53突變的TP53抑制劑 (例如HDM201) 以及針對BRCA1/2突變的poly(ADP–ribose) polymerase (PARP) 抑制劑 (例如olaparib) 用於治療晚期胃癌的多個第I/II/III期試驗,目前皆正在進行中7。
由於MSI的TMB值高以及EBV的PD-L1/2高表現,因此這兩個亞型的胃癌病人,適合使用ICI藥物來治療7,10。
值得注意的是,針對CLDN18.2的標靶藥物claudiximab (IMAB362)。第II期FAST研究顯示,claudiximab併用第一線化療治療晚期胃癌病人,其存活期在CLDN18.2高表現者 (≥70%) 明顯延長 (HR 0.44)9。目前,正在進行的第III期SPOTLIGHT臨床試驗,乃是claudiximab併用化療mFOLFOX6 (oxaliplatin / 5-fluorouracil / leucovorin) 第一線治療CLDN18.2 ≥75%的晚期胃癌患者,這群患者佔晚期胃癌病人的36%9。
此外,目前有一個針對DNA過度甲基化的臨床試驗正在進行,乃是使用組織蛋白去乙醯酶 (histone deacetylase) 抑制劑vorinostat併用化療capecitabine和cisplatin第一線治療轉移性或復發的胃癌病人12。
伍、結論
隨著人類基因的解碼,醫學已進入精準醫療時代。雖然根據胃癌的分子生物學特徵,TCGA和ACRG兩個組織已分別對胃癌進行分類,但是其臨床應用至今仍有限。Trastuzumab和ramucirumab是目前唯一兩個被核准可用於治療胃癌的標靶藥物。MSI和 EBV亞型的胃癌病人,適合使用ICI藥物來治療。對於預後最差的GS或MSS/EMT亞型的胃癌病人,針對CLDN18.2的標靶藥物claudiximab是相當具有潛力的。另外,針對PI3K/Akt/mTOR訊息傳導路徑的標靶藥物也值得期待。未來希望藉由對胃癌基因表現有更多的瞭解、更多嶄新的標靶藥物研發以及依據不同的胃癌基因型進行更多的個別臨床試驗,使得胃癌之精準醫療可以更上一層樓。
基因縮寫的全名
Molecular Biology and Precision Medicine in Gastric Cancer
Chi-Yuan Cheng1, Tzu-Cheng Tsai1,2, Wen-Cheng
Chang3
1Department of Pharmacy, Chang Gung Memorial
Hospital, Linkou
2Department of Long Term Care, Hsin Sheng Junior
College of Medical Care and Management
3Department of Oncology, Chang Gung Memorial
Hospital, Linkou
Abstract
In recent years, new classifications of TCGA (The Cancer Genome Atlas) and ACRG (Asian Cancer Research Group) which divided gastric cancer into four subtypes based on its molecular characteristics were introduced, and it paved the way for precision medicine of gastric cancer. This article will describe these two molecular classifications, and precision medicine corresponding to different subtypes and genomic alterations. In general, the clinical application of TCGA and ACRG was still limited so far. To date, trastuzumab and ramucirumab were the only two targeted therapy approved for the treatment of gastric cancer. MSI and EBV subtypes of gastric cancer patients were suitable for the treatment with immune checkpoint inhibitors. For the worst prognosis among GS or MSS/EMT gastric cancer patients, claudiximab targeting CLDN18.2 had considerable potential. Besides, targeted therapy aimed to PI3K/Akt/mTOR signal pathway was also worth looking forward to.
參考資料:
1. NCCN Guideline: Gastric cancer (Version 4.
2019) Available from:
https://www.nccn.org/professionals/physician_gls/pdf/gastric.pdf
Accessed Jan 17, 2020
2. Nivolumab中文仿單 Available from:
https://info.fda.gov.tw/MLMS/ShowFile.aspx?LicId=60001013&Seq=017&Type=9
Accessed Jan 17, 2020
3. 臺灣醫學會,閻雲,個人化醫療:基因學於臨床應用之整合。Available from: http://www.fma.org.tw/2015/bio-1.html Accessed Jan 10, 2020.
4. 臺灣精準醫學學會,王子豪:精準醫學的範疇。Available from: http://www.tpms.org.tw/2017/02/02/%E7%B2%BE%E6%BA%96%E9%86%AB%E5%AD%B8%E7%9A%84%E7%AF%84%E7%96%87/ Accessed Jan 10, 2020.
5. Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature 2014;513:202-9.
6. Cristescu R, Lee J, Nebozhyn M, et al: Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes. Nat Med 2015;21:449-56.
7. Bonelli P, Borrelli A, Tuccillo FM, et al: Precision medicine in gastric cancer. World J Gastrointest Oncol 2019;11:804-29.
8. Jeon J, Cheong JH: Clinical implementation of precision medicine in gastric cancer. J Gastric Cancer. 2019;19:235-53.
9. Ishii T, Kawazoe A, Shitara K: Dawn of precision medicine on gastric cancer. Int J Clin Oncol 2019;24:779–88.
10. Liu X, Meltzer SJ: Gastric cancer in the era of precision medicine. Cell Mol Gastroenterol Hepatol 2017;3:348–58.
11. Gambardella1 V, Fleitas1 T, Tarazona N, et al: Towards precision oncology for HER2 blockade in gastroesophageal adenocarcinoma. Ann Oncol 2019;30:1254–64.
12. Available from:
https://clinicaltrials.gov/ct2/show/NCT01045538
Accessed Jan 17, 2020
通訊作者:鄭吉元/通訊地址:桃園市龜山區復興街五號林口長庚醫院病理大樓6樓化療藥局
服務單位:林口長庚紀念醫院藥劑部/聯絡電話:(O) 0975367860