淺談再生醫療製劑
陳秋蘭1、劉宗榮2
1嘉南藥理大學藥學系、2社團法人台灣生醫品質保證協會
摘要
再生醫療製劑泛指細胞、基因或組織工程產品用於重建、修復因疾病或自然衰老受損的人體構造或功能,以達到治療或預防人類疾病的目的。近年來,國際上陸續有再生醫療製劑上市,用於治療醫療需求未獲滿足之疾病,效果顯著,為各種難治之疾病帶來希望。目前各國在再生醫療管理之法規架構,歐美採風險程度分級管理之原則,風險程度較高者,須依藥物相關法規管理。日本及台灣則採醫療技術與產品雙軌管理,以提供再生醫療產業發展的不同選擇。我國目前雖然已有70件細胞治療技術施行計畫獲准可執行,然而目前國內尚無自行研發上市之再生醫療製劑,期待政府可建構更完善之法規環境,促進國內再生醫療產業之全面發展。
關鍵字:再生醫療製劑、細胞治療、人體組織優良操作規範、regenerative medicinal products、cell therapy、Good Tissue Practice (GTP)
壹、前言
再生醫療製劑(regenerative medicinal products)泛指細胞、基因或組織工程產品,用於重建、修復因疾病或自然衰老受損的人體構造或功能,以達到治療或預防人類疾病的目的。包含經由植入活細胞以促進生長、取代或修復受損組織來達到疾病治療目的之細胞治療;經由取代突變基因或引入可正常表現之基因序列,以治療或預防特定基因突變造成之疾病的基因治療;以及藉由生物材料、細胞及/或生物活性分子之複合產物達到回復、維持、改善或取代受損組織及器官治療目的之組織工程產品。部分再生醫療製劑涉及人體細胞組織物之處理,與醫療技術範疇重疊,但其製造過程必須經過數日至數週之體外培養,或是複雜的處理程序,唯有在優良的生產品質管理系統下,經由嚴謹管控之製程,方可保證最終產品之有效性與安全性。
例如由諾華藥廠研發的Kymriah (tisagenlecleucel),其於2017年時取得美國食品藥物管理署(FDA)上市許可,用於治療孩童或年輕人抗藥性/復發型前驅B細胞之急性淋巴性白血病(refractory/relapse B-cell precursors acute lymphoblastic leukemia, r/r B-cell ALL)。Kymriah之製藥工藝與小分子化學藥品有極大不同,是將病人T細胞取出體外後,利用基因工程將其改造成具有「嵌合抗原受體」(chimeric antigen receptor, CAR)的T細胞,並在體外增殖後,再輸注回病人體內。這使CAR-T細胞就如同裝了導航系統般,在病人體內利用嵌合的抗原受體,可專一性辨認癌細胞上的特殊抗原,並與其結合後活化T細胞,進而將癌細胞殺死1-2。隨著科技發展,再生醫療製劑陸續在世界各國上市,用於治療各種醫療需求未獲滿足之疾病,也為其他難治疾病帶來希望。然而細胞組織物具生命活性,這與傳統小分子或蛋白藥物有極為不同的特性,難以一體適用於現今藥物管理法規,故世界各國多依其特性協調修訂更適用之法規,以利再生醫療之發展。
貳、各國對再生醫療管理之模式
世界各國對再生醫療管理,歐美係依據其製造過程之複雜程度做風險分級,若是製造過程複雜,不符合最小操作、同源使用及不會產生全身性作用等條件,一般被視為風險程度高,以藥物法規或其他特別法規管理。此外,如涉及人體細胞組織物之處理,為避免因使用相關產品造成傳染性疾病之導入、擴散或傳播,還須遵循人體細胞組織物之管理法規。日本及台灣則採醫療技術與製劑雙軌管理,醫療技術部分由醫療機構提出相關施行計畫,由中央主管機關審核管理,而欲申請查驗登記上市許可之製劑,則以藥物法規或其他特別法規管理(表一)。
表一 美、歐、日等國及台灣之再生醫療管理模式
一、美國
在美國,公共衛生服務法案(Public Health Service Act, PHS Act)將用於植入、移植、輸注或轉植於人體之人體細胞、組織、或以人體細胞或組織所構成之產品(human cell, tissue, or cellular or tissue-based products, HCT/Ps)分為風險程度較低之PHS 361類,這類產品須符合最小操作、同源使用及不具系統性作用等要件,不符合此三要件之HCT/Ps則列為風險程度較高之PHS 351類。PHS 361類的HCT/Ps如皮膚、角膜等,須依循聯邦法規第21篇之1271部(Code of Federal Regulations Title 21, Part 1271),進行機構登錄與產品列冊,且操作須符合人體組織優良操作規範(Good Tissue Practice, GTP),並依捐贈者合適性篩選細胞組織物之提供者。PHS 351類的HCT/Ps產品,則須符合美國食品藥物與化粧品法(the Federal Food, Drug, and Cosmetic Act),並依產品之功能屬性以生物藥品或醫療器材相關法規管理。除了須符合GTP外,還要對細胞組織物之提供者進行捐贈者合適性篩選,在製造過程還須符合GMP之要求3。
二、歐盟
歐盟將此類產品稱為新興生醫產品(Advanced Therapy Medicinal Products, ATMPs),並依照人用藥品進行管理。為促進ATMP發展,歐盟執委會2007年制定第1394法規(Regulation (EC) No 1394/2007),將ATMPs分為基因治療、細胞治療、組織工程類別產品,ATMPs醫藥產品之上市申請由歐盟集中管理,在歐洲藥品管理局(European Medicines Agency, EMA)下設先進療法委員會(Committee for Advanced Therapies),負責ATMPs的監管和諮詢,審查意見則交由人用藥品委員會(Committee for Medicinal Products for Human Use)作出最後建議,由EMA批准上市。
同時,對僅在一個國家中使用的產品,Regulation (EC) No 1394/2007亦提出了醫院豁免條款(Article 28),允許歐洲醫院在經過基礎研究、臨床研究驗證有效性與安全性之後,可以生產小規模的細胞產品,限定於在醫療機構中進行的個體細胞治療,且要有醫師負相關責任,同時也要遵循其國家對醫藥產品之品質、可追溯性及安全通報等要求。而醫院豁免權須由歐盟各國家修訂至本國的相關醫療法規後方得以執行4。
三、日本
日本為推動再生醫療,國會於2013年通過再生醫療推進法(Regenerative Medicine Promotion Act),並制訂再生醫療安全確保法(Act on the Safety of Regenerative Medicine),修訂醫藥品、醫療器材和其他治療產品法(The Pharmaceuticals, Medical Devices, and Other Therapeutic Products Act,簡稱藥機法),於隔年開始實施,確立雙軌制管理架構。
再生醫療安全確保法規範過去未納管之自由診療與臨床研究,依風險程度將施行計畫分為三級,必須向日本厚生勞動省申報,並經由對應級別之再生醫療認定委員會審查,對特定細胞培養暨加工設施,也制訂必須達成之專門條文,目的是確保由醫療機構自行執行之再生醫療的安全性。藥機法則是新設「再生醫療產品」類別,針對其應用與商品化管理,並新增「早期承認制度」,在再生醫療產品早期臨床試驗完成,可確認安全性並有初步療效資料時,厚生勞動省有權可以給予有條件准許上市。廠商在上市後一定期間內,完成所要求案例數之上市後有效性臨床研究,以證明療效取得最後之上市許可5。
日本經由此再生醫療三法,快速打開再生醫療市場,2015年至今已有九個再生醫療製劑獲得上市許可,其中有三個是經由早期承認制度取得有條件許可。然而國際間,對日本再生醫療發展策略抱持疑慮態度並有所質疑,認為這些措施可能會降低審查標準,進而造成病人損害6。
四、台灣
台灣對再生醫療亦採取醫療技術與治療藥物雙軌管理。2018年公告修正「特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法」(簡稱特管辦法),開放自體CD34+ selection周邊血幹細胞移植、自體免疫細胞治療、自體脂肪幹細胞移植、自體纖維母細胞移植、自體骨髓間質幹細胞移植及自體軟骨細胞移植等六種特定自體細胞治療技術項目。醫療機構須擬訂施行計畫,向中央主管機關提出申請,另外製備人體細胞組織物之製備場所也必須經過查核,計畫經審查核准,製備場所也取得GTP認可後方可執行。至2021年2月,已有七十個細胞治療技術施行計畫取得許可,主要為治療癌症之自體免疫細胞治療技術,治療之適應症則以第四期實體癌最多。
其他製備過程複雜度較高,臨床應用風險較高,或欲經由查驗登記取得上市許可之產品,則須依循「藥事法」,以藥物相關法規管理。為了確保新興生醫產品的品質與安全,並與國際接軌,我國自2002年陸續公告相關管理法規(表二),涵蓋再生醫療製劑,由新藥開發臨床試驗至申請查驗登記須符合之相關規範,而為使相關產業的法規環境更趨完備,衛生福利部並公告「再生醫療製劑管理條例(草案)」朝向設立專法努力,將針對商品化、規格化、製程加工達標準且一致化之再生醫療製劑納入管理,期望促進國內再生醫療產業發展,讓民眾有機會接受此類新興治療7-10。
表二 我國歷年來公告之再生醫療相關規範
參、已上市再生醫療製劑簡介
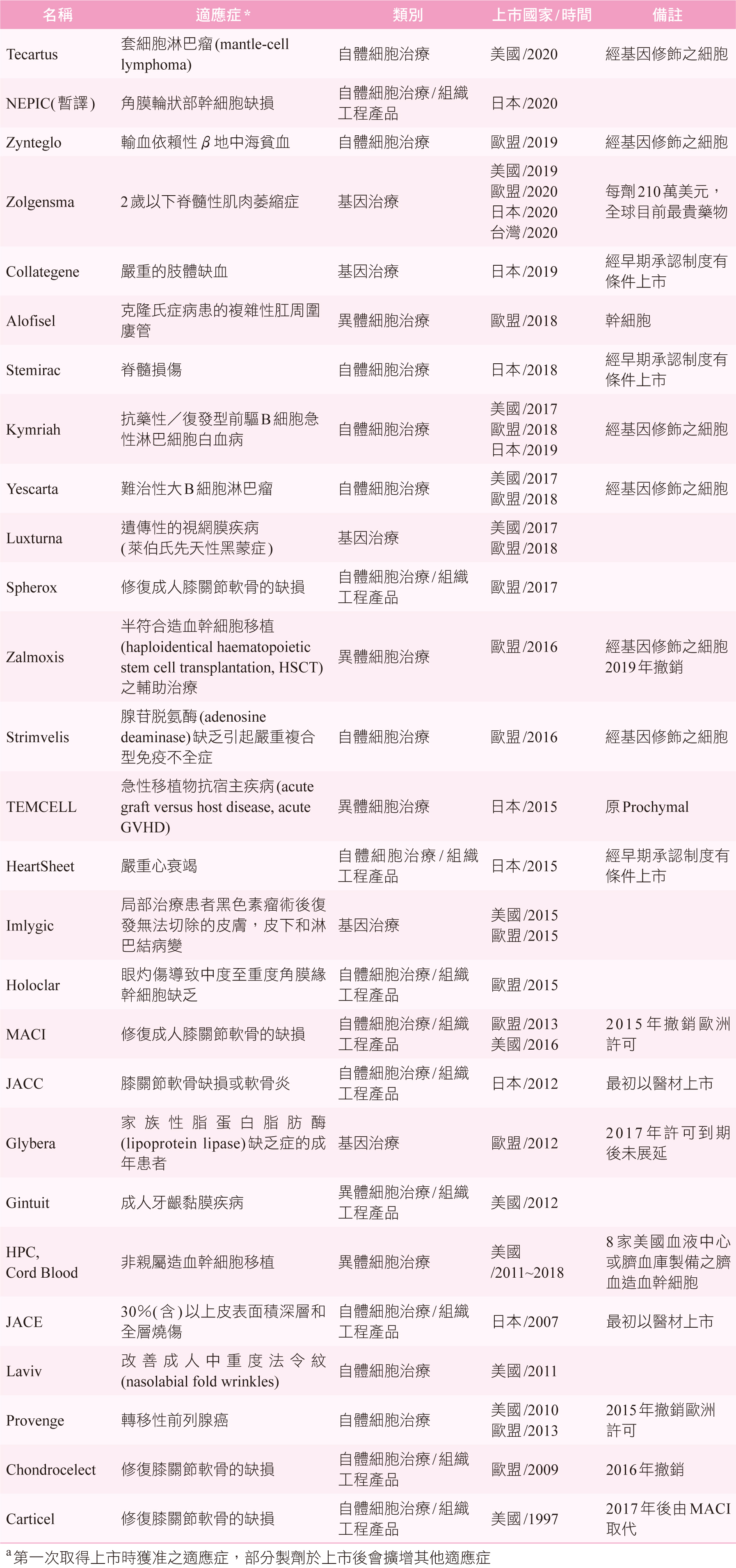
目前世界各國已上市之再生醫療製劑有數十多種,於歐、美、日上市之製劑,簡單彙整如表三。這些再生醫療製劑之適應症包含:修復關節軟骨或皮膚、抗移植免疫排斥、癌症免疫細胞療法及治療遺傳疾病等。早期上市產品主要是由自體細胞培養組成之組織工程製劑,近年來,基因治療製劑與經基因修飾之細胞製劑占比則明顯增加,而細胞治療製劑中,異體比例雖有增加但目前仍以自體較多11。
表三 簡列各國已上市之再生醫療製劑介紹(含已撤銷許可之產品)
細胞治療為未被滿足的醫療需求帶來希望,然而參考過去細胞治療產業發展歷史,有多個已上市產品都因為商業考量或破產而退出歐盟市場,說明了取得上市許可,不代表產品一定可成功銷售。另外再生醫療製劑產品特性和製造工藝的複雜性,使其開發除了須要面對法規議題外,如何降低生產成本、建立溫控物流配送系統、正確估算市場需求等,都是再生醫療產業待解決之課題12。
肆、結語
隨著國際再生醫療相關管理法規日趨成熟完備、生產製造設備與技術精進,再生醫療製劑產品不但上市時程縮短、數量提升,且如Kymriah、Yescarta等產品已打破區域限制,走向國際化取得多國許可。2020年12月,諾華藥廠的Zolgensma取得台灣第一張基因治療藥品許可證,且已有上百個細胞治療製劑及十幾個基因治療製劑之臨床試驗執行中,其中有3%為phase II/III試驗,8%為phase III試驗,我國自行研發之再生醫療製劑產品上市亦指日可待。期待更適合再生醫療之專法盡快通過,建構更完善法規環境,帶動整體產業開發,讓我國再生醫療產業可永續發展。
Brief Introduction of Regenerative Medicinal Products
Chiu-Lan Chen1, Tsung-Yun Liu2
1Department of Pharmacy, Chia Nan University of
Pharmacy and Science
2Taiwan Society of Quality Assurance (TSQA)
Abstract
Regenerative medicinal product is designed to rebuilt or repair the function of human body due to disease or aging, and intended to treat, prevent or reverse a life-threatening disease by the application of cell therapy, gene therapy or tissue engineering products. Recently, we are witness more regenerative medicinal products gained marketing approval in different parts of the world. These products are used in the treatment of otherwise end-stage diseases and sometimes with satisfactory results. The marketing approval of these regenerative medicinal products in the US and EU are based on the risk level management. The products at higher risk are regulated as drugs. On the other hand, Japan and Taiwan regulate the regenerative medicinal products as two-tract system, medical techniques and products, and this will provide another choice for related medical industries. Currently, 70 cell therapy technology implementation projects have been approved and executed in this country. However, we do not yet have any approved regenerative medicinal (cellular) products. We are looking forward to welcoming the new therapy with the improvement of the regulatory environment as well as the growth of regenerative medicinal product related industries.
參考資料:
1. Freyer CW: Tisagenlecleucel: the first CAR on the highway to remission for acute lymphoblastic leukemia. J Adv Pract Oncol 2018;9(5):537-544.
2. Hucks G, Rheingold SR: The journey to CAR T cell therapy: the pediatric and young adult experience with relapsed or refractory B-ALL. Blood Cancer J 2019;9:10.
3. Marks P, Gottlieb S: Balancing safety and innovation for cell-based regenerative medicine. N Engl J Med 2018;378(10):954-959.
4. Coppens DGM, Hoekman J, De Bruin ML, et al: Advanced therapy medicinal product manufacturing under the hospital exemption and other exemption pathways in seven European Union countries. Cytotherapy. 2020;22(10):592-600.
5. Kusakabe T. Regulatory perspectives of Japan. Biologicals. 2015;43(5):422-4.
6. Cyranoski D. The potent effects of Japan's stem-cell policies. Nature. 2019;573(7775):482-485.
7. 衛生福利部:特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法(修正)。臺北:衛生福利部,2018。
8. 衛生福利部食品藥物管理署:人類細胞治療產品查驗登記審查基準。臺北:衛生福利部食品藥物管理署,2015。
9. 衛生福利部食品藥物管理署:人類細胞治療產品臨床試驗申請作業與審查基準。臺北:衛生福利部食品藥物管理署,2014。
10. 行政院衛生署:人體細胞組織優良操作規範。臺北:行政院衛生署,2002。
11. Cuende N, Rasko JEJ, Koh MBC, Dominici M, et al: Cell, tissue and gene products with marketing authorization in 2018 worldwide. Cytotherapy. 2018;20(11):1401-1413.
12. Abou-El-Enein M, Elsanhoury A, Reinke P. Overcoming Challenges Facing Advanced Therapies in the EU Market. Cell Stem Cell. 2016;19(3):293-297.
通訊作者:陳秋蘭/通訊地址:台南市仁德區二路一段 嘉南藥理大學藥學系
服務單位:嘉南藥理大學藥學系/聯絡電話:(O)06-2664911 ext 2201