核醫放射性藥品調劑與法規概論
張文議1、黃文盛1、高潘福2
1臺北榮民總醫院核子醫學部、2中山醫學大學附設醫院核子醫學科
摘要
放射性藥物為以放射性元素或以放射性元素與前驅物結合,作為核子醫學影像診斷或是治療之使用藥物。核醫藥師於調劑藥物時除須確保其安全性與有效性之外,因放射性藥物多為靜脈注射給藥針劑,所以操作時除須有無菌操作的要求,同時也應有輻射防護的訓練。本篇文章簡介歐美核醫藥物之調劑與人員所需之訓練、技術與法規,其次介紹國內核醫藥物臨床調劑與放射性化合物的PIC/S GMP生產等之法規,並探討與歐美現況的差異,建議未來國內法規與教育的方向。
關鍵字: 放射性藥物、radiopharmacist、Pharmaceutical Inspection Co-operation Scheme (PIC/S)
壹、前言
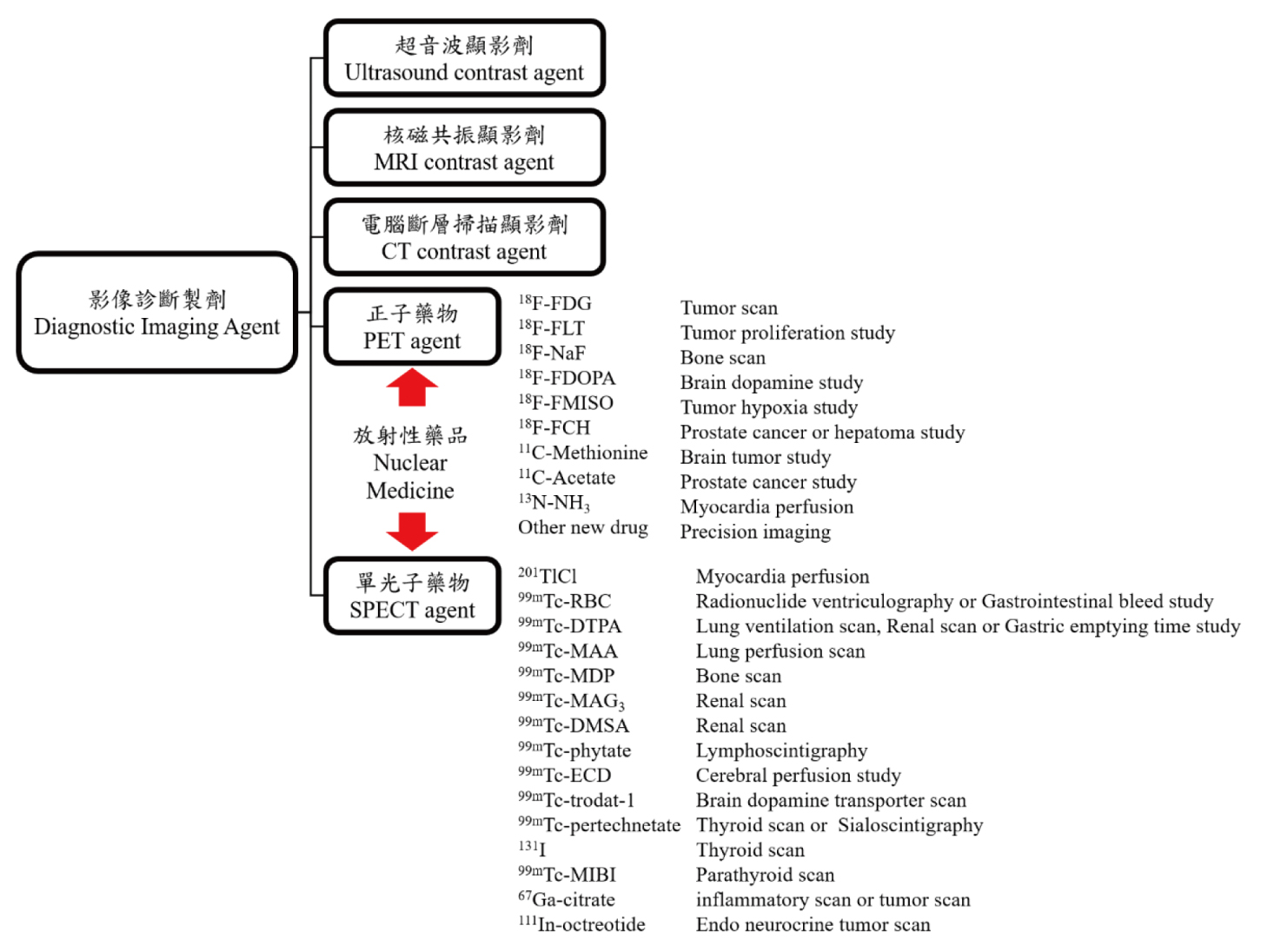
放射性藥品,最早在藥學領域被歸類為一種作為診斷使用的顯影劑,其他如電腦斷層(Computed Tomography, CT)、超音波(Ultrasound, US)與核磁共振(Magnetic Resonance Imaging, MRI)等不同檢查儀器也有其專屬的顯影劑(圖一)。放射性藥品為藥物分子標誌上放射性元素,進入人體後藉由偵測放射性訊號,以了解藥物分子於人體內隨時間變化在各器官的藥物動力學,以判讀特定器官的功能是否正常(圖二)1。因此,放射性藥品所得的影像也稱為功能性影像2,相較其他顯影劑作為解剖性影像有很大的不同3-6。
圖一 台灣影像診斷製劑中放射藥品及其臨床應用(臺北榮民總醫院核子醫學部資料)。
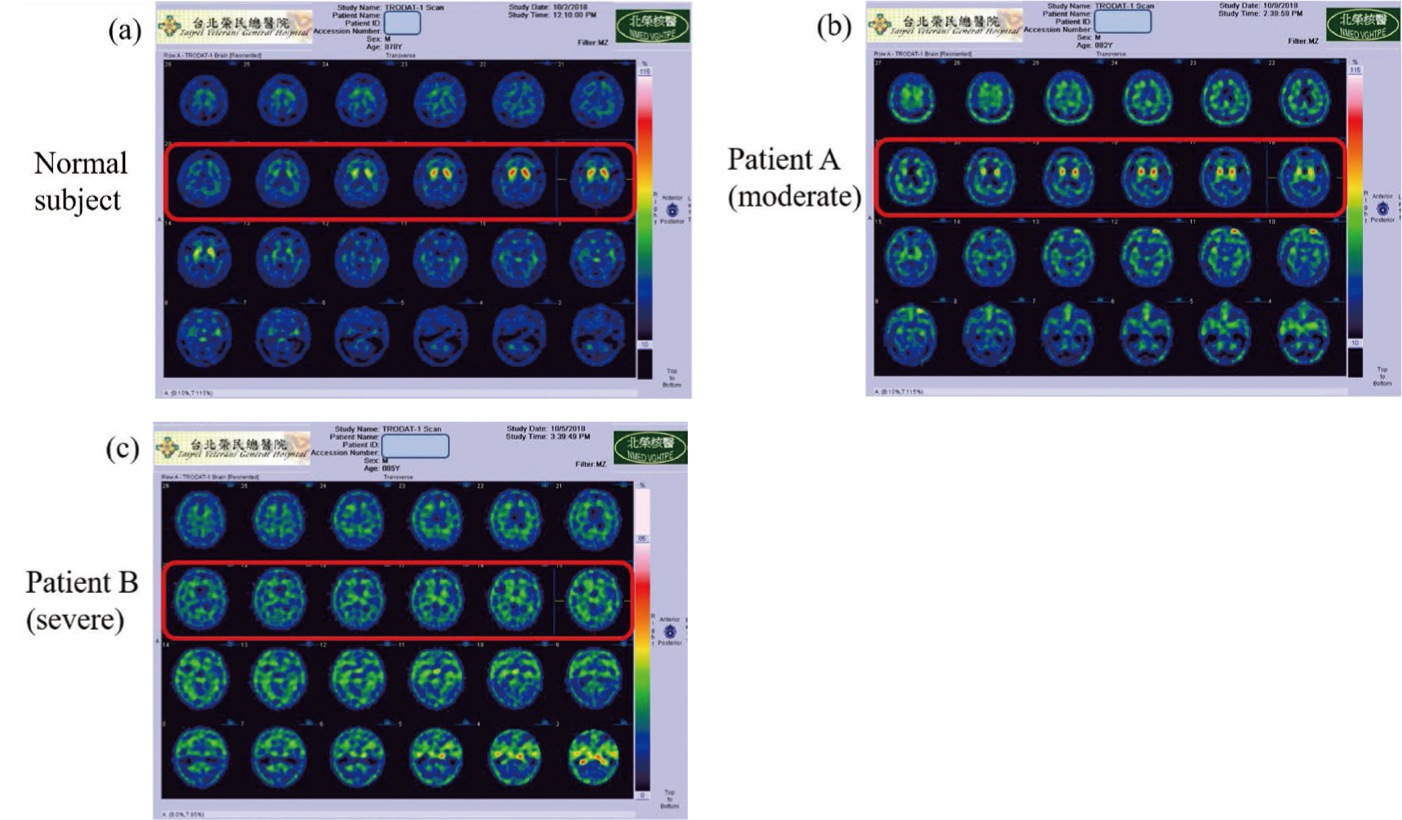
圖二 臺北榮民總醫院99mTc-TRODAT-1測量腦部多巴胺轉運體功能之比較,觀察SPECT影像的差別:(a)為正常受試者,(b)為中等嚴重之病患,(c)為重度嚴重之病患。從SPECT檢查即可由影像看出三者多巴胺轉運體功能的不同。
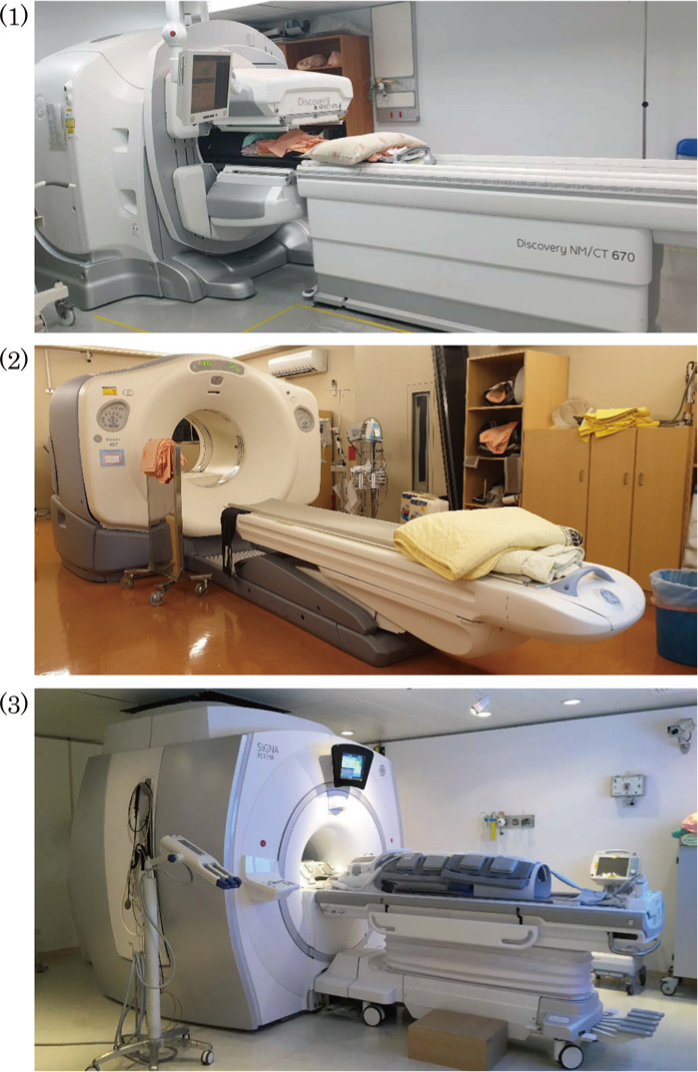
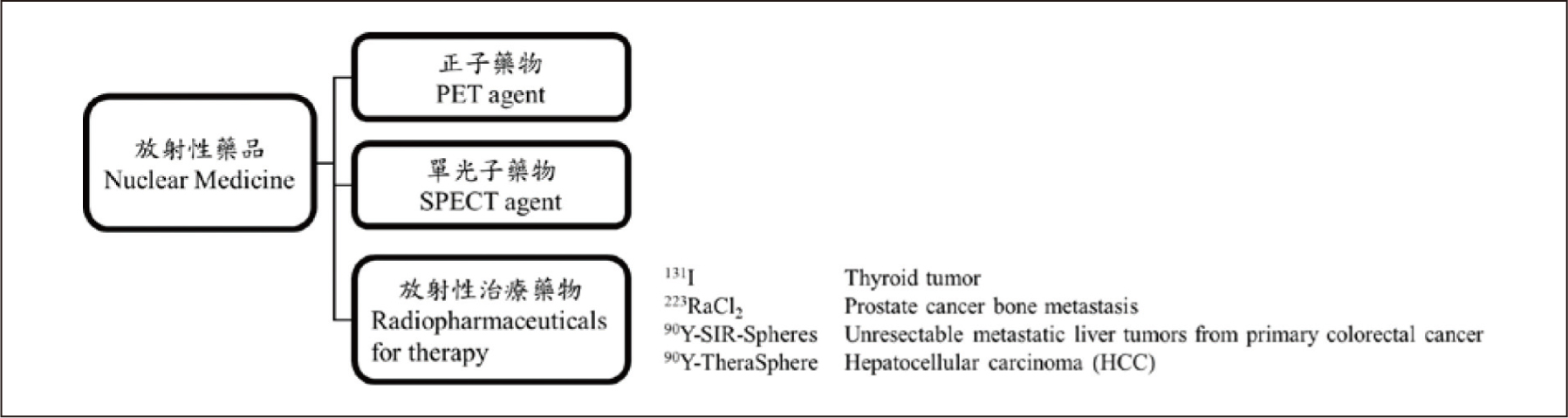
放射性藥品依其藥物分子所攜帶的放射性元素特性與呈像原理的不同,可分為單光子藥物與正子藥物,分別搭配單光子掃描儀(Single photon emission computed tomography, SPECT)與正子掃描儀(Positron emission tomography, PET)進行診斷造影,現今臨床亦有發展合併功能性與解剖性影像的儀器使得診斷更加精確,如SPECT-CT、PET-CT與PET-MRI等(圖三) 7。近年來放射性藥品除了用於臨床診斷,也可使用於臨床癌症治療(甲狀腺癌、前列腺癌、肝癌等),利用藥物分子可積聚於腫瘤部位的特性,再搭配標誌上特定的放射性同位素,以達到殺死腫瘤細胞或抑制腫瘤生長的療效(圖四)。
圖三 臺北榮民總醫院核子醫學部診斷影像儀器: (1)單光子斷層掃描儀(SPECT-CT),(2)正子斷層掃描儀(PET-CT),(3)正子核磁共振掃描儀(PET-MRI)。
圖四 台灣治療用放射藥品及其臨床應用(臺北榮民總醫院核子醫學部資料)。
以下將分別介紹國內外放射藥品調劑與臨床試驗法規,以提供未來法規、臨床給付與國內教育調整之方向的建議。
貳、國外放射藥品調劑與臨床試驗法規解析
一、傳統核醫(單光子)藥品調劑與法規
單光子藥物發展較正子藥物早,因此也被稱為傳統核醫(單光子)藥物,目前在臨床仍被大量使用,其包含的放射性核種有鎝-99m(Tc-99m)、鉈-201(Tl-201)、鎵-67 (Ga-67)與碘-131(I-131)等。核醫單光子放射性藥品的調劑方式,是以相較快速簡單的方式將放射性核種與藥物結合再進行分裝,如Tc-99m methylene diphosphonate (Tc-99m MDP)臨床作為骨骼掃描造影劑之調劑,為先由放射性核種孳生器(generator)取得99mTc-NaTcO4,再注入MDP藥品瓶內(kit)與MDP結合後,經測定酸鹼度與放射化學純度後即可分裝使用8。根據民國96年歐洲放射藥物委員會所提供的良好放射性藥物製備規範(current good Radio-pharmacy Practice, cGRPP)指南9中提及,調劑核醫(單光子)藥品有下列規範:
(一) 操作人員
調劑注射用放射性藥品,操作人員須具無菌操作的技術與輻射防護之觀念。
(二) 品質保證
需有品保人員或是品保單位確保從藥品原料與放射性原料收料,至放射性藥品配製、調劑等過程符合規範。
(三) 設備與設施
調劑核醫(單光子)藥品所需設備為Tc-99m放射性核種孳生器(generator)與劑量校正器(dose calibrator),Tc-99m放射性核種孳生器(generator)應存放於潔淨度Grade A之環境。在調劑區域之調劑操作應於有高效濾網(HEPA)過濾Grade A的層流操作台內執行,環境區域應至少為Grade D的無塵室,人員應穿戴適當的無塵衣帽與無菌手套;輻射防護應有鉛玻璃、鉛磚與環境輻射監控等防護設施。環境應定時清潔,保持潔淨度,且定期監測環境微生物。
(四) 標準作業程序文件
應建立標準作業程序,以確保調劑藥物的品質,且每兩年更新作業程序文件。另外,應根據標準作業程序文件建立紀錄表格,項目建議如下:(a)記錄訂購、驗收的前驅物與原物料;(b)記錄訂購、驗收放射性原料;(c)孳生器掏洗時,應記錄活度、日期、時間;(d)藥品調製時記錄批號、活度、體積、品管結果與放行;(e)調劑場所清潔與維持紀錄;(f)設備的校正與保養紀錄;(g)人員訓練紀錄;(h)放射性物質轉讓紀錄;(i)輻射污染與放射性廢棄物處理紀錄;(j)異常事件紀錄;(k)處方箋紀錄;(l)微生物監測紀錄。
(五) 調劑前準備與調劑過程管制
包含原物料驗收、孳生器掏洗、無菌操作、消毒劑與滅菌劑、操作人員輻射暴露管制。
(六) 品質管制
建議依據美國藥典或歐洲藥典執行藥品品質管制。
(七) 藥物審核與放行標準
須有專人審核生產、調劑與品管文件,確保藥品符合放行標準。
(八) 調劑
調劑時應根據病患處方箋逐一調劑,針劑標籤應標明病患、調劑者、放射性活度、校正時間與放射性物質符號。
(九) 運送
醫院傳統核醫藥物無運送出院外,此項規範對象為藥商與藥局。
(十) 客訴處理
記錄藥品使用端的使用問題,檢討是否為調劑過程衍生的問題,並提出處理方式與事件的追蹤進度。
(十一) 自我稽核
依據標準作業流程,建議每年自我稽核。
(十二) 紀錄保存
所有文件紀錄應有專屬保存場所,並訂定文件保存的時間規範。
二、正子藥品調製與法規
正子藥品與單光子藥品不同,因其包含放射性元素(氟-18、碳-11、氮-13等),其由醫用迴旋加速器生產後,再與標誌前驅物進行放射化學反應;經純化取得產物,再經品管分析,確認符合規格後始得分裝使用。上述流程已屬藥品「製造」與「分裝」,根據民國96年歐洲放射藥物委員會指引9〈Positron Emission Tomography and other Locally Prepared Radiopharmaceuticals〉,其規範建議項目與前述傳統核醫(單光子)藥品相似。近年正子藥物蓬勃發展,歐美對於正子藥品調製法規持續更新,包含歐盟的Pharmaceutical Inspection Co-operation Scheme (PIC/S)和美國的Current Good Manufacture Practice (cGMP)10,對無塵室場所、人員、原物料、品管、放行、建立標準作業程序與品保等訂定更嚴謹的規範11,12,這其中也包含原物料檢驗、藥品分裝時的動態空氣粒子、浮游菌監測等。
三、臨床試驗法規
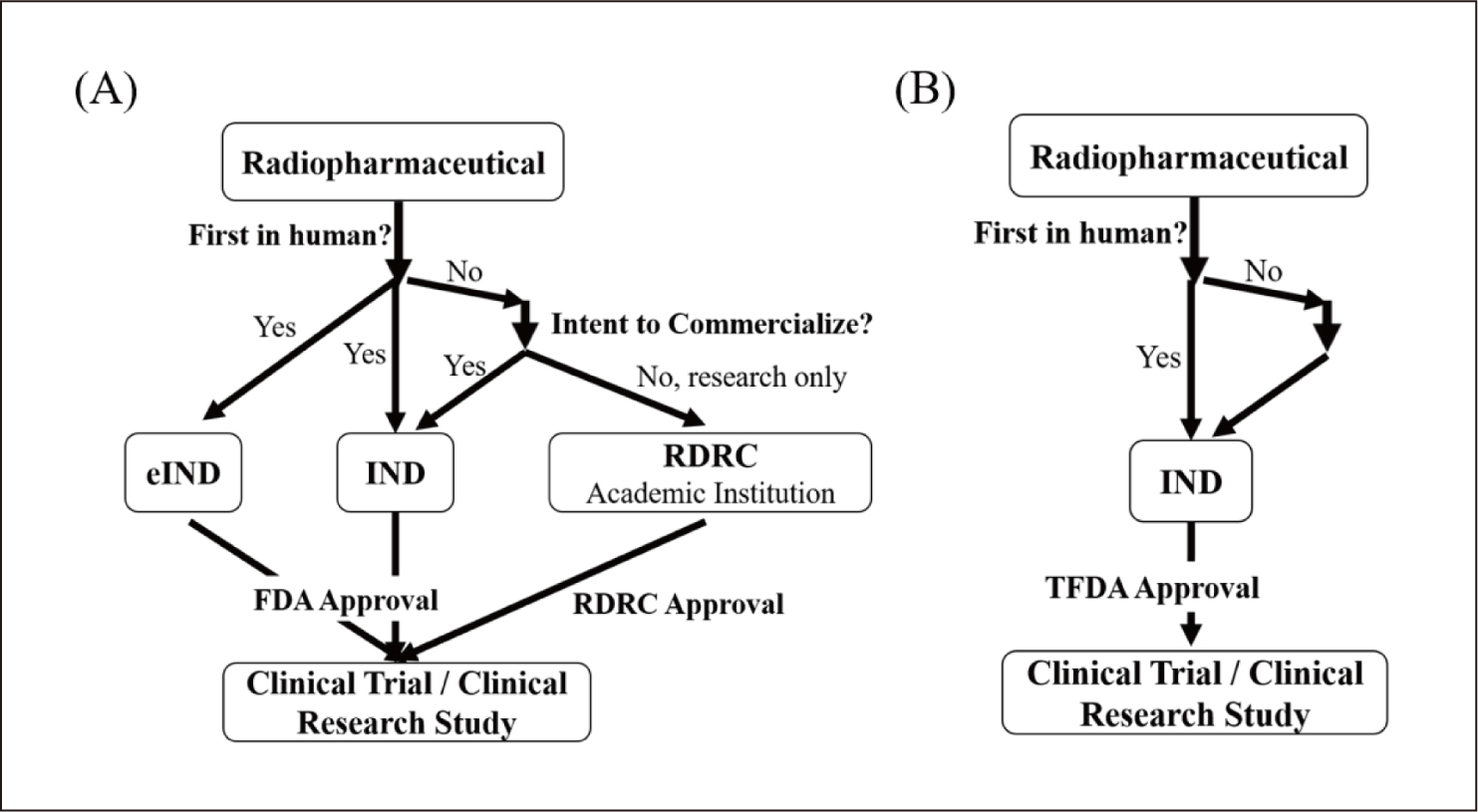
在美國法規中,除了新藥試驗(Investigational New Drug, IND),也有第一期臨床新藥試驗(Exploratory Investigational New Drug, eIND)(圖五)針對於臨床微劑量(低於臨床1/100th藥理作用劑量且最大劑量不超過100μg)的試驗,主要目的為探索人體藥物動力學、藥理學及確認作用機轉。放射藥品在美國還可經另一方式進行臨床試驗,若藥品非為首次人體試用且不進行商品化開發,僅為學術研究用,可向學術單位之輻射藥品研究委員會(Radioactive Drug Research Committee, RDRC)提出申請,經核准後可於人體執行臨床研究。上述申請eIND與RDRC所須提供的文件均少於IND,其原因可能與使用的劑量低於臨床藥理劑量(1/100th),或者實驗藥品非商品化開發,且已有其他人體試驗使用範例有關。
圖五 (A)美國核醫藥物臨床試驗申請10,(B)台灣核醫藥物臨床試驗申請。
參、國內放射藥品調劑與臨床試驗法規解析
一、傳統核醫(單光子)藥物調劑與藥品法規
調劑傳統核醫(單光子)藥品的步驟是以無菌操作技術將放射性核種與市售前驅物(cold kit)結合,品管測驗通過後即可分裝給予臨床使用,此方面的法規,除藥事法、藥師法、放射性物質與可發生游離輻射設備及其輻射作業管理辦法外,因放射性藥品與一般藥品性質不同,行政院衛生署於民國74年公告〈核醫藥局管理要點〉,該要點所稱之核醫藥局係指從事醫用放射性藥品服務,包括配方、調劑、標示、儲存、運輸等項目之藥局。但上述管理要點至今未有更新,因此建議食藥署參考歐美國家較新的規範,訂立較詳盡的新版管理要點以符合國際核醫藥品規範。
國內政府為確保上市核醫放射性藥品的品質、安全性及有效性,並使查驗登記檢送資料時有所依據,於民國88年訂定〈核醫放射性藥品審查基準〉,當時參考美國食品藥物管理局(FDA)於民國70年公告的放射性藥物臨床評估指引(Guidelines for the Clinical Evaluation of Radiopharmaceutical Drugs)13。近年來國內生技製藥產業欲與國際接軌,於民國99年修正〈藥品查驗登記審查準則〉,於附件十、十一加註,核醫放射性藥品查驗登記資料表與新藥、新劑型、新劑量查驗登記技術性資料表,之後政府也跟隨國際潮流,於民國103年公告〈西藥藥品優良製造規範〉,推廣PIC/S GMP,對學術研究及業界造成重要影響。傳統核醫(單光子)藥品前驅物(kit)來源大多來自已符合PIC/S GMP之國外藥廠,國內只有核能研究所可供應部分通過PIC/S GMP審核之藥物品項(http://192.192.22.67/rpc/intro/products_c_2019.htm)。近年國外藥廠為銷售全球,大多已符合PIC/S GMP之規格,但日本藥廠較慢進行因應措施,因此部分由日本進口之品項受到影響。雖然放射性藥品可從歐美進口,但距離較遠,一旦遇到天候不佳、飛機航班延誤、製藥廠設備損壞或歲修等因素,就容易造成國內缺藥,影響病患檢查。期望國內衛生主管機關也應輔導國內藥廠提高產量,或尋找其他國際藥廠以供應我國需求。
二、正子藥品與法規
正子藥物的半衰期較傳統核醫(單光子)藥物短,不易由國外進口,世界各國都在他們國內設置醫用迴旋加速器,以生產正子放射核;再搭配放射藥物自動合成設備,以製造此類藥物。台灣自民國81年臺北榮民總醫院設立國家多目標醫用迴旋加速器中心,引進台灣首部醫用迴旋加速器,搭配正子藥物自動化合成核,進行正子藥物開發與生產,至今全國已有九所醫院設有迴旋加速器中心以供應全台正子藥物需求。此外,近年陸續有兩家正子藥物藥廠成立,可見國內對於此類藥物的需求逐年提升。然而,目前國內放射藥品法規卻未與國際同步,例如歐美等國正子藥物的藥證可由藥廠與醫院申請,但台灣僅止於藥廠。雖然國內北部與中部各有一家正子藥品生產藥廠成立,且領有一品項藥證(氟-18標記葡萄糖,2-[18氟]-2-去氧-D-葡萄糖,18F-FDG),但由於半衰期只有110分鐘,因此每日的產量無法供應全台使用,而大部分臨床使用之18F-FDG仍需由九所醫院提供。
針對醫院的正子藥物調製法規是依據衛生署於民國92年公告之〈斷層掃描用正子放射同位素調製作業要點〉,並於民國94年至今陸續以科技計畫方式委託辦理醫院調製作業查核、教育訓練課程及研討會等事宜,並於民國100~101年計畫中新增正子放射同位素cGMP之製造管理法規研究。〈斷層掃描用正子放射同位素調製作業要點〉作業至今已超過15年,雖然相較國際最新法規仍有可改進之處,但依據臺北榮民總醫院的紀錄顯示,至今無任何民眾使用正子藥品而產生嚴重副作用之紀錄。根據美國研究資料(2007~2011年)14,一般放射性藥物常見的副作用為熱潮紅、噁心、低血壓與感覺異常等,標準為無嚴重副作用且副作用發生率約為十萬分之二,因此醫院依據現行法規,亦是能生產具一定品質且安全之正子藥物。
民國108年,國內衛生主管機關為強化我國斷層掃描用正子放射同位素調製之品質,將原有〈斷層掃描用正子放射同位素調製作業要點〉修訂為〈斷層掃描用正子放射同位素優良調製作業指引〉,其新增內容包含應建立先期性及回朔性之風險評估與潔淨室級區定義比照PIC/S改為A、B、C、D級區。目前國內衛生主管機關欲參考國外較新法規(PIC/S GMP)再次修訂,但卻仍以一般藥物的標準來審核正子藥物,未將PIC/S GMP附則三〈放射性藥品的製造〉的規範納入考量。國外將放射性藥品的製造增列於PIC/S GMP附則三中就代表放射性藥品與一般藥品的不同,且須依其特性訂立適當的規範。
上述PIC/S GMP均適用於藥廠(industry,文件編號:PE 009-14),但如以PIC/S GMP (PE 010-4)附則三,則針對醫院(healthcare establishments)15進行規範,以輔導國內各醫院迴旋加速器中心調製正子藥物更為恰當。
PIC/S GMP (PE 010-4)之主要目的為使醫院藥品調製有適用的法規可依循,且經衛生主管機關查驗登記通過之藥物品項可獲取藥品許可證,於醫院內使用亦可申請醫療健保給付。在美國藥廠經查驗登記獲取藥品許可證之後可販賣藥物,而醫院亦可申請查驗登記取得藥品許可證後僅供院內使用。期望將來衛生主管機關可成立放射藥品審核委員會,召集此領域藥物學術與臨床專家協助審核設立適當法規,輔導正子製藥醫院提高製藥品質,以利國內放射性藥品研發與臨床應用能與國際接軌。
三、臨床試驗法規
國內財團法人醫藥品查驗中心於民國107年當代醫藥法規月刊中〈歐美近代核醫放射藥品法規解析〉一文討論歐美與台灣臨床試驗法規的現況16。近年放射性藥品臨床試驗申請時也出現無適用規範的困境,民國107年藥品查驗中心參考美國FDA相關規範,公告〈核醫放射性藥品於國內申請IND時,化學、製造與管制(CMC)、藥動(PK)及藥毒理(PT)方面應提供那些技術性資料?〉的訊息。目前已有研究因計畫內容所使用之藥物並非以商品化開發為主,僅為學術研究使用,卻無類似國外eIND或RDRC可申請(圖五),使得計畫無法執行。期望藥品查驗中心或衛福部可參考美國FDA,成立審核委員會以利國內臨床研究發展。
肆、建議法規與教育並進
臨床與研究的法規需全面性的考量,建議衛福部召集國內外專家學者一同參與,啟動放射藥品領域法規之研擬。另外通盤考量國內放射性藥品教育,例如放射藥物學在核子醫學部中,核醫醫師有專科證照制度;核醫放射師其基礎課程與臨床實習於大學醫事放射學系課程中均已包含;但與放射藥品最為直接關係的核醫藥師,其大學相關課程明顯不足,亦無相關單位之見習或實習。在歐美放射核醫藥師為取得藥師資格後再經上課、訓練與考試。美國醫院藥師學會(American Society of Health-System Pharmacists, ASHP)認證之專科住院藥師訓練類別中亦有相關證照(Educational Outcomes, Goals, and Objectives for Postgraduate Year Two (PGY2) Residencies in Nuclear Pharmacy, https://reurl.cc/gKAgV)。國內目前並無相關專業學程,僅於調劑學中的一堂或將內容設立於選修課程中獨立開課。但藥師在放射藥品領域中不只是擔任調劑而已,藥師可作為放射藥品的研究開發、製造、品管、調劑、品保等角色,且放射領域有關的課程更涉及了化學、藥物化學、藥理學、藥物分析、調劑學、法規、CGMP或PIC/S GMP等藥學課程,但在現今台灣教學中卻將上述課程中,與放射藥品相關的內容省略,實為可惜。
伍、臨床調劑給付
放射性藥品為醫院的核醫部門使用,負責調劑的藥師除須具備藥師執照外,根據政府所發布〈放射性物質或可發生游離輻射設備操作人員管理辦法〉,須持有放射性物質操作相關證書,如輻射安全證書、輻射防護員執照或輻射防護師執照,才能進行調劑。放射性藥品調劑必須遵守無菌操作規範,且應於放射性物質管制區域內執行,法規上對於執行人員(藥師)、調劑方式、場所和調劑後放射性廢棄物的處置於〈放射性物質與可發生游離輻射設備及其輻射作業管理辦法〉中有嚴謹的規範。在全民健康保險醫療服務給付項目及支付標準中,放射性藥品是特殊調劑藥品中的一類,但給付卻僅有225點,較全靜脈營養注射與化療藥品的365點為低。近年來歐美國家新開發多種具治療效果的放射性藥品,國內則只有I-131膠囊、Y-90微球體與Ra-223鐳治骨三種,其中I-131膠囊有健保給付,用於治療甲狀腺機能亢進和甲狀腺癌轉移;另外Ra-223鐳治骨則於108年通過健保給付,用於前列腺癌骨轉移治療,但其調劑屬放射性藥品,給付點數仍低於TPN與化療藥品。
陸、結語
放射性藥品相較其他藥物發展晚且品項較少,近年來歐美先進國家蓬勃發展,許多新型診斷或治療的放射性藥品研究或上市,國內藥師於臨床前的研究與上市後的製造、調劑與品管,甚至於法規制定都應積極參與。衛福部應加緊修改相關法規與準則,審慎參考歐美相關規範,使得國內醫藥產業與研究能與國際接軌。此外,希望國內能從教育開始加強國內藥學系學生對於放射藥品的基礎概論,才能讓學生於畢業後能銜接上國際最新個人化精準醫療的醫學領域發展。
Introduction of Radiopharmaceutical Dispensing and Regulations in Taiwan
Wen-Yi Chang1, Wen-Sheng Huang1, Pan-Fu Kao2
1Department of Nuclear Medicine, Taipei Veterans
General Hospital
2Department of Nuclear Medicine, Chung Shan
Medical University Hospital
Abstract
Radiopharmaceutical is a field of medicine using radio-isotopes or radio-isotopes conjugate with organic compound for nuclear medicine diagnosis and treatment of diseases. The main responsibility of the radiopharmacist or radiopharmaceutical scientist in nuclear medicine is the preparation of radiopharmaceuticals to ensure their safety and efficacy. Many radiopharmaceuticals are administered by intravenous injection, so that preparation needs to be performed under aseptic conditions. All radiopharmaceuticals are, by definition, radioactive, so that radiation protection forms an integral part of the job. This article summarizes important legal documents and guidelines in relation to human application of radiopharmaceuticals that pose a major challenge in implementing the full potential of this technology, thereby differentiating the Taiwan from the United State and European situation. Regulations are reviewed with respect to licensing, conducting clinical and radiopharmaceutical production - including PIC/S GMP for radioactive compounds. Professional requirements, including education, are discussed, with an outlook on future developments.
參考資料:
1. Lin WC, Tsai NW, Huang YC, et al: Peripheral leukocyte apoptosis in patients with Parkinsonism: correlation with clinical characteristics and neuroimaging findings. Biomed Res Int. 2014, doi: 10.1155/2014/635923
2. Prvulovich EM, Bomanji JB: The role of nuclear medicine in clinical investigation. BMJ. 1998;316(7138):1140-1146.
3. Boss A, Bisdas S, Kolb A, et al: Hybrid PET/MRI of intracranial masses: initial experiences and comparison to PET/CT. J Nucl Med. 2010;51(8):1198-1205.
4. Heusch P, Buchbender C, Kohler J, et al: Thoracic staging in lung cancer: prospective comparison of 18F-FDG PET/MR imaging and 18F-FDG PET/CT. J Nucl Med. 2014;55(3):373-378.
5. Subesinghe M, Scarsbrook AF, Sourbron S, et al: Alterations in anatomic and functional imaging parameters with repeated FDG PET-CT and MRI during radiotherapy for head and neck cancer: a pilot study. BMC Cancer. 2015;15:137.
6. Histed SN, Lindenberg ML, Mena E, et al: Review of functional/anatomical imaging in oncology. Nucl Med Commun. 2012;33(4):349-361.
7. Prakash D: Introduction to Nuclear Medicine. Nuclear Medicine: A Guide for Healthcare Professionals and Patients. New Delhi: Springer India 2014:1-8.
8. International AtomicEnergy Agency: Operational Guidance on Hospital Radiopharmacy: A Safe and Effective Approach. Vienna, 2008. 90p
9. European Association of Nuclear Medicine: Guidelines on current good Radio-pharmacy Practice (cGRPP) in the Preparation of Radiopharmaceuticals, Version 2. 2007. 19p
10. Food, Drug Administration HHS: Current good manufacturing practice for positron emission tomography drugs. Fed Regist. 2009;74(236):65409-65436.
11. International AtomicEnergy Agency: Good Practice for Introducing Radiopharmaceuticals for Clinical Use. Vienna, 2016. 84p
12. International AtomicEnergy Agency: Quality Control in the Production of Radiopharmaceuticals. Vienna, 2018. 150p
13. United State Food and Drug Administration: Guidelines for the clinical evaluation of radiopharmaceutical drugs. 1977.
14. Silberstein EB: Prevalence of adverse events to radiopharmaceuticals from 2007 to 2011. J Nucl Med. 2014 Aug;55(8):1308-10.
15. Pharmaceutical Inspection Convention: PIC/S Guide to Good Practices for the Preparation of Medicinal Products in Healthcare Establishments. 2014. PE 010-4
16. 段宗帆:歐美近代核醫放射藥品法規解析。當代醫藥法規月刊2018;87:1-15。
通訊作者:張文議/通訊地址:台北市北投區石牌路二段201號
服務單位:臺北榮民總醫院核子醫學部/聯絡電話:(O) 02-28757301 ext 548