難治型憂鬱症的革命性新藥
杜駿廷、童玟津
員林基督教醫院藥劑課
摘要
新型抗憂鬱藥Spravato®的藥物成分為esketamine鼻噴劑,是K他命(ketamine)的鏡像異構物(enantiomer)之一,為N-甲基-D-天門冬氨酸受體拮抗劑(N-methyl-D-aspartate receptor antagonist, NMDA receptor antagonist)1;其作用原理與目前治療憂鬱症的藥物不同。美國食品暨藥物管理局(US FDA)於2019年3月核可esketamine鼻噴劑配合口服抗憂鬱藥物,合併治療難治型憂鬱症(treatment-resistant depression, TRD) 2。此外,esketamine可望應用於「具有立即性自殺風險」的重度憂鬱症(major depressive disorder, MDD),目前進入第三期臨床試驗3。雖然esketamine已由短期臨床試驗證實其快速的療效與良好的耐受性,但缺乏長期用藥的數據,加上成癮性及濫用的疑慮,仍需要更多後續的研究與觀察。
關鍵字: esketamine、NMDA receptor antagonist、treatment-resistant depression
壹、疾病簡介
依據STAR*D study (sequenced treatment alternatives to relieve depression, STAR*D)統計結果,「難治型憂鬱症」的專家共識為:接受過兩種單一抗憂鬱藥物治療,但於適當劑量、足夠療程的情況下,仍然療效不彰者4。
大型研究STAR*D study開始於2001年,為期六年。為接近臨床治療實況,試驗設計採開放性試驗(open-label treatment),醫護人員與受試者皆知悉藥物與心理治療方案。經17題版本的「漢氏憂鬱症狀量表(Hamilton Depression Rating Scale, HDRS)」評分≧14分者具受試資格,分數越高症狀越嚴重。除HDRS外,症狀量化工具使用「憂鬱症狀快速評定量表(Quick Inventory of Depression Symptomatology-Clinician Rating, QIDS-C)」與「憂鬱症狀快速評定量表-自評(QIDS-Self-Report, QIDS-SR)」。主要評估指標為症狀緩解(remission),以HDRS總分低於7分或QIDS-SR低於5分為症狀緩解指標。
試驗分四階段,第一階段使用藥物citalopram,療程14週,症狀緩解者維持原治療藥物與劑量,繼續追蹤12個月;未達緩解標準者進入第二階段。第二到第四階段分別提供多種治療方案,含更換藥物、加入第二種藥物與心理治療,每階段療程12週,症狀緩解者維持原治療方案,繼續追蹤12個月;未達緩解標準者則進入下一階段。共追蹤3,671名受試者,第一到第四階段獲得症狀緩解的受試者比例分別為37%、31%、14%、13%,與第一、二階段比較,第三與第四階段的緩解率明顯大幅地下降4,5。
貳、新藥介紹
一、 作用機轉
憂鬱症成因複雜,目前已知與數個神經傳導物質(neurotransmitters)失調有關,包含血清素(serotonin)、去甲腎上腺素(norepinephrine)、多巴胺(dopamine)、麩胺酸(glutamate)、γ-胺基丁酸(γ-Aminobutyric acid, GABA)等。除了熟悉的serotonin之外,研究發現,重度憂鬱症患者大腦枕葉皮質區(occipital cortex)的glutamate上升、GABA下降6,於是麩胺酸拮抗劑(glutamate antagonist)成為治療憂鬱症的新切入點。NMDA receptor屬glutamate receptor的一個亞型,esketamine是一種非選擇性、非競爭型的NMDA receptor antagonist 1,7,8。Esketamine為ketamine之左式鏡像異構物(S-enantiomer),其作用快速,可在數小時內緩解難治型憂鬱症病徵,包含自殺意念(suicidal ideation) 1,7。
二、適應症與用途
Esketamine鼻噴劑配合口服抗憂鬱藥物,合併治療成人難治型憂鬱症2,不可作為麻醉劑1。
三、劑量和給藥
Esketamine鼻噴劑型為單一裝置包裝,每裝置含兩噴,共遞送劑量28mg。若需投藥56mg則於間隔五分鐘後,使用第二個裝置。須合併口服抗憂鬱藥物治療,建議劑量為第一天鼻內給56mg;第1至第4週,每週兩次給予56或84mg;第5至8週,每週一次鼻內給藥56或84mg,然後每兩週一次或每週一次,劑量維持56或84mg。在第9週之後,以最少頻率的劑量投藥1。
四、療效、安全性
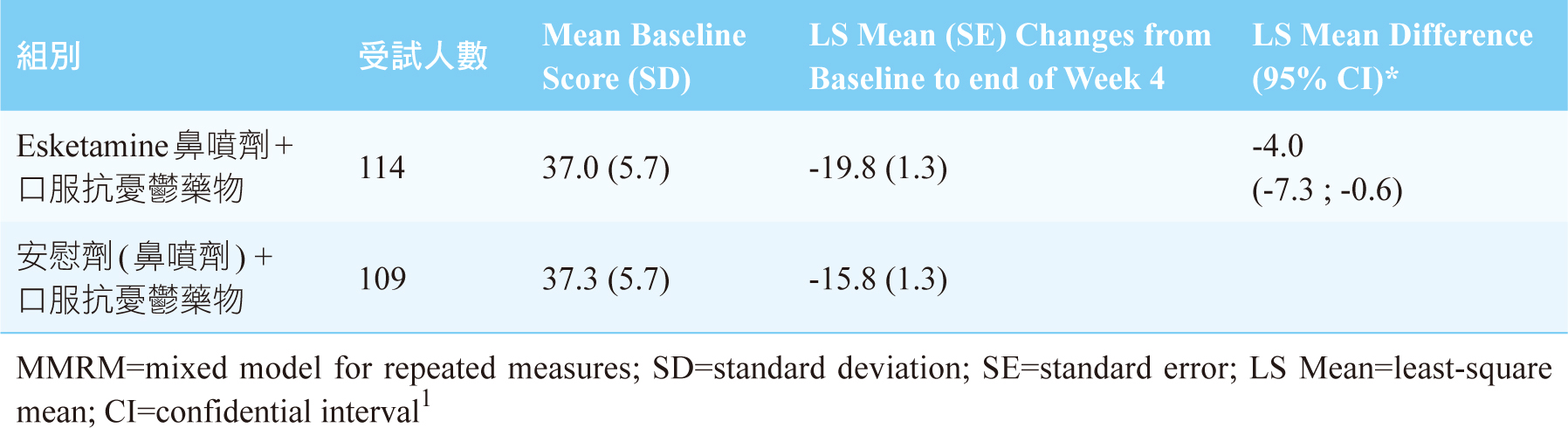
依DSM-5診斷準則確診為重度憂鬱症,且已接受過至少兩種適當劑量、足夠療程的抗憂鬱藥物卻仍未獲得緩解的受試者,進行為期四週(短期),隨機、雙盲、多中心的臨床試驗。將受試者隨機分配為用藥組與安慰劑組,症狀評估使用「蒙哥馬利抑鬱評定量表(Montgomery-Asberg Depression Rating Scale, MADRS)」,分數越高表示症狀越嚴重。用藥組每週使用兩次esketamine鼻噴劑合併口服抗憂鬱藥物;安慰劑組使用安慰劑合併口服抗憂鬱藥物;結果顯示用藥組的症狀改善優於安慰劑組。統計結果詳表一1。
表一 四週(短期)臨床試驗用藥組與安慰劑組MADRS的LS mean比較(MMRM)1
另一個試驗將已經接受esketamine鼻噴劑合併口服抗憂鬱藥物治療四週後,其中三週MADRS總分≦12分的受試者,定義為病情穩定緩解。穩定緩解的受試者續接受16週esketamine鼻噴劑合併口服抗憂鬱藥物治療,隨後分配為維持期用藥組與安慰劑組,觀察維持期用藥組預防憂鬱症復發的效果,追蹤至疾病復發(追蹤期間逾70週)。疾病復發主要評估指標(primary endpoint)為疾病復發時間;疾病復發定義為MADRS總分連續兩週≧22分、憂鬱症惡化需住院或其它象徵疾病復發的臨床指標1。維持期用藥組投藥頻率為每兩週一次或每週一次,投藥劑量56mg或84mg。數據顯示,維持期用藥組復發風險較低1。
綜合分析esketamine鼻噴劑的耐受性及安全性,統計五個第三期臨床試驗1,601名受試者與一個第二期臨床試驗結果,共計1,709名受試者。其中479名受試者完成6個月以上的藥物治療,178名受試者完成12個月的藥物治療。194名(12%)受試者年齡>65歲,為時一年試驗期間未觀察到年長受試者與一般受試者產生用藥劑量或副作用的差異。esketmine鼻噴劑還沒進行兒童族群的試驗,資料闕如。分析各項副作用導致停藥的比例為:焦慮(1.2%)、憂鬱(0.9%)、血壓上升(0.6%)、頭暈(0.6%)、自殺意念(0.5%)、精神解離(0.4%)、噁心(0.4%)、嘔吐(0.4%)、頭痛(0.3%)、肌肉無力(0.3%)、暈眩(0.2%)、高血壓(0.2%)、恐慌(0.2%)、鎮靜(0.2%)1。
此外,依據美國FDA核准,進行中的esketamine第三期臨床試驗,招收145名12~18歲、有立即性自殺意念的重度憂鬱症青少年受試者,進行200天隨機、雙盲、平行分組試驗。受試者分為四組,第一至三組為84mg/56mg/28mg三種劑量的esketamine合併口服安慰劑;第四組使用口服midazolam(劑量0.125mg/kg)與鼻噴安慰劑組比較。預期2021年公布第一階段試驗結果3。
五、 藥物動力學
Esketamine經鼻腔吸收的平均生體可用率(bioavailability)為48%,投藥20~40分鐘後達到最高血中濃度(maximum plasma concentration),後以雙相方式從血漿排除(biphasic decline in plasma concentration),前2~4小時迅速下降,平均末相排除半衰期(mean terminal half-life)為7~12小時。Esketamine主要經肝臟cytochrome P450系統中的2B6與3A4酵素代謝為具活性代謝物noreskeatmine。活性代謝物noreskeatmine與相關受體的親和力(affinity)略低於esketamine。小於劑量1%的原型藥物及78%的代謝物經尿液排泄1。
六、 使用與注意事項
美國現行規定esketamine鼻噴劑必須在指定醫療機構,並由醫療照護者的直接監督下進行使用,包括鼻腔給藥與給藥後觀察。給藥前須評估血壓,如果收縮壓>140mmHg,舒張壓>90mmHg,須審慎評估血壓或顱內壓升高的風險;給藥後建議觀察2小時,必要時給藥後40分鐘可再度評估血壓。由於esketamine鼻噴劑可能引起噁心或嘔吐,可提醒患者使用前2小時避免進食,使用前30分鐘避免飲用液體。給藥日如需要使用其它鼻噴劑,建議投藥間隔至少1小時1。
依臨床試驗統計,esketamine鼻噴劑發生率大於5%的副作用包含:解離(dissociation)、頭暈/眩暈、噁心、嘔吐、鎮靜、感覺遲鈍(hypoesthesia)、昏睡(lethargy)、血壓上升、酒醉感1。目前尚無證據支持兒童與孕婦使用1。具動脈瘤性血管疾病或動靜脈畸形、腦內出血病史者禁用1。
七、 藥物交互作用
Esketamine併用中樞神經抑制劑,如benzodiazepine、opioid、酒精,會加成鎮靜效果1。併用monoamine oxidase inhibitor (MAOI) 或中樞神經刺激劑,如methylphenidate、modafanil,須密切監測血壓1。
參、結語
台灣列管為第三級管制藥品的ketamine於1970年即已獲得美國FDA核准作為麻醉劑;2000年時有小規模的隨機雙盲人體試驗,發現靜脈注射ketamine可快速產生抗憂鬱效果9,然而ketamine存在成癮性與濫用的風險,且會發生不可逆副作用,如膀胱功能受損、記憶受損、認知功能障礙等1,加上沒有足夠臨床研究證據,至今美國FDA仍未開放ketamine當作抗憂鬱藥物。雖然esketamine臨床試驗結果並未出現奇蹟式的抗憂鬱效果,而且仍然有精神解離副作用與潛在成癮性的疑慮,然有鑑於傳統抗憂鬱藥物需4~6週才能發揮藥效,僅需數小時即可產生療效的esketamine或可定位為傳統藥物空窗期間與病情惡化時的救援治療。期望後續的長期試驗有正面消息,為難治型憂鬱症的藥物治療開啟新扉頁。
A Game Changer for Treatment-resistant Depression
Chun-Ting Tu, Wen-Jin Tung
Yuanlin Christian Hospital
Abstract
Spravato®, a new antidepressant, is a nasal spray formulation of esketamine, which is the S-enantiomer of ketamine and acts as a N-methyl-D-aspartate (NMDA) receptor antagonist, meaning the entirely new mechanism of action. In March 2019, esketamine nasal spray, combined with an oral antidepressant, received the US FDA approval for treatment-resistant depression (TRD). There are ongoing trials to evaluate the safety and efficacy for major depressive disorder with imminent risk for suicide. Several short-term trials showed rapid antidepressant effect and acceptable tolerance of esketamine. Given the paucity of data on the maintenance esketamine treatment, further advanced studies are conducted to address the concern about addiction liability and potential for abuse.
參考資料:
1. US Food and Drug Admnistration. Drugs@FDA: FDA Approved Drug Products. Available at: https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/211243lbl.pdf
2. US Food and Drug Admnistration. FDA approves new nasal spray medication for treatment-resistant depression; available only at a certified doctor's office or clinic. Available at: https://www.fda.gov/news-events/press-announcements/fda-approves-new-nasal-spray-medication-treatment-resistant-depression-available-only-certified
3. US Food and Drug Admnistration. Study to Evaluate the Efficacy and Safety of 3 Fixed Doses of Intranasal Esketamine in Addition to Comprehensive Standard of Care for the Rapid Reduction of the Symptoms of Major Depressive Disorder, Including Suicidal Ideation, in Pediatric Participants Assessed to be at Imminent Risk for Suicide. Available at: https://clinicaltrials.gov/ct2/show/NCT03185819
4. Unipolar treatment resistant depression in adults: Epidemiology, risk factors, assessment, and prognosis. In: UpToDate, Post TW (Ed), UpToDate, Waltham, MA. (Accessed on Jul 16, 2018.)
5. Sinyor M, Schaffer A, Levitt A. The sequenced treatment alternatives to relieve depression (STAR*D) trial: a review. Can J Psychiatry. 2010 Mar;55(3):126-35.
6. Unipolar depression in adults: Epidemiology, pathogenesis, and neurobiology. In: UpToDate, Post TW (Ed), UpToDate, Waltham, MA. (Accessed on Feb 13, 2019.)
7. Ketamine and esketamine for treating unipolar depression in adults: Administration, efficacy, and adverse effects. In: UpToDate, Post TW (Ed), UpToDate, Waltham, MA. (Accessed on Dec 29, 2019.)
8. Mitchell ND, Baker GB. An update on the role of glutamate in the pathophysiology of depression. Acta Psychiatr Scand. 2010 Sep;122(3):192-210.
9. Berman RM, Cappiello A, Anand A, et al: Antidepressant effects of ketamine in depressed patients. Biol Psychiatry. 2000 Feb 15;47(4):351-4.
通訊作者:杜駿廷/通訊地址:彰化縣員林市莒光路456號 藥劑課
服務單位:員林基督教醫院藥劑課/聯絡電話:(O) 04-8381456 ext
1157、1156