臺灣製藥產業的重要性
陳志麟
臺灣製藥工業同業公會西藥經營發展委員會
摘要
2020年嚴重特殊傳染性肺炎(COVID-19)疫情籠罩全球,我國衛生福利部超前部署,在疫情初期備妥各項醫療防疫措施,更與國產製藥廠共同合作籌組製藥國家隊,提供防疫酒精、第二原料藥來源供應、醫療院所穩定供貨、疫苗研發等,讓民眾安心免於缺藥危機。有92.7%民眾對於國產製藥能確保藥品供應無虞有信心,凸顯製藥產業於國防民生工業的重要性。我國衛生福利部食品藥物管理署於2013年加入國際醫藥品稽查協約組織(Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme, PIC/S)及2018年加入國際醫藥法規協和會(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH)組織1,藥品查驗登記審查及製造法規均與國際接軌且藥品具嚴謹的上市後品質2管控機制,建立各種監控系統,包括藥品安全監視網、不良品通報、療效不等通報等;當發現異常時,立即啟動調查及處理等相關措施,以確保用藥安全。國際間美國、日本及歐盟國家已正視學名藥供給的重要性,我國應將使用國產學名藥訂為重要政策,鼓勵並制定相關配套措施,穩定藥品供應鏈,為國產製藥產業永續發展奠基,讓生技製藥業有後盾投入研發與創新進而更蓬勃發展。
關鍵字: 學名藥、嚴重特殊傳染性肺炎/新冠肺炎/武漢肺炎、藥品供應鏈、Generic drugs、Severe Acute Respiratory Syndrome Coronavirus 2、Coronavirus Disease-2019 (COVID-19)、drug supply chain
壹、 前言
2020年嚴重特殊傳染性肺炎即新冠肺炎或稱武漢肺炎(COVID-19)疫情籠罩全球,我國衛生福利部超前部署,在疫情初期備妥各種醫療防疫措施,更與國產製藥廠共同合作籌組製藥國家隊,在防疫酒精、第二原料藥來源供應、醫療院所穩定供貨、疫苗研發等方面,讓民眾安心免於缺藥危機。根據衛生福利部食品藥物管理署委託臺灣製藥工業同業公會執行2020年「定位國產製藥品質形象」計畫裡在一項「2020年學名藥認知及國產製藥發展現況調查」報告3指出:有92.7%民眾對於國產製藥能確保藥品供應無虞有信心,凸顯製藥產業具有國防民生工業的重要性。
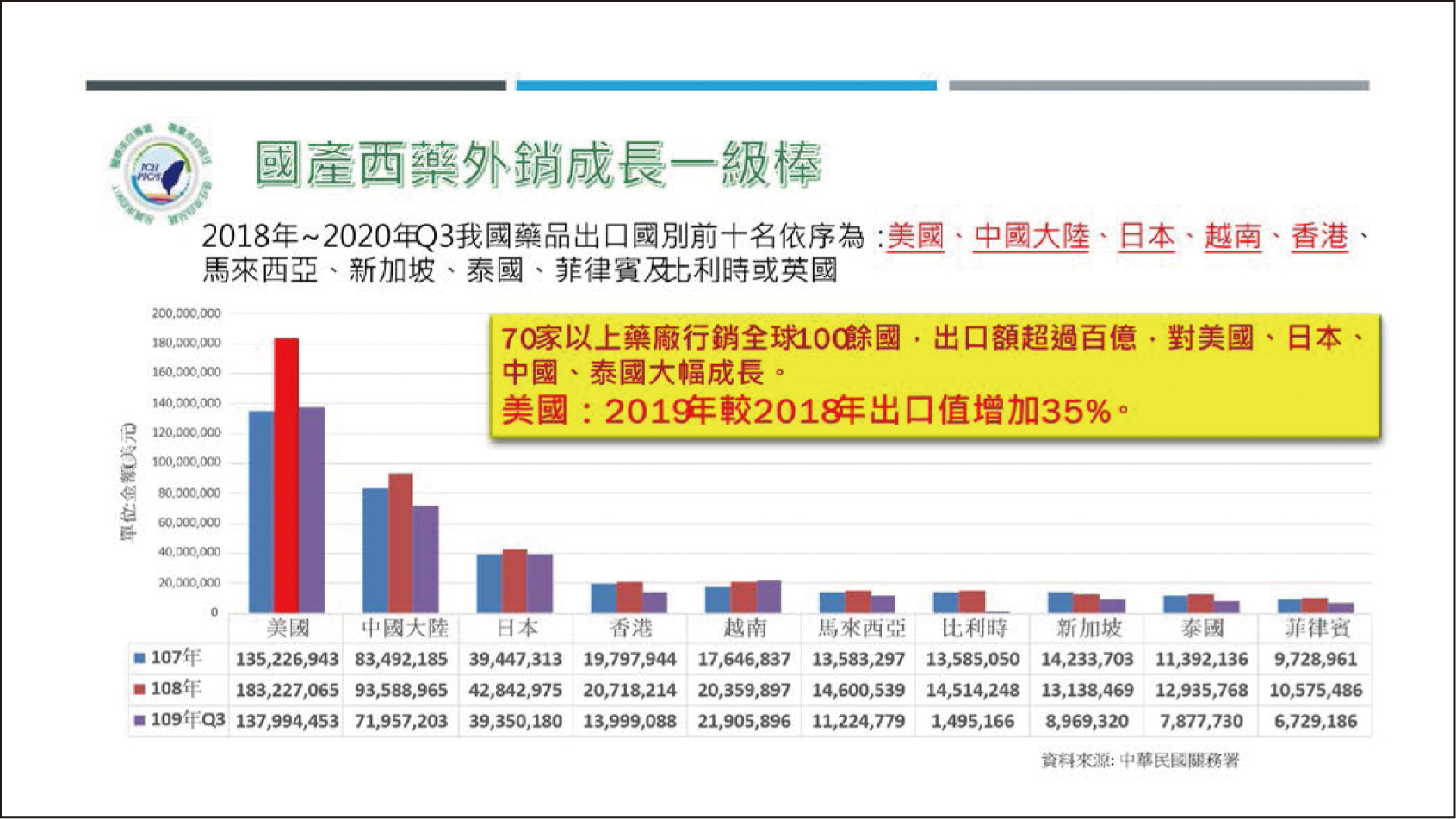
台灣製藥產業包括原料藥、西藥製劑、生物藥品和中藥製劑的生產與銷售4,2019年產值達757.1億元,原料藥為170.2億元;西藥製劑為476.1億元,較2018年成長7.2%。2019年西藥製劑出口金額為98.2億元,較2018年成長16.0%。西藥製劑在外銷上的表現是製藥總值表現的主因,乃因我國製藥品質與先進國家並駕齊驅,獲國際肯定,再加上衛生福利部協助拓展外銷布局,快速審查,藥廠充分展現外銷實績,有70家以上的藥廠,行銷全球100餘國,出口額超過百億,對美國、日本、中國與泰國出口大幅成長,出口美國於2019年(183,227,065美元)較2018年(135,226,947美元)之出口值增加35%(圖一)。2020年我國製藥產業前三季累計產值共新台幣583.7億元,較2019年同期成長6.5%,2020年全年各類產品產值變化以原料藥產值成長較高,西藥製劑及生物藥品仍緩步成長,推估2020年我國製藥產業總產值較2019年成長5.0%,產值約為794.8億元5。2020年武漢肺炎疫情發生且疫情仍全球延燒中,但整體而言製藥產業仍維持穩定。
圖一 2018~2020年國產西藥製劑出口成長
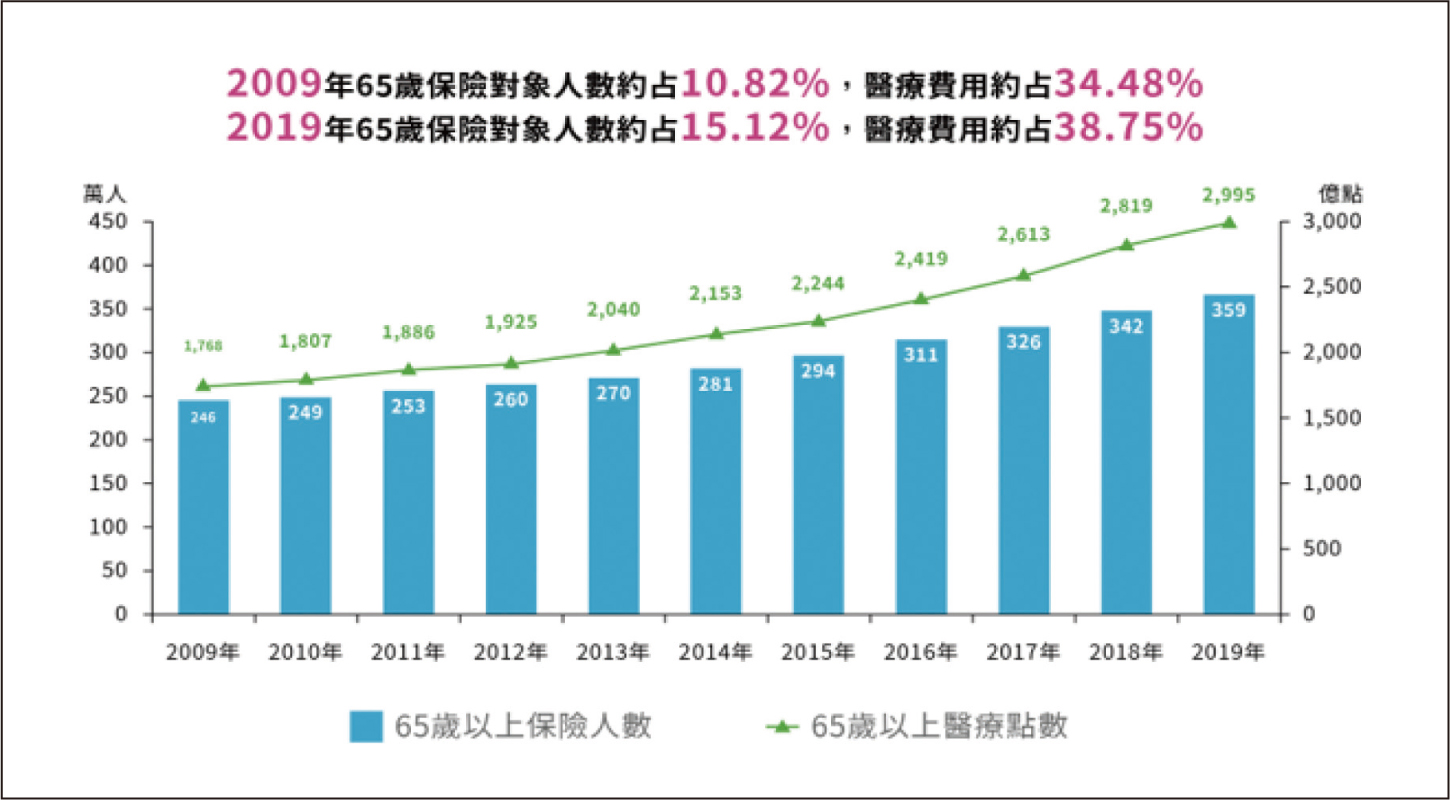
我國人口高齡化加速,醫療費用逐年上升6,2019年65歲保險對象人數約占15.12%,醫療費用約占38.75%,計2,995億(圖二)。而藥費逐年上升,2019年達2,083億,主要成長原因是在65歲以上人口(重大及非重大傷病)過去10年共增加了1187.7億7。健保支出年年增長,健保財務面臨嚴峻的考驗。事實上人口高齡化已是各國面臨的問題,歐、美、日各國均制定使用學名藥政策,以日本為例,2020年學名藥使用率將達80%8,根據「2020年學名藥認知及國產製藥發展現況調查」報告指出:有74%受訪者表示支持「健保署以鼓勵使用國產學名藥,進而節省健保支出,讓醫療資源能更有效利用。」,以目前健保藥費分布來看,2019年健保醫令金額原廠藥占比57%、學名藥43%,在43%學名藥裡面,國產占51%、輸入占49%。但在19,340張學名藥許可證,輸入學名藥卻僅占1,518張(圖三),顯見平價優質國產學名藥對健保財務的重要性。
圖二 2009~2019年醫療費用支出
圖三 國產與輸入學名藥許可證之占比
貳、 臺灣製藥產業的活水與建言9
一、 扎根深耕在地製藥產業、強化學名藥重要性10
(一)推動我國學名藥政策,將使用國產學名藥訂為國家政策,並落實配合獎勵措施之實施方案,在同樣推廣使用學名藥的日本,已規定學名藥須達到80%使用量,健保在診療費或藥事服務費就會給予加成獎勵,既然日本能做到,其經驗實在值得我國參考借鏡。
(二)制定使用國產學名藥比率之短、中、長期價量目標,藉以擴大學名藥替代使用率,降低健保財務負擔及提升國產製藥產值。
(三)建立推行使用國產學名藥完整獎勵機制或配套措施,給予醫師使用藥效相同學名藥之多元選擇。
(四)建立與用藥品質相關議題之溝通平台或推廣網頁,以長期性方式持續推廣國產學名藥。
(五)醫療院所若使用國產學名藥占比或金額成長率達到一定百分比率,可提供醫療院所額外獎勵方案或鼓勵措施。其採行方式,如納入醫策會醫院評鑑項目、公開表揚等,以作為醫院之間另一種競賽方式。
(六)比照日本政府主動宣導民眾對於國產學名藥使用,優先以公立醫院漸進式方式執行。
(七)政府提供經費宣傳臺灣製藥品質已經全面國際化的水準,促進醫療人員及民眾正確認識國產學名藥品。
二、建立合理法規、強化在地製藥產業發展
(一)因人種與地域差異及用藥安全,輸入我國之藥品應比照國際慣例在我國重新執行並通過生體相等性(BE)試驗,不應以國外通過之文件申請我國之查驗登記, 並核以相同之健保給付價。
(二)民眾健康意識抬頭,應建立非處方藥產業政策,推動對自身小小病痛的自我照護(Self-care) 與自我用藥(Self-medication)觀念,提升民眾選用之方便性,降低疾病治療之財務負擔。
(三)有關電子通用技術文件(eCTD, Electronic Common Technical Document)11送件推行期程,建議由食藥署編列預算和軟體公司聯合開發建置eCTD軟硬體,再提供給業界使用,如此也可以減少政府端與廠商端在eCTD軟硬體連結之問題發生。
(四)政府對於進口藥品應比照國內藥廠辦理全面回溯清查,要求進行GMP實地查廠,國內外查廠審查應標準一致化。
(五)對於屬PIC/S GMP會員之外國藥廠,仍應視該國對我國輸出產品之查廠認定方式,以平等互惠原則,採取對等作法。海外查廠比照國內查廠作業方式,建立無預警機動查核機制。
(六)對於非屬PIC/S GMP會員之進口藥品,依照藥事法授權規定,除必須通過我國食品藥物管理署實地查廠,並應於海關進行加強抽批檢驗。
三、 拓展製藥產業國際市場、強化創新價值
(一)主管機關協助掌握各國法規,了解當地藥品法規變化以及發展方向,讓廠商能因應當地醫療市場的需求及發展趨勢,快速調整。
(二)政府除積極讓國內學名藥品上市、增加產品線的互補性外,須積極尋求並善用策略聯盟方式,輔導國內學名藥廠於全球各地建置藥品合作行銷通路。
(三)各國政府為了鼓勵製藥公司研發治療特殊疾病所需要的藥物,在藥品審查制度上應給予該國廠商快速審查機制,以加速其國內廠商藥品上市的時間。
(四)協助廠商在藥品專利到期之後,能迅速推出利基學名藥上市。
四、 對健保藥價之建議
(一)所有具逾專利期成分之藥品,主管機關應秉持平等原則,健保核給之藥價不應再予以保障(現行辦法為再保障15年)。兩者藥價在專利期滿後,應立即採一致藥價(三同藥價),建構學名藥和具逾專利期藥品以同藥價核給之制度。
(二)差額負擔推動應限定於新藥給付,並應依據十大先進國之國民所得參考國際藥價給予一定比例之給付價,再訂定出合理且民眾可承受之差額負擔制度,讓專利新藥得以快速進入國內。對於專利期滿的藥品不應導入差額負擔制度而讓民眾在資訊不對等且毫無配套措施下增加負擔。
(三)中央健康保險署應儘速提出國產學名藥品優先使用政策,以減少藥品費用支出,增進健保財務健全。
(四)考量人種差異及用藥安全,進口學名藥在國內未取得BE證明,藥價應有區隔。
五、對人才培育的建議
(一)因應我國加入PIC/S及ICH組織,藥品查驗登記及GMP製造法規與國際接軌,建議儘速建立在職人員法規人才教育訓練與交流平台。
(二)對醫藥相關科系在學學生向下扎根,提早宣導國產製藥產業發展之現況。
六、對用藥教育的建議
(一)食品藥物管理署及中央健康保險署應投入充沛經費,促進醫療人員及民眾正確認識國產學名藥品。教育各界在全民健保制度下,優先使用更值得信賴的國產學名藥品。
(二)由政府主導並落實建立標準化民眾版仿單機制,且由廠商積極配合辦理,提供民眾清楚及易懂的藥品資訊,正確了解藥物特性,以保障民眾用藥安全。
參、臺灣製藥產業之發展願景
國際間美國、日本及歐盟國家已正視學名藥供給的重要性,尤其疫情期間為確保供藥無虞,我們也應將使用國產學名藥訂為重要政策,鼓勵並制定相關配套措施,穩定藥品供應鏈,為國產製藥產業永續發展奠基,讓生技製藥業有後盾以投入研發與創新,進而更蓬勃發展。
參考資料:
1. 陳志麟:藥事法規採納PIC/S GMP與GDP規範對臺灣製藥品質提升之探討。全國律師2018:5月號。
2. 陳志麟:品質不是你做了什麼..是你管控了什麼…。藥學雜誌2019:第139冊第35卷第2期。
3. 陳志麟:「定位國產製藥品質形象」計畫成果報告。台北:衛生福利部食品藥物管理署,2020。
4. 經濟部工業局:2019生技產業白皮書。台北:經濟部工業局,2019。
5. 經濟部技術處:2019醫藥產業年鑑。台北:經濟部技術處,2020。
6. 國家發展委員會:中華民國人口推估2018至2065年。台北:國家發展委員會,2018。
7. 衛生福利部全民健康保險會:109年度全民健康保險醫療給付費用總額範圍(草案)諮詢健保會意見。https://dep.mohw.gov.tw/NHIC/cp-4039-47572-116.html。
8. 學名藥使用促進事業。譯自日本厚生勞動省:後発医薬品使用促進事業 平成30年度行政事業レビュー公開プロセス資料。日本:厚生勞動省,2019。
9. 臺灣製藥工業同業公會:2020臺灣製藥產業白皮書。台北:臺灣製藥工業同業公會,2020。
10. 陳志麟:日本與臺灣推廣使用學名藥之探討。藥學雜誌2020:第143冊第36卷第2期。
11. 衛生福利部食品藥物管理署:藥品查驗登記電子通用技術文件指引,2020。
The Significance of Taiwan Pharmaceutical Industry
Chih-Lin Chen
Taiwan Pharmaceutical Manufacturer's Association
Western Medicine Business Development Committee
Chairperson
Abstract
In 2020, the COVID-19 pandemic spread all over the world. At the initial stage of the pandemic, besides implementing the Advance Development for preparing ready of various medical and epidemic prevention measures, Taiwan Ministry of Health and Welfare also cooperated with domestic pharmaceutical manufacturers to constitate the National Team to ensure the supply of pharmaceutical alcohol and active pharmaceutical ingredients, assist the R&D of vaccines, and prevent form the shortage of medical supplies. According to the survey, 92.7% of the surveyed Taiwan citizens are confident of the stable medical supplies by domestic pharmaceutical companies, which highlights the significance of the domestic pharmaceutical industry as the military-civil industry. Taiwan Food and Drug Administration, MOHW joined the Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme (PIC/S) in 2013 and the International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) in 2018. Taiwan drug inspection, registration, review, and manufacturing regulations are consistent with international standards and have a stringent post-marketing quality control mechanism. Various monitoring systems have been established, which include the drug safety monitoring network, reporting system for products with defects, and the reporting system for unequal curative effects that allow immediate investigation and solving of any detected abnormalities to ensure medication safety. Many countries such as the United States, Japan, and the members of the European Union have been officially focusing on the importance of the supply of generic drugs. Taiwan shall stipulate and promulgate the key policies for the use of domestic generic drugs, encourage and formulate related supporting measures, stabilize the drug supply chain, and lay the foundation for the sustainable development of the domestic pharmaceutical industry, which would provide support for the biotechnology and pharmaceutical industry in terms of investment in R&D and innovation to achieve better development and growth.
通訊作者:陳志麟/通訊地址:台北市敦化南路2段267號3樓
服務單位:臺灣製藥工業同業公會西藥經營發展委員會/聯絡電話:(O) 02-27365838