HCV DAA藥物於特殊族群患者的治療
洪瑄佑 林慧娟
戴德森醫療財團法人嘉義基督教醫院藥劑部
摘要
衛生福利部中央健康保險署自2017年至今,已開放給付九個全口服直接抗病毒(direct-acting antiviral, DAA) 藥物,依給付順序為daklinza、sunvepra、viekirax、exviera、zepatier、harvoni、sovaldi、maviret、epclusa,分別針對C肝病毒genotype 1a, 1b、genotype 1a, 1b、genotype 1a, 1b, 4、genotype 1a, 1b、genotype 1a, 1b, 4、genotype 1, 4, 5, 6、genotype 1, 2, 3, 4、pan-genotype,本篇論述特殊族群為慢性C型肝炎患者併有懷孕及兒童族群、腎功能不全、肝硬化、肝腎移植、HIV共同感染之患者。
關鍵字: DAA、HCV 、特殊族群、Unique Populations、special populations
壹、前言
C型肝炎病毒(Hepatits C virus, HCV) 主要經由血液經由皮膚或黏膜進入體內而傳染,潛伏期通常為6至9週。急性感染後,約50-80%的病人變成慢性感染,在臺灣C型肝炎病毒(Hepatits C virus, HCV) 感染者約40-70萬人1,HCV感染後發生肝硬化前,有約20到25年的停滯時間,較為嚴重的末期肝病(end stage liver disease, ESLD)和肝癌(hepatocellular carcinom, HCC)可能在初感染後第30到40年發生2。過去調查顯示臺灣C型肝炎盛行率有區域差異,C型肝炎個案多集中在中南部沿海地區、部份原住民社區1。自2011年起,美國食品及藥物管理局(Food and drug administration, FDA)陸續核准新治療藥物機轉-直接抗病毒(direct-acting antiviral, DAA),為全口服劑型,可增加病患服藥順從性,臺灣最新的報告顯示不同基因的組合藥物之持續性病毒反應 (sustained virologic response, SVR) 分別為60-95不等3,慢性C型肝炎患者依HCV基因型選擇適當的藥物治療外,還需考量患者年齡、是否具有其他疾病、透析、移植、治療藥物相互交互作用等,HCV建議DAA藥物皆可用於輕至中度腎功能不全患者及輕度肝功能不全(Child-Pugh A級)患者4,禁用於懷孕或可能懷孕的婦女、女性伴侶已懷孕的男性患者,以及 18歲以下之兒童與青少年,小於18歲患者安全性與療效尚未確立5。
貳、C型肝炎全口服藥物簡介
自2017年起,衛生福利部中央健康保險署陸續開放給付直接抗病毒(direct-acting antiviral, DAA)藥物,於2017年01月24日最先核准給付藥物為Daklinza® (daclatasvir 60mg)、Sunvepra® (asunaprevir 100mg)、Viekirax® (ombitasvir 12.5mg、paritaprevir 75mg、ritonavir 50mg)、Exviera® (dasabuvir 250mg),給付療程治療基因型為HCV genotype 1a、1b型之感染, daklinza和viekirax皆不可單一使用, daklinza需與sunvepra併用、viekirax需與exviera併用, viekirax + exviera與ribavirin (RBV)併用,核淮治療成人慢性C型肝炎genotype 1、4之感染;同年08月後核准的新藥Zepatier® (elbasvir50mg、grazoprevir100mg) 可治療genotype 1a、1b、4之感染,可治療更廣泛的基因型,降低服藥頻次,且吸收不受食物併服影響。
2018年01月01日,給付Harvoni® (ledipasvir 90mg、sofosbuvir 400mg) 治療genotype 1、4、5、6之感染;Sovaldi® (sofosbuvir 400mg) 治療genotype 1、2、3、4型之感染;同年08月01日,健保核准給付Maviret® (glecaprevir 100mg、pibrentasvir 40mg),為第一個治療HCV全基因型藥物,治療療程更縮短至8週,但每次需服藥三粒。
2019年06月01日,最新健保給付藥物Epclusa® (sofosbuvir 400mg、velpatasvir 100mg),與maviret相同為可針對HCV genotype 1、2、3、4、5、或6 (全基因型) 之感染5,DAA藥物中唯有zepatier、harvoni、maviret、epclusa可作為單一藥物治療HCV。
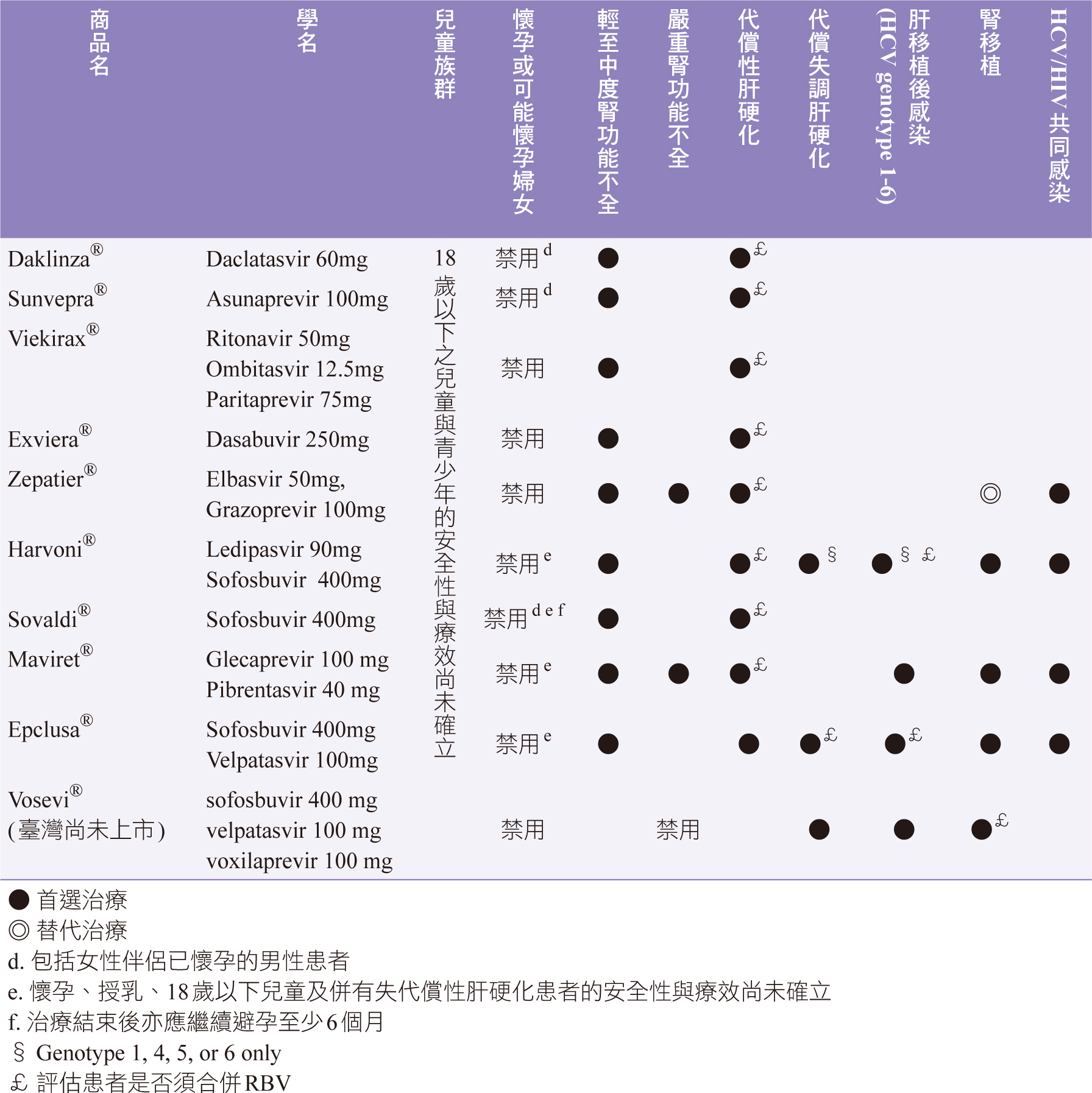
DAAs不建議用於中至重度肝功能不全 (Child-Pugh B與C)及代償失調肝硬化患者,唯獨harvoni、sovaldi和epclusa可用於任何程度肝功能不全(Child-Pugh A、B、C級)且不須調整劑量;DAA藥物於不同程度腎功能不全患者皆不須調整劑量,除sunvepra對重度腎功能不全患者(未血液透析)需調整劑量, harvoni目前尚未針對重度腎功能不全或血液透析治療之末期腎病(ESRD)患者評估安全性與療效,其中daklinza、zepatier和maviret血液透析無法移除(表一) 5。
表一 DAA藥物比較5
參、特殊族群患者藥物使用
一、 腎功能不全患者
血液透析(hemodialysis)具交叉感染風險,可能造成HCV感染,患有慢性HCV血液透析患者與沒有HCV透析患者相比,會增加整體死亡風險,HCV是發展成腎細胞癌(renal cell carcinoma)的危險因素2。2012 年 Kidney Disease:Improving Global Outcome(KDIGO)將慢性腎臟病(Chronic Kidney Disease, CKD)定義:出現腎臟損害或腎絲球過濾率(Glomerular Filtration rate, GFR)<60 (ml/min /1.73m2 )且持續超過三個月以上,分期標準依據 GFR 分成五期:腎功能正常但有腎臟損傷(G1;GFR≧90 ml/min /1.73m2 ) 、輕度慢性慢性腎衰竭但有腎臟損傷(G2;GFR 60-89 ml/min /1.73m2 )、中度慢性腎衰竭(G3a;GFR 45-59 ml/min /1.73m2) 、中度到重度慢性腎衰竭(G3b;GFR 30-44 ml/min /1.73m2)、重度慢性腎衰竭(G4;GFR 15-29 ml/min /1.73m2)、末期腎臟病變(G5;GFR <15 ml/min /1.73m2) 6。
HCV感染合併輕至中度腎功能不全患者,皆可使用美國肝病研究協會(American Association for the Study of Liver Diseases, AASLD) -美國感染症醫學會(Infectious Diseases Society of America, IDSA) HCV建議的DAA藥物治療4,無需劑量調整,除非DAA藥物與其他藥物具交互作用才需調整劑量,該族群與非肝硬化患者藥物選擇相似,只是非肝硬化患者須再評估患者有無需要合併RBV;嚴重腎功能不全的HCV患者(CKD stage 4 or 5,eGFR低於30 mL / min或終末期腎臟病),AASLD-IDSA建議使用zepatier 12週療程(HCV基因型1a,1b或4)和maviret治療8-16週(HCV基因型1-6)4。
二、肝硬化患者
HCV肝硬化病人每年發展為末期肝病或肝癌的風險為2%至7%。肝臟是沉默的器官,肝硬化發病率會隨著感染時間而增加,一旦被診斷為HCV代償性肝硬化者,應優先考慮進行HCV治療。
肝硬化的嚴重程度依Child-Turcotte-Pugh分類為代償性肝硬化和代償失調肝硬化,二者治療方法和目標不盡相同。HCV感染且中度或重度肝功能不全(Child-Pugh B或C級)者,若出現腹水,黃疸,靜脈曲張破裂出血或肝腦病變任一種或多種症狀,則被定義為代償失調肝硬化。相反若輕度肝功能不全(Child-Pugh A級)無出現黃疸,腹水,靜脈曲張出血或肝性腦病等症狀,為代償性肝硬化2。
(一) HCV代償性肝硬化患者
HCV代償性肝硬化治療短期目標是達到SVR,中期目標為降低患者發生肝臟代償失調風險,長期目標為減少HCV發展成HCC和死亡的風險,代償性肝硬化患者藥物選擇與非肝硬化患者相似,差異於評估後考慮是否加上RBV4。
(二) HCV代償失調肝硬化患者
根據AASLD-IDSA指引建議4,HCV代償失調肝硬化患者,應轉介至專科醫生,尤肝移植中心治療為佳,因患者可能包含HCC患者;DAA首選藥物為epclusa或harvoni (僅限HCV基因型1、4、5或6)合併低初始劑量的RBV(600 mg,隨著耐受程度調整劑量)治療12週;若無法使用RBV的情況下,則將DAA治療週期拉長至24週。HCV代償失調肝硬化患者不建議使用Interferon和任何的蛋白酶抑製劑(protease inhibitor) 例如:glecaprevir、grazoprevir、paritaprevir、simeprevir、voxilaprevir。
三、 移植患者
(一) 腎臟移植患者
慢性HCV感染且需腎臟移植患者應盡可能在移植前接受HCV治療。AASLD-IDSA於移植後階段,須考量藥物交互作用,尤其是免疫抑製劑calcineurin inhibitors,cyclosporine 和tacrolimus。
1. 初次和沒有DAA藥物經驗HCV基因1-6型感染具或不具代償性肝硬化的腎移植患者,epclusa、maviret、harvoni (僅限HCV基因型1、4、5或6),皆治療12週;替代藥物zepatier僅限HCV基因型1或4,無NS5A抗藥性多形性病毒株患者使用。
2. 對於曾經使用過DAA藥物治療HCV基因1-6型感染,具或不具代償性肝硬化的腎移植患者患者,AASLD-IDSA建議使用sofosbuvir 400 mg/velpatasvir 100 mg/voxilaprevir 100 mg (Vosevi®) ± RBV治療12週 (vosevi臺灣尚未上市)4。
(二) 肝移植後復發HCV感染患者
若移植前不進行治療,肝移植後容易復發HCV感染,在移植後沒有給予有效抗病毒治療,可能是造成移植失敗主因7。
1. HCV基因型1-6非肝硬化患者,無論是否具治療經驗,建議使用epclusa或harvoni (僅限HCV基因型1、4、5或6)或maviret,治療12週。
2. HCV基因型1-6代償性肝硬化患者,無論是否具治療經驗,可使用harvoni (僅限HCV基因型1、4、5或6)合併低初始劑量RBV(600 mg,隨著耐受程度調整劑量)治療12週、epclusa治療12週、maviret治療12週。
3. HCV基因型1-6代償失調肝硬化患者,無論是否具治療經驗,Epclusa合併低初始劑量的RBV或Harvoni (僅限HCV基因型1、4、5或6)合併低初始劑量的RBV,治療12-24週。
4. 有DAA藥物治療經驗,HCV基因型1-6感染具或不具代償性肝硬化患者,使用vosevi治療12週4。
HCV基因型1-6代償失調肝硬化患者,移植後藥沕治療與移植前差異在於,治療需再合併低初始劑量的RBV,Harvoni治療週數延長12-24週,有DAA藥物治療經驗者,可使用vosevi治療。
(三) DAAs 和 Calcineurin Inhibitors藥物交互作用
DAAs和Calcineurin Inhibitors具複雜且不可預測的藥物交互作用;cyclosporine與grazoprevir和elbasvi併用時,會增加grazoprevir和elbasvir代謝,grazoprevir AUC會上升15倍,elbasvir AUC上升2倍。Grazoprevir與tacrolimus同時使用時,會增加40%-50% tacrolimus 血中濃度,故應監測tacrolimus血中濃度4。
四、 HCV/HIV共同感染患者
C 型肝炎病毒屬於血行性傳染病原(blood-borne pathogens),愛滋病毒(Human immunodeficiency virus, HIV)感染者中,靜脈注射藥成癮者合併感染HCV的盛行率高達90%以上,曾經感染梅毒HIV患者,發生男男間性行為,造成肛門黏膜損傷或性病形成的潰瘍病灶,會增加急性HCV感染的風險1。
隨著HCV DAA藥物的普及,HCV-HIV合併感染者的療效和不良事件發生率與HCV單一感染者相似,治療HCV-HIV合併感染者,AASLD-IDSA建議與一般HCV感染相同:zepatier、maviret、epclusa、harvoni、vosevi,harvoni的8週療程,限於治療HCV基因型1單一感染患者,不能治療HCV-HIV合併感染的HCV基因型1患者4。治療期間須持續關注HCV藥物與HIV抗反轉錄病毒(antiretroviral)藥物可能會發生的交互作用(表二)。
表二 特殊族群使用DAA藥物的選擇4, 5
HCV-HIV感染患者不建議中斷抗反轉錄病毒藥物治療,二者藥物合併使用時,應注意避免藥品產生交互作用,例如:zepatier應避免合併使用cobicistat、efavirenz、etravirine、nevirapine、或任何HIV蛋白酶抑制劑;maviret應避免合併使用atazanavir、efavirenz、etravirine、nevirapine、包含ritonavir抗病毒製劑;epclusa應避免合併使用efavirenz、etravirine、nevirapine;SOF/VEL/VOX應避免合併使用efavirenz、etravirine, nevirapine、atazanavir、lopinavir;含Sofosbuvir治療組合應避免合併使用tipranavir;RBV應避免合併使用didanosine、stavudine、zidovudine4。
肆、結論
本篇綜論特殊族群之DAA使用建議準則(統整如表二),由於安全性與療效尚未確立,DAA藥物仿單皆不建議18歲以下兒童與青少年使用5,其他特殊族群依據AASLD-IDSA指引建議如下:嚴重腎功能不全病人首選藥為zepatier治療12週、maviret治療8至16週;代償失調肝硬化患者首選為epclusa或harvoni合併低初始劑量的RBV,治療12週;若無法使用RBV,則將DAA治療週期延長至24週;初次和沒有DAA藥物經驗HCV基因1-6型感染具或不具代償性肝硬化的腎移植患者,可選用epclusa、maviret、harvoni,治療12週,替代藥物為zepatier;曾經使用過DAA藥物治療HCV感染腎移植患者,建議使用vosevi ± RBV治療12週,但vosevi目前臺灣尚未上市;肝移植後感染HCV基因型1-6患者,可選擇epclusa、harvoni、maviret治療12週,HCV代償性肝硬化肝移植後感染患者,建議使用harvoni合併低初始劑量RBV,HCV代償失調肝硬化肝移植後感染患者,首選epclusa或harvoni合併低初始劑量RBV治療12-24週,曾有DAA藥物治療經驗肝移植後感染者,可選擇vosevi治療12週;HCV/HIV共同感染藥物選擇與一般HCV感染相同,zepatier、maviret、epclusa、harvoni、vosevi,治療期間須緊密切注意DAAs與HIV抗反轉錄病毒發生藥物交互作用4,今年七月臺灣已發表針對特殊族群之指引共識8,執行用藥評估成效時亦可參考。
Direct-acting antiviral agent treatment unique populations of hepatitis c virus
Hsuan-Yu Hung, Hui-Chuan Lin
Department of Pharmacy, Ditmanson Medical
Foundation Chi-Yi Christian Hospital
Abstract
Since January 2017, National Health Insurance Administration MOHW approved the new therapeutic oral medication direct-acting antiviral (DAA): daklinza, sunvepra, viekirax, exviera, zepatier, harvoni, sovaldi, maviret and epclusa. Major genotypes of the HCV focused on genotype 1a,1b, genotype 1a,1b, genotype 1a,1b,4, genotype 1a,1b, genotype 1a,1b,4, genotype 1,4,5,6, genotype 1,2,3,4, even to pan-genotype. Current article summarizes the updated guidance for management of patients with HCV in special populations including pregnancy and pediatrics, renal impairment, cirrhosis, liver and renal transplantation, HIV coinfection patients.
參考資料:
1. 衛生福利部疾病管制署 2016:傳染病防治工作手冊。
2. Lingala S, Ghany MG. Natural History of Hepatitis C. Gastroenterol Clin North Am. 2015;44:717-34.
3. YuML, ChenPJ, DaiCY: 2020 Taiwan consensus statement on the management of hepatitis C: part (I) general population. J Formos Med Assoc. 2020;119(6):1019–1040. doi:10.1016/j.jfma.2020.04.003
4. AASLD-IDSA HCV Guidance : Management of Unique & Key Populations With HCV Infection. 取自https://www.hcvguidelines.org/unique-populations. 引見於 三月22, 2020.
5. 衛生福利部中央健康保險署:健保用藥品項查詢.。取自http://www.nhi.gov.tw/QueryN/Query1.aspx.
6. 財團法人國家衛生研究院 2015:台灣慢性腎臟病治療指引。
7. Lorna M Dove, MD, MPHRobert S Brown: Hepatitis C virus infection in liver transplant candidates and recipients. UpToDate. Available from: https://www.uptodate.com (Accessed on Aug 03, 2020)
8. YuML, ChenPJ, DaiCY: 2020 Taiwan consensus statement on the management of hepatitis C: Part (II) special populations. J Formos Med Assoc. 2020;119(7):1135–1157. doi:10.1016/j.jfma.2020.04.002
通訊作者:洪瑄佑/通訊地址:嘉義市東區忠孝路539號(嘉義基督教醫院藥劑科)
服務單位:戴德森醫療財團法人嘉義基督教醫院藥劑部/聯絡電話:(O) 05-2765041 ext
2135