三陰性乳癌新治療藥物:atezolizumab
洪永潤、項怡平
義大醫療財團法人義大醫院藥劑部
摘要
三陰性乳癌占整體乳癌的比例15~20%。三陰性乳癌的疾病進展具高度的侵略性,若轉移中樞神經,將會對於化療的反應相當有限。轉移後的三陰性乳癌病人的存活中位數約為15個月,由於TNBC對各類的荷爾蒙類和抗HER2標靶藥物治療較不具顯著的治療效果,因此過去數十年只能一直停留在使用傳統化學治療控制疾病,在治療上相當棘手。
近幾年,免疫檢查點抑制劑(immune checkpoint inhibitors, ICPi)突破了黑色素細胞癌的治療困境後,陸續在肺腺癌、腎細胞癌等癌別的治療上取得顯著進展,在三陰性乳癌的治療上也備受期待。
2019年,第三期臨床試驗IMpassion130的研究結果證實,針對細胞程式死亡配體蛋白-1表現≥1%的晚期三陰性乳癌族群使用atezolizumab合併化學治療與一般化療相比較,中位存活期可達25個月,顯著延長7個月,讓三陰性乳癌的治療出現了第一道曙光。
關鍵字: 三陰性乳癌、免疫檢查點抑制劑、atezolizumab
壹、 前言
一、三陰性乳癌簡介
乳癌是女性癌症中最常見的癌症類型,是導致女性癌症死亡的主因1。台灣每年約有12,000名新診斷的乳癌患者,其中三陰性乳癌(Triple negative breast cancer, TNBC)約佔15%2。TNBC代表腫瘤上的雌激素受體(estrogen receptor, ER)、黃體素受體(progesterone receptor, PR)及第二型人類上皮生長受體(human epidermal growth factor receptor 2, HER2)等受體皆呈現陰性。常因疾病進程快,診斷時已發生遠端轉移;早期的TNBC也有三成病人會在手術後二到三年內復發,相較其他類型的乳癌病人有著較差的預後3。由於TNBC無明確的生物標記(biomarker)作為治療的依據,治療上無相對有效的標靶藥物治療,相較於其他亞型的乳癌通常只能選擇化學治療,臨床上有其迫切的醫療需求4。
乳癌轉移最常見的部位包括骨、腦、肝和肺,其相關的臨床症狀列於下表一。除此之外,轉移性乳癌還有發生其他的非特異性全身症狀,包括疲勞、體重減輕和食慾不振、睡眠不安、情緒困擾和嗜睡等等5。
表一 乳癌轉移於不同部位的臨床症狀5
二、三陰性乳癌治療方式
目前三陰性乳癌的治療大多以化學治療(如anthracyclines、taxanes)或有無合併放射線治療來進行疾病的控制6,一旦化學治療產生抗藥性後,易造成生命威脅。進展或轉移性三陰性乳癌在第一線化學治療開始治療不到一年的時間內,大多患者會出現治療失敗,中位存活年通常限於2~3年。在化學治療上,一旦患者接受過anthracycline和任一種taxane治療失敗後,eribulin、capecitabine或vinorelbine便會被建議作為一線化療失敗後接續使用的化學治療藥物。
三、三陰性乳癌與免疫治療
近年來,從乳癌的組織研究中發現:三陰性乳癌有較多浸潤腫瘤的淋巴球、較高的突變負擔與腫瘤抗原表現,及較高的細胞程式死亡配體蛋白-1 (Programmed death-ligand protein-1, PD-L1)表現,這些特徵顯示三陰型乳癌更容易從免疫治療中獲得治療效益 (Treatment benefit)。
貳、癌症免疫循環與治療機轉
一、癌症免疫循環(cancer-immunity cycle)
人體內的抗癌免疫反應若要產生對癌細胞有效的毒殺作用,必須啟動一連串的作用,如圖一8。首先,癌細胞釋放出抗原(cancer cell antigens)(步驟1),而抗原呈現細胞樹突狀細胞(dendritic cell)會呈現癌細胞的特徵(步驟2),同時活化T細胞(步驟3)。被活化的T cell經由血液系統能特異性地轉移(traffic)(步驟4)並浸潤(infiltrate)到腫瘤組織(步驟5),進而在腫瘤微環境(Tumor microenvironment)中,辨識癌細胞(步驟6)後,啟動細胞毒殺作用(步驟7),達消滅腫瘤的目的。這被稱為癌症-免疫循環(cancer-immunity cycle)七步驟,使人體免疫系統在正常的情況下能有效地殺死癌細胞。
圖一 癌症免疫循環七步驟8
二、免疫治療機轉
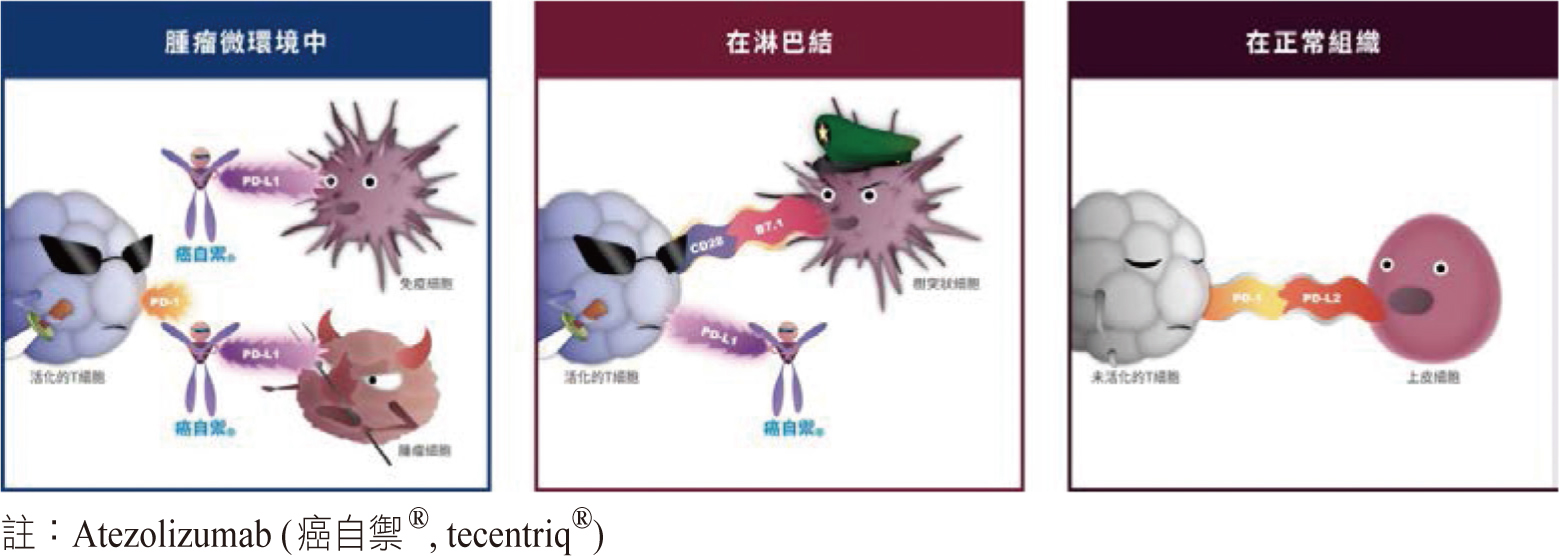
當人體內的抗癌免疫反應啟動時,癌細胞會藉由免疫逃脫(immune escape)來避免自然的免疫攻擊,導致癌症的發生。免疫逃脫其中之一便是癌細胞藉由自身發展出的PD-L1與T細胞表面的PD-1受器結合,開啟T細胞的煞車系統,讓T細胞失去活性來避免免疫系統的攻擊而存活下來8。
免疫檢查點抑制劑(immune checkpoint inhibitor, ICPi)則是藉由與PD-1或PD-L1結合的特性,重啟T細胞原本的活性來進行細胞毒殺作用。目前,已上市的PD-1抑制劑有nivolumab和pembrolizumab,PD-L1抑制劑則有atezolizumab、avelumab和durvalumab9,其中,atezolizumab (Tecentriq®)是目前台灣唯一核准用於晚期三陰性乳癌一線治療的免疫療法。
參、三陰性乳癌的治療新選擇
如前所述,在三陰性乳癌的組織研究中被證實,其腫瘤組織相較於其他的乳癌亞型具有較多的浸潤腫瘤淋巴球(TILs)、突變負擔(tumor mutation burden)、腫瘤抗原及較高的PD-L1表現,以至於比較有機會於免疫療法中產生效用。
2019年3月,美國FDA核准了第一個用於治療三陰性乳癌的免疫檢查點抑制劑──atezolizumab,台灣FDA也在同年9月核准atezolizumab (Tecentriq®,癌自癒®)與nab-paclitaxel併用,適用於PD-L1表現(tumor-infiltrating immune cells ≥1%, IC≥1%)無法切除之局部晚期或轉移性三陰性乳癌的第一線治療10。
一、atezolizumab的作用機轉
atezolizumab是一個 anti-PD-L1的抗體,主要藉由活化T細胞功能來殺死癌細胞。它可以通過阻斷腫瘤細胞(TC)及/或浸潤腫瘤淋巴球(TILs)上的PD-L1,恢復腫瘤微環境中的抗腫瘤免疫反應,也可以藉由結合PD-L1使樹突細胞上的B7.1和T細胞上的CD28結合,進一步活化T細胞(圖二)。除此之外,不會抑制PD-1與PD-L2結合,減少影響正常組織中的免疫平衡而導致免疫相關副作用的產生11。
圖二 免疫檢查點抑制劑作用機轉
二、IMpassion130 trial
在三陰性乳癌的免疫治療研究IMpassion130中11,收錄了902位未曾接受轉移性乳癌化療的轉移性三陰性乳癌病人,以1:1的方式隨機分成atezolizumab或安慰劑合併nab-paclitaxel的實驗與對照組,以每兩週給予atezolizumab或palcebo並搭配連續三週休息一週的化學治療進行治療,直到病人在影像學上被判定疾病惡化,或出現無法接受的毒性為止。
在IMpassion130中,病人年齡中位數為55歲,有六成為女性白人,亞洲人占全體的18% 左右,使用VENTANA PD-L1 (SP142)分析法偵測腫瘤浸潤免疫細胞(Immune Cells, IC) PD-L1的表現,作為隨機分配的因子及次族群的定義(PD-L1 IC≥1% subgroup)。主要評估的共同研究終點(co-primary end point)為意向治療族群(intention-to-treat, ITT)、PD-L1表現族群之疾病無惡化存活期(progression free survival, PFS),及整體存活期(overall survival, OS)。
研究結果顯示,ITT族群中atezolizumab與化療的合併療法的試驗組相較於化學治療的對照組可顯著延長mPFS約2個月(mPFS7.2 vs. 5.5, HR 0.80, 95% CI: 0.69, 0.92);而在PD-L1≥1%的族群可見更明顯的差異(mPFS 7.5 vs. 5, HR 0.62, 95% CI: 0.49, 078)。就整體存活率(mOS)的評估,期中分析的結果顯示,ITT族群中兩組之間尚未達到顯著差異,但在PD-L1≥1%的族群,免疫化療合併療法相較於一般化學治療整體存活中位數(mOS)增加了7個月之多(mOS 25 vs. 18, HR 0.71, 95% Cl: 0.54, 0.93)。此外,在IMpassion 130的次級研究中,PD-L1表現≥1%的病人,將近59%對於免疫化療合併療法的治療達到部分反應 (partial response, PR)或完全反應(complete response, CR)。其中CR的比例高達10.3%,是一般化療(1%)的10倍11。
安全性部分,免疫合併化學治療相較於單用化學治療,兩組之間發生副作用的比例相差不多,合併atezolizumab的組別在部分發生嚴重副作用(serious adverse event, SAE)雖顯略高,但都是可以控制的狀況。治療過程中免疫相關的不良反應(immune-related adverse events, irAEs),免疫合併化療組發現甲狀腺相關以及皮疹(rash)的副作用,但程度上依照常見不良事件評價標準CTCAE中第三與第四級(Grade3/4)的嚴重副作用比例與一般化療組之間並沒有太大差別。除此之外,所有等級肺炎的發生率大約3%,而Grade 3/4的肺炎發生比例不到1%11。
肆、伴隨式診斷與精準醫療
IMpassion130的研究結果告訴我們,PD-L1的表現對於使用atezolizumab治療晚期三陰性乳癌效果的評估,能成為一個明確的生物標記。在免疫治療的年代,精準的生物標記可使癌症免疫藥品發揮在最有效的族群,而伴隨式診斷(Companion Diagnostics)的應用可望實現精準醫療的目標。
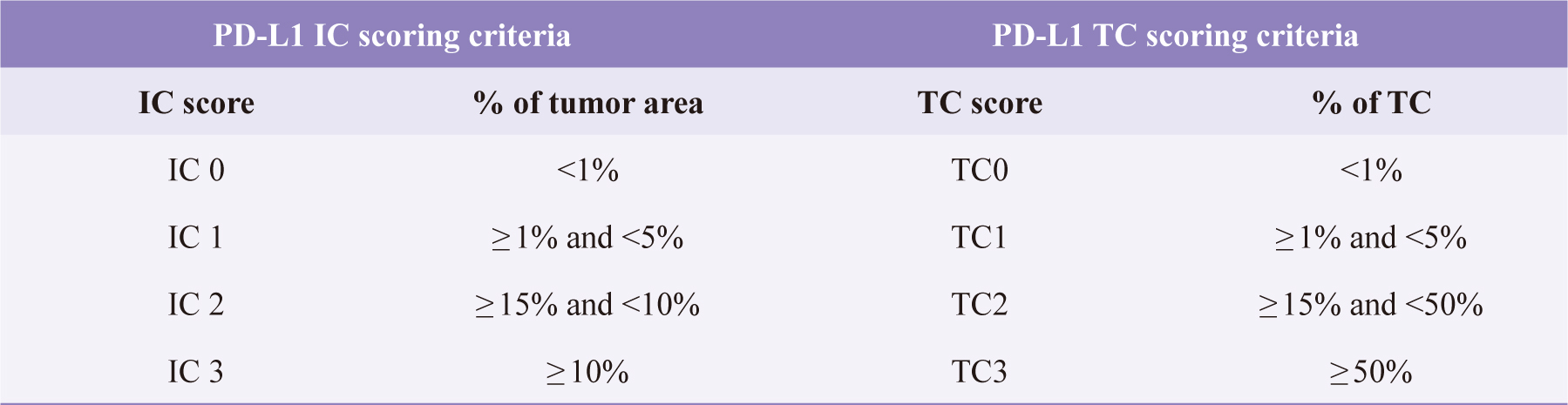
研究中的伴隨式檢測VENTANA PD-L1 (SP142)使用PD-L1的單株抗體(SP142)的定量免疫組化檢測,運用抗體染色原理,檢測出PD-L1表現於腫瘤浸潤免疫細胞(tumor-infiltrating immune cells, IC)佔腫瘤面積的比例,以(% IC)表示其强度(intensity);而PD-L1表現在腫瘤細胞(tumor cells, TC)的比例則以(% TC)表示,依各自表現面積比例不同給予對應的評分。在IMpassion130使用SP142作為PD-L1檢測的評分,如表二12。
表二 VENTANA PD-L1 (SP142)在IMpassion 130檢測的評分表12
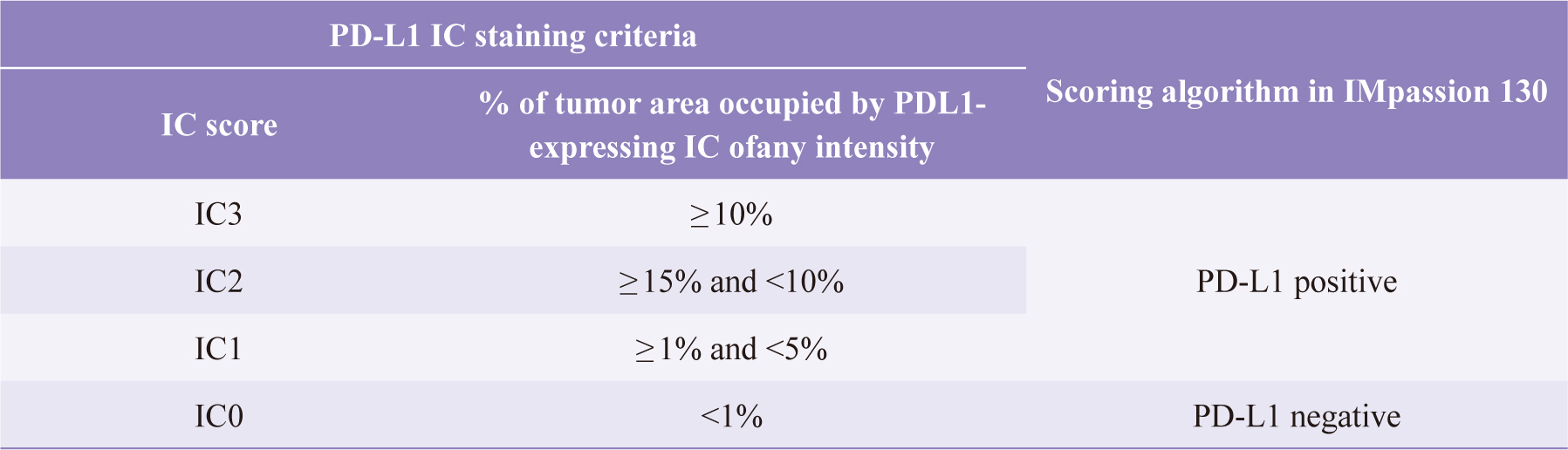
由於在三陰性乳癌,絕大部分的PD-L1都表現在IC上,鮮少部分表現在腫瘤細胞中,有97%的表現與IC重疊。在IMpassion
130以PD-L1 IC的表現強度(≥1%),分為 PD-L1 positive和PD-L1
negative評分標準,如表三11。
表三 VENTANA PD-L1 (SP142)在三陰性乳癌使用的評分標準11
在IMpassion 130中,41%病人為PD-L1 ≥1% IC,9%是PD-L1 ≥1% TC,其中只有2%的病人單純只有PD-L1 ≥1% TC11。綜觀整個研究效果,atezolizumab與nab-paclitaxel合併療法無論在ITT或PD-L1≥1%的族群,皆可顯著延長PFS。尤在PD-L1 ≥1%的族群更可見明顯的差異。在整體存活期的表現上,PD-L1≥1% IC族群病人加上atezolizumab的治療整體存活期,則顯著增加7個月。由此結果更加奠定PD-L1 IC為一明確的生物標記,可用於預測病人接受治療組合的療效,協助醫護人員找出最適合使用的族群。
伍、結論
atezolizumab的問世對於三陰性乳癌的治療是一大突破。在IMpassion 130的研究中,atezolizumab合併nab-paclitaxel對於晚期三陰性乳癌的一線治療,不論是在ITT或PD-L1呈陽性的族群,相較於一般化療的病人,其無病存活期的中位數都達到顯著差異,為晚期三陰性乳癌的治療帶來突破性的發展。IMpassion 130同時證實了PD-L1 IC的表現是一個準確的生物標記,可以透過伴隨式診斷SP142 assay來評估PD-L1 IC的表現,進一步精準預測病人藥物的療效。除了晚期三陰性乳癌,目前已有研究顯示,原發腫瘤(primary tumor)比轉移性的部位更具immunogenic,所以臨床上也有許多三陰性乳癌的前輔助性(neoadjuvant)和輔助性(adjuvant)的免疫治療的試驗正在進行13,期許能為三陰性乳癌的治療提供突破性的進展,造福更多三陰性乳癌的病人。
New Treatment for Triple-negative Breast Cancer: Atezolizumab
Yi-Ping Hsiang, Yung-Jun Hung
Department of Pharmacy, E-Da Hospital
Abstract
Triple negative breast cancers (TNBCs) are defined as tumors that are negative for estrogen, progesterone and HER-2 receptor. Due to the absence of targeted cancer therapy, treatment of TNBC mainly depends on chemotherapy. At a percentage of 15% TNBCs represent a minority in all subtypes of breast cancer, but the poorest prognosis among all subtype. Given the aggressive nature and high risk of distant recurrence, chemotherapy is warranted in most patients except when brain metastases occur. TNBC experiencing the shortest median survival 15 months as compared with other subtypes of breast cancer, unmet needs remain in TNBC treatment. Over the last years, immunotherapy has been one of the most promising, especially immune checkpoint inhibitors (ICPi) which were explored in treating a number of different cancers. atezolizumab, the first PD-L1 inhibitor received Taiwan FDA approval as treatment of advanced TNBC whose tumors express PD-L1, in combination with nab-paclitaxel. In patients whose tumors express PD-L1≥1%, the median overall survival of atezolizumab+nab-paclitaxel patients was 25 months compared with 18 months for those who received nab-paclitaxel only. This novel treatment definitely gives TNBC patients new hope.
參考資料:
1. Shi, Y., Jin, J., Ji, W. et al. Therapeutic landscape in mutational triple negative breast cancer. Mol Cancer 2018; 17:99.
2. 行政院衛生署:臺灣地區癌症登記調查報告。臺北:衛生署,2019。
3. American Cancer Society website. https://www.cancer.org/research/cancer-facts-statistics/breast-cancer-facts-figures.html. Accessed May 20, 2019.
4. National Breast Cancer Foundation. Metastatic Breast Cancer. http://www.nationalbreastcancer.org/metastatic-breast-cancer. Accessed May 20, 2019.
5. Andre F, Neven P, Marinsek N, et al. Disease management patterns for postmenopausal women in Europe with hormone-receptor-positive, human epidermal growth factor receptor-2 negative advanced breast cancer. Curr Med Res Opin. 2014;30(6):1007-1016.
6. Jerusalem G, Rorive A, Collignon J. Chemotherapy options for patients suffering from heavily pretreated metastatic breast cancer. Future Oncol. 2015;11(12):1775-1789.
7. National Comprehensive Cancer Network (NCCN).
8. Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013;39(1):1-10.
9. Rotte A, Jin JY, Lemaire V. Mechanistic overview of immune checkpoints to support the rational design of their combinations in cancer immunotherapy. Ann Oncol. 2018;29(1):71-83.
10. Breast Cancer - NCCN Guidelines (Version 4) 2020. Accessed May 20, 2019.
11. Basile D, Pelizzari G, Vitale MG, et al. atezolizumab for the treatment of breast cancer. Expert Opin Biol Ther. 2018;18(5):595-603.
12. O'Sullivan H, Collins D, O'Reilly S. atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2019;380(10):986.
13. Emens, et al. SABCS 2018 (Abstract GS1-04)
14. Marra A, Viale G, Curigliano G. Recent advances in triple negative breast cancer: the immunotherapy era. BMC Med. 2019;17(1):90.
通訊作者:洪永潤/通訊地址:高雄市鼓山區麗興里捷興二街31號
服務單位:義大醫療財團法人義大醫院藥劑部/聯絡電話:(O) 07-6150011 ext
6219