直接口服抗凝血劑於心房顫動使用評估
方喬玲
台北市立聯合醫院和平婦幼院區藥劑科
摘要
目的:直接口服抗凝血劑(direct oral anticoagulants, DOACs)實際使用於亞洲族群的研究資料有限,因此擬評估本院DOACs處方型態與使用安全性。
方法:採回溯性世代研究調查本院2013年1月~2016年12月間,初次處方任一種DOACs的非瓣膜性心房顫動的病人,追蹤至2017年12月31日止。評估病人處方直接口服抗凝血藥品劑量的適當性、藥品併用、停換藥原因、出血事件發生率與比較rivaroxaban與dabigatran安全性上的差異。
結果:共收納171位非瓣膜性心房顫動的病人。dabigatran、rivaroxaban處方適當劑量過低的比率13.1%、93.1%。dabigatran使用者中有2.3%併用Dronedarone,交互作用等級為「嚴重」。最常導致停換藥的副作用原因是出血事件的發生。在重大出血方面,dabigatran、rivaroxaban累積發生率為2.78%/year、0.94%/year;dabigatran與rivaroxaban兩組比較重大出血的風險未達顯著差異 (HR, 3.062; 95% CI, 0.24-38.74; p=0.388)。
結論:本研究不適當劑量的比率與過去以亞洲族群為研究對象的結果相似。dabigatran與rivaroxaban在重大出血風險無顯著差異,次要出血以皮下出血與血尿為主。未來應加強民眾對交互作用及出血副作用的認知,提醒民眾規律服藥的重要與即時提供嚴重交互作用等級的訊息予醫師參考。
關鍵字: 直接口服抗凝血劑、安全性、出血、direct oral anticoagulants、safety、bleeding
壹、前言
心房顫動(atrial fibrillation, AF)是臨床上最常見的心律不整,在台灣盛行率約百分之11。心房顫動會增加缺血性中風(ischemic stroke, IS)與全身性栓塞(systemic embolism, SE), 傳統的維他命K拮抗劑能預防AF病人發生IS與SE,但會增加出血風險2。台灣或亞洲健保資料庫顯示,直接口服抗凝血劑(direct oral anticoagulants, DOACs),不管在缺血性中風的預防、重大出血發生,或是顱內出血比例,都明顯優於warfarin3。目前大型隨機對照試驗研究皆是DOACs與warfarin相比較,較少DOACs之間直接比較,本文旨在探討本院DOACs的處方型態、出血事件發生率與比較個別藥物使用後的安全性是否存在差異。
貳、方法
一、 納入標準
以回溯世代研究方式調查2013年1月~2016年12月曾於某區域醫院首次處方任一種DOACs、年滿20歲且診斷碼為心房顫動的病人,前半年至少有一次住院紀錄或兩次門診紀錄。指標日期為研究區間內第一次處方DOACs的日期;且於指標日期後90天內回診處方至少一次,觀察至個案停藥、換藥、失去追蹤、任何原因死亡或至研究終止日。Dabigatran 110mg、rivaroxaben 15mg於本院區醫令系統中開檔使用日期依序為2013年1月、2014年9月,研究終止日設定為2017年12月31日。研究獲本院人體試驗委員會核准(TCHIRB-10709105-E)。
二、 排除標準
排除過去曾有嚴重瓣膜疾病、接受人工心臟瓣膜置換病史、深層靜脈栓塞、肺栓塞、指標日期前半年曾使用任一種DOACs藥物。
三、 統計方法
連續變相以平均值±標準差表示、類別變相以個數及百分比統計,分別以two sample t test、chi-squared test分析組間差異。事件發生率以人年(Incidence and Person-Year)表示。cox-proportional harzard model計算rivaroxaben組與dabigatran組間變相與出血事件之風險比值。
四、 評估指標
(一) 分析本院心房顫動病人使用NOACs期間出血事件發生率。
(二) 比較Rivaroxaban、Dabigatran兩組病人出血風險,做為未來處方藥品的參考。
(三) 分析研究終止日前導致停換藥的不良反應型態、評估使用劑量與潛在交互作用。
五、定義出血事件
於DOACs使用期間發生之出血事件,以病歷記載為準。重大出血指致命性出血、關鍵部位或器官出血。次要出血指重大出血之外的出血事件。
六、預防非瓣膜性心房顫動發生中風與全身性栓塞之建議劑量3,如表一。
表一 預防非辦膜性心房顫動發生中風之建議劑量3
參、結果
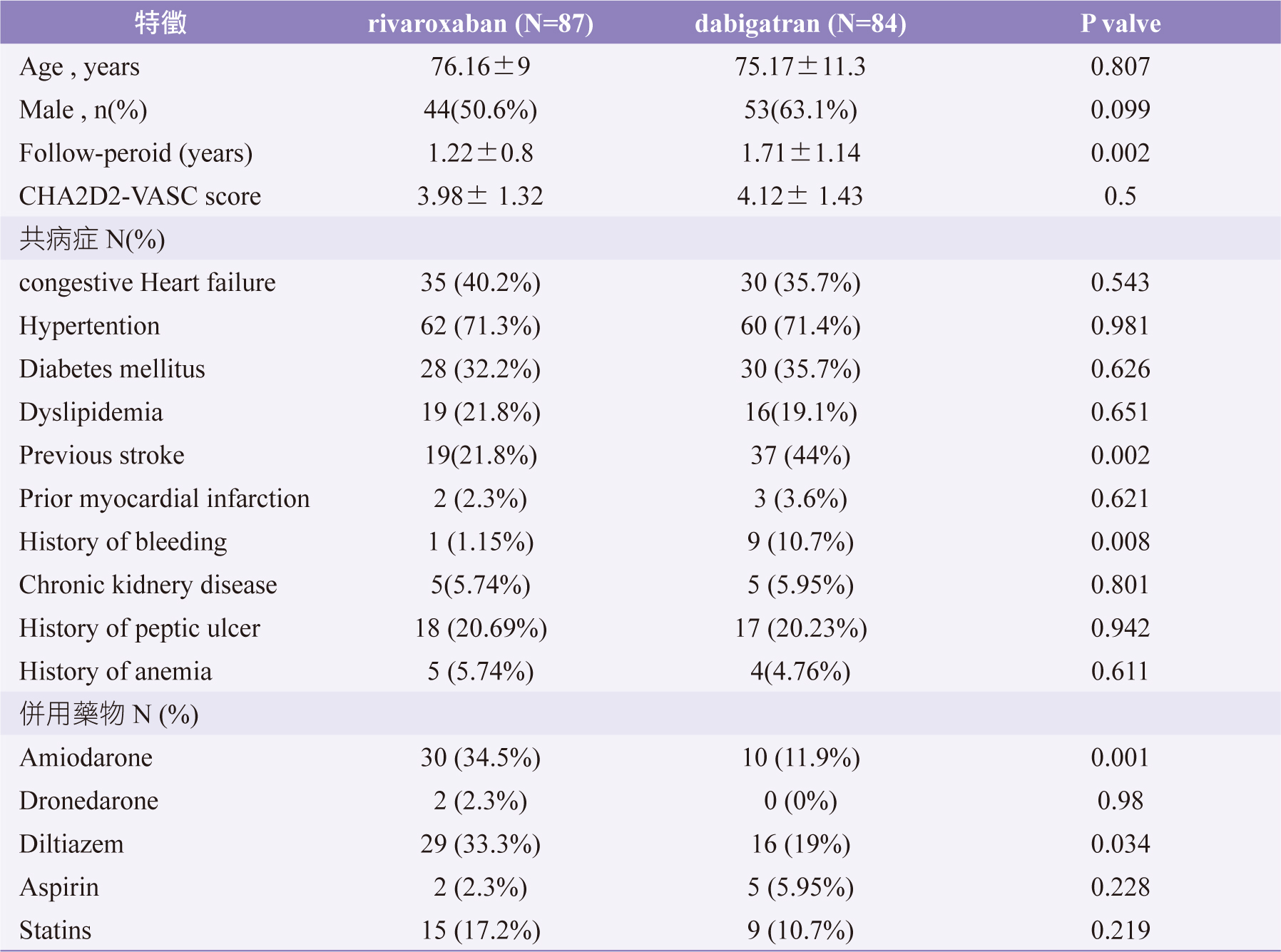
本院自2013年1月1日~2016年12月31日間共有84人、87人初次處方dabigatran、rivaroxaban,平均用藥天數為1.71、1.22年,二組病人在用藥天數呈顯著差異(p=0.002)。在共病症方面,dabigatran、rivaroxaban兩組病人在中風病史(p=0.002)、出血病史 (p=0.008)呈顯著差異,如表一。指標日期後併用amiodarone,組間呈顯著差異(p=0.001)。在預測心房顫動病患中風機率,依風險等級分為高中低,男性高風險(≥ 2分)共90人(92.8%)、女性高風險(≥3分)者共65人(87.8%),二組病人CHA2D2-VASC分數未達顯著差異(p=0.5),如表二。用藥前半年內未檢驗estimated glomerular filtration rate (eGFR)者共22人(12.9%)、未檢驗alanine aminotransferase (ALT)者共49 人(28.7%)。開始用藥半年內,非因副作用停藥的病人共27人(15.7%),一年內非因副作用停藥的病人共45人(26.3%)。
表二 病人基本資料
參照歐洲心臟節律學會指引評估每日用藥劑量4,dabigatran使用低於建議劑量共11人(13.1%)、rivaroxaban使用低於建議劑量者共81人(93.1%)。分析潛在藥物交互作用情形4,併用會「顯著增加血中濃度,不建議使用」者,rivaroxaban併用dronedarone共2人(2.3%)。併用「會增加血中濃度;有≥2種會影響藥物血中濃度的危險因子,應減少藥物劑量或換藥治療」者,dabigatran、rivaroxaban併用amiodarone分別為10人(11.9%)、30人(34.5%)。
於研究終止日前因不良反應發生而停換藥的原因以發生重大與次要出血事件最常見,其中以皮膚瘀斑與血尿表現為主,其次是腸胃道副作用,腸胃道副作用以dabigatran發生率最高, 如表三。
研究區間內dabigatran,rivaroxaban分別發生4、1件重大出血事件,累計發生率 (cumulative incidence)為2.78%/year、0.94%/year。次要出血發生5、7件,累計發生率為3.48%/year、6.58%/year。因dabigatran與rivaroxaban兩組病人數相近且皆使用低劑量,以cox比例風險模式校正病史、併用amiodarone、Diltiazem等變相,dabigatran相對於rivaroxaban在重大出血風險未達顯著差異(HR, 3.062; 95% CI, 0.24-38.74; p=0.388),如表三。
表三 導致中斷治療的不良反應類型
肆、討論
依照過去文獻顯示4,處方dabigatran、rivaroxaban劑量如表一。處方DOACs須依照病人年齡、體重、腎功能、併用藥品來調整劑量使用,分析本研究中初始劑量未依照仿單或準則的情形,dabigatan、rivaroxaban組有13.1%、93.1%處方低於建議劑量。
Joana Santos發表系統性綜論顯示5,有25~50%病人未依照準則處方DOACs,過量使用與全因死亡率增加及惡化出血事件有關,劑量不足會增加心血管事件住院率。多篇研究顯示6,使用DOACs的亞洲人約50~90%處方低劑量。meta-analysis研究指出7,亞洲人使用dabigatran與rivaroxaban標準劑量於降低IS與SE,顯著優於非亞洲人,低劑量用於預防中風、全身性栓塞、缺血性中風、效果與warfarin相似且於族群上無差異。
本研究結果證實處方不適當劑量的比率與過去研究相似,以低於建議劑量為主因,使用低於建議劑量的原因推測為dabigatran (150mg/tab)與rivaroxaban (10mg/tab)於本院開檔日超過研究區間及過去文獻使用低劑量在安全性與效果不劣於warfarin有關。本研究以CHA2DS2-VASc分數預測心房顫動病人的中風風險,二組病人在分數無顯著差異,歐美治療指引評估中風與全身性栓塞事件3,若男性CHA2DS2VASc score ≥2分,女性≥3分,視為高風險;應使用抗凝血劑,本研究中的病人約90%屬於高風險族群;台灣健保資料庫研究CHA2DS2VASc分數0、1分的年中風率可達1.1%、2.7%,較西方國家高,因此2019年台灣腦中風學會對於AF中風預防藥物的選擇建議須更積極慎重考慮,符合本院病人CHA2DS2VASc分數屬低風險時,醫師處方NOACs藥物的原因。
在藥物交互作用方面,根據文獻顯示4,dabigatran併用amiodarone血中濃度上升約12~60%、rivaroxaban併用amiodarone對血中濃度影響輕微,當病人有≥2種預計會影響DOACs血中濃度的危險因子且併用上述藥品時建議減低劑量使用,因本研究中dabigatran與rivaroxaban使用者皆以低劑量治療,因此劑量上無須調整,但未來應對病人加強衛教,提醒病人注意出血不良反應形態與處置方式。
Dabigatran為P-醣蛋白(P-gp)的受質,與P-醣蛋白抑制劑dronedarone併用時相較於單獨使用會導致dabigatan於體內最高血中濃度(Cmax)與曲線下面積(AUC)上升2倍以上,藥物交互作用等級屬於major,因此不建議併用8。本研究中dabigatran使用者中有2.3%併用dronedarone;因會增加出血風險,臨床上應盡量避免併用,特別是腎功能不佳與年長者須特別小心。
26%的病人於開始處方後一年內非因副作用發生而停藥,原因包括病人拒絕使用、失去追蹤、醫師停止處方等。而最常導致停換藥的副作用是出血事件的發生,對AF病人來說,規律服藥可降低中風風險,未來可著重衛教民眾對出血副作用的認知以及長期規律服藥的重要性。
在重大出血(major bleeding)方面,以warfarin作為對照組,RE-LY試驗次群組中,亞洲族群使用dabigatran 110mg發生率2.22%/year9、J-ROCKET試驗rivaroxaban發生率為3%/year10。2018年Chen等人以台灣健保資料庫研究指出,重大出血發生率dabigatran (2.12%/year)、rivaroxaban (1.97%/year)皆低於warfarin (3.25%/year) 11;本研究中二種DOACs未與warfarin做比較,與上述研究結果相比,dabigatran發生率與過去研究相似,rivaroxaban則較低於過去研究。
近年已有DOACs藥物之間直接比較的研究,2020年M. Jansson等人於瑞典收錄25,843位診斷NVAF初次使用NOACs病人,dabigatran對比rivaroxaban在低劑量使用時,重大出血風險無顯著差異(HR,0.72; 95% CI, 0.52-1)12;2019年Shih-WM等人以台灣健保資料庫做研究,收錄13,505位服用dabigatran 110mg與6,551位使用rivaroxaban 15mg的病人,結果顯示rivaroxaban相對於dabigatran在缺血性中風(HR,1;95% CI, 0.82-1.22)、顱內出血(HR,1.12;95% CI 0.73-1.74)、胃腸道出血(HR,1.14; 95%CI, 0.91-1.43)無顯著差異13。2019年Antonios Douros等人發表系統性回顧與統合分析的觀察性研究14,rivaroxaban相較於dabigatran增加重大出血事件風險(HR 1.33; 95% CI 1.20-1.47; I2: 22%),本研究將低劑量的dabigatran與rivaroxban兩組直接比較,校正後在重大出血風險統計上無顯著差異(p=0.388),與台灣健保資料庫研究及瑞典的研究結果相似。
在次要出血方面,RE-LY試驗族群使用dabigatran 110mg次要出血發生率為10.12%/year9、J-ROCKET-AF試驗中rivaroxaban為15.42%/year10。2015年回溯性世代研究指出rivaroxaban、dabigatran次要出血發生率為23.85%/year、12.12%/year,本試驗中的累積發生率較過去研究低,推測與次要出血事件的計算是依據電子病歷紀錄,病人未告知醫師或未註記停換藥原因,導致發生率可能被低估。
伍、結論
本試驗中處方低劑量dabigatran、rivaroxaban標準劑量治療的比率與其他以亞洲族群為研究對象相似,處方時須考量年齡、體重與腎功能調整劑量,心房顫動的病人應避免併用會顯著增加DOACs血中濃度的藥物,以免增加出血風險,未來也應加強民眾對交互作用及出血副作用的認知與即時提供醫師嚴重交互作用的資訊。DOACs重大出血的發生率約1~3%/year,次要出血事件的型態以血尿及皮下出血為主,dabigatran與rivaroxaban在低劑量時重大出血發生率無顯著差異。本試驗僅收納區域醫院單一院區的個案,受限樣本數不足,相關研究結論仍待未來更多的本土研究來證實。
Utilization of direct‐acting oral anticoagulation in non valvular atrial fibrillation
Chiao Ling Fang
Department of Pharmacy, Taipei City Hospital,
Heping Fuyou Branch.
Abstract
Limited real-world data are available regarding the safety of direct oral anticoagulants in Asians. The present study aimed to evaluate the safety and prescription patterns of DOACs (direct oral anticoagulants) in our hospital. A retrospective cohort study was conducted to investigate the patients with nonvalvular atrial fibrillation (NVAF) who first prescription of DOACs including dabigatran, rivaroxaban, followed up until December 31, 2017. Evaluate the appropriateness of the initial prescribed daily dose of DOACs , the reason of interrupting therapy, the incidence rate of bleeding events and compare the safety differs among rivaroxaban and dabigatran. A total of 171 NVAF patients were included. The prescription of inappropriate-low-dose rate of dabigatran and rivaroxaban is 13.1% and 93.1%. 2.3% dabigatran users were taken concomitant with dronedarone, the severity level of potential drug interaction is Major. The incidence rate of major bleeding occurred with rivaroxaban (0.94%/year) followed by the rate of Dabigatran (2.78%/year), no significant differences were found in major bleeding between dabigatran and rivaroxaban ((HR, 3.062; 95% CI, 0.24-38.74; P=0.388). Our study confirm the rate of inappropriate prescription is similar with previous studies in Asians. dabigatran showed no significant differences with rivaroxaban in major bleeding. The most frequent sites of minor bleeding included hematuria and due to limited sample size, more studies are needed to confirm the results in the future.
參考資料:
1. Chen EC,Tsu JW, Kwo CU, et al. 2016 Guidelines of the Taiwan heart thythm society and the Taiwan society of cardiology for the management of atrial fibrillation. J Formos Med Assoc 2016;115:893-952.
2. Chun LW,Chien CW, Huang YT, Shang HC, et al. Safety and effectiveness of non–vitamin K antagonist oral anticoagulants for stroke prevention in patients with atrial fibrillation and anemia: a retrospective cohort study. J Am Heart Assoc 2019;8(9):e012029.
3. 林雅如、黃英庭、崔百青等.2019台灣腦中風學會非維他命K拮抗劑口服抗凝血劑用於心房纖維顫動患者中風預防治療指引.台灣中風醫誌 2019;1(3):143-184.
4. Jan Steffel, Peter Verhamme, Tatjana SP, et. al. European Heart rhythm association practical guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. European Heart Journal 2018;39: 1330-1393.
5. Joana Santos, Natália António, Marília Rocha, et al. Impact of direct oral anticoagulant off-label doses on clinical outcomes of atrial fibrillation patients: A systematic review. Br J Clin Pharmacol. 2020;86:533-547.
6. Kwang NL, Jong-IC, Ki YB, et al. Effectiveness and safety of off-label dosing of non–vitamin K antagonist anticoagulant for atrial fibrillation in asian patients. Scientific Reports. 2020;10:1801.
7. Kang-LW, Giugliano RP, Goto S, et al. Standard dose versus low dose non–vitamin K antagonist oral anticoagulants in Asian patients with atrial fibrillation: A meta-analysis of contemporary randomized controlled trials. Heart Rhythm. 2016; 13(12):2340-2347.
8. Product Information: PRADAXA® (dabigatran etexilate) capsules. [cited 2020 Sep.30].Availablefrom:https://info.fda.gov.tw/MLMS/H0001D3.aspx?LicId=02025459.
9. Masatsugu Hori, Stuart J. Connolly, et al. Effects on ischemic and hemorrhagic strokes and bleeding in asians and non-Asians with atrial fibrillation. Stroke 2013;44:1891-1896.
10. Hori M, Matsumoto M, Tanahashi N, et al. Rivaroxaban vs. warfarin in Japanese patients with atrial fibrillation - the J-ROCKET AF study. Circ J 2012;76:2104-11.
11. Yi HC, Lai CS, Hu TT, et al. Efficacy and safety of apixaban, dabigatran, rivaroxaban, and warfarin in asians with nonvalvular atrial fibrillation. J Am Heart Assoc 2018;7(8): e008150.
12. M Jansson, S Själander, V Sjögren, et al. Direct comparisons of effectiveness and safety of treatment with apixaban, dabigatran and rivaroxaban in atrial fibrillation. Thromb Res. 2020;185:135-141.
13. Shih-WM, Ting TL, Min TL, et al. Direct comparison of low-dose dabigatran and rivaroxaban for effectiveness and safety in pPatients with non-valvular atrial fibrillation. Acta Cardiol Sin 2019;35:42-54.
14. Antonios Douros, Madeleine Durand, Carla MD, et al. Comparative effectiveness and safety of direct oral anticoagulants in patients with atrial fibrillation: a systematic review and meta-analysis of observational studies. Drug Saf 2019;42(10):1135-1148.
通訊作者:方喬玲/通訊地址:台北市中華路一段33號 藥劑科
服務單位:台北市立聯合醫院和平婦幼院區藥劑科/聯絡電話:(O) 02-23889595 ext
2020