新型冠狀病毒疫苗簡介
洪千茵1、吳家鈞2
1彰化基督教醫療財團法人雲林基督教醫院藥劑課、2台中榮民總醫院家醫科
摘要
新型冠狀病毒(COVID-19)感染造成全球巨大公共衛生危機,大量資源投入疫苗研發以預防感染。本文探討COVID-19疫苗研發相關研究並針對疫苗種類及效用做進一步文獻回顧。
關鍵字: SARS-CoV-2、COVID-19、新型冠狀病毒、疫苗
壹、前言
自2019年底起,嚴重急性呼吸道症候群冠狀病毒2 (severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)造成全球重大疫情,引發嚴重國際公共衛生緊急狀態,隨後被世界衛生組織(World Health Organization, WHO)命名為COVID-19 (Coronavirus Disease-2019),即是大家熟知的新型冠狀病毒(新冠病毒)。全球投入不可計量的醫療資源,用以發展感染預防及疾病控管、治療等相關研究,而其中疫苗更是在預防醫學的初段預防中提供了特殊保護的效用,是杜絕感染性疾患中不可或缺的重要角色。目前以WHO最新公告來看,有66個基於不同機轉的疫苗(表一)於臨床發展階段,另有176個臨床前研究進行中1。
表一 臨床試驗─新型冠狀病毒候選疫苗
貳、疫苗發展
一、發展原理
利用人體免疫系統經疫苗注射後,發展辨識及學習的能力,讓病原體(如細菌或病毒)進入體內前能藉預先的記憶細胞產生中和病原抗體(neutralizing antibodies),進而消滅尚未引發疾病的病原體。新冠病毒屬於正單鏈核糖核酸病毒(single- stranded, positive-sense RNA genome),因缺乏修正錯誤的DNA聚合酶,因此具有突變特型,可能造成地區流行的病毒株不同,疫苗效力也不同。新冠病毒藉其表面的棘突蛋白(spike [S] protein)增加對人體細胞的親和力,是其高傳染力的主因,因此部分疫苗的製造,也係藉由辨認此獨特的S蛋白為主要機轉。
二、疫苗發展步驟2
(一) 臨床前研究
蒐集疾病相關的流行病學、致病機轉、非臨床資料,如可能的疫苗反應模式、相關動物實驗,甚至是毒性實驗,以支持未來臨床研究的安全性及療效。
(二) 第一期臨床試驗
主要受試者為具有健全免疫的健康成人(常介於18~55歲間),目的在評估疫苗對於人體的安全性,因受試者少(通常小於百人),須頻繁追蹤是否有不良反應出現。也在研究過程中,逐步增加藥物劑量,建立初步安全劑量資料。
(三) 第二期臨床試驗
通過初步安全檢驗後,深究疫苗的最佳劑量、投藥方式、時程。通常納入約數百位受試者,而其中除了日後該疫苗鎖定的目標族群(target population)外,也有部分受試者是由上一期的臨床試驗接續參加的,以建立完整的安全資料。在此期別多以隨機(randomized)分配的不同劑量作為分組,以平行對照模式,評估不同劑量下的免疫原性及藥物安全性,並建立疫苗療效的初步資料。
(四) 第三期臨床試驗
以前瞻性(prospective)、雙盲(double-blinded)具對照組的隨機研究中,驗證疫苗療效,因此選擇疾病發生率高之區域並且收納較多受試者(數以千計),評估臨床保護力、療效及安全性,並確立不同批次所製造的疫苗具有一致性(consistency)。而疫苗效用(efficacy)可藉以下公式來評估:[(未接種疫苗者被傳染率-接種者被傳染率)/未接種疫苗者被傳染率]x100%。
三、 疫苗研發平台 (Vaccine platforms)
新冠病毒疫苗研發平台眾多,除傳統的去活性(如流感疫苗)及減毒(麻疹疫苗)法,在科技進步下,病原體的基因、蛋白片段也能作為研發平台3。
(一) 去活性疫苗(Inactivated vaccines)
其製造原理為使用化學劑或加熱將病毒去活化,讓其在體內無法致病,而其抗原經抗原表現細胞表現給Th cell後,誘發體液性免疫,產生B cell記憶(memory),但由於T cell記憶較差,因此效力較低,保護時效較短。常需要多次注射及追加劑,以提高效價。大多去活性疫苗為肌肉注射。針對新冠病毒的疫苗不只針對棘突蛋白,也能對病毒其他部位的成分做辨識,引發後續的免疫反應3。
(二) 活性滅毒疫苗(Live attenuated vaccines)
將病原體或其部份成份加以滅毒或減毒處理,降低其致病力,接種後造成類似自然感染的免疫反應,可產生中和抗體,好處是可提供完整的抗原,所以產生的免疫效果較好,持續時間較久,但對人體還是具有輕微感染性,免疫力低下的人接種時須特別注意。活性疫苗多為經鼻黏膜噴劑,但目前滅毒疫苗的研發皆處於臨床前的試驗,尚未有人體試驗登記在案1。
(三) 重組蛋白疫苗(Recombinant protein vaccines)
擷取蛋白片段不需活性病原體,如Novavax的NVX-CoV2373重組次單元奈米顆粒疫苗。另外目前台灣三家疫苗研發廠皆是藉此技術發展疫苗,皆準備進入第二期審查階段。國光生技自主研發的重組蛋白候選疫苗AdimrSC-2f COVID-19 S蛋白片段4,高端疫苗的新冠疫苗MVC-COV1901以三聚體結構呈現的S-2P全長基因修飾重組S蛋白為疫苗抗原5,最後,聯亞生技UB-612除有精準設計之S1-RBD病毒抗原外,另加入Th/CTL混合胜肽,是可刺激人體B、T免疫細胞的多重表位次單位新冠疫苗(Multitope Protein/Peptide-based Vaccine, MPV)6,可引起均衡之B細胞活化並擴大T細胞免疫反應,此類疫苗通常不需以超低溫冷鏈運送及儲存。
(四) 病毒載體疫苗(viral vector-based vaccines)
將低毒性的替代病毒(如腺病毒)作為載體,破壞其複製能力,不致對人體造成危害,然後將一段製造病毒S蛋白的DNA放入載體基因序列中,最後將之遞送至人體細胞,刺激免疫系統。中國康希諾生物公司(CanSino Biologics)的Ad5-nCoV、英國阿斯利康公司(AstraZeneca Inc.)與牛津大學(Oxford Biomedica)合作開發的AZD1222、莫斯科Gamaleya研究院與俄國防部共同開發的Gam-COVID-Vac、美國嬌生集團(Johnson & Johnson)子公司Janssen製造的JNJ-78436735,皆是以腺病毒為載體的疫苗。病毒載體疫苗通常使用DNA,結構穩定度較高,不需以超低溫冷鏈運送,也較易儲存1。
(五) DNA疫苗
在細菌或酵母菌表現載體(expression vector)上,攜帶病原中和抗體相關的抗原序列,以肌肉注射接種為例,DNA載體進入肌細胞後會不斷地合成抗原相關蛋白,激發宿主體液性及細胞媒介免疫反應,而達到免疫保護作用。優點是能大量產生抗原序列,持續良好的免疫保護力,但也有載體基因跟人類DNA結合的風險。目前發展中的DNA疫苗仍以S蛋白抗原序列為主。美國疫苗大廠Inovio Pharmaceuticals開發的INO-4800就是屬於DNA疫苗7。
(六) 訊息RNA (mRNA)疫苗
屬於較新的疫苗發展方法,原理是編碼棘蛋白的訊息RNA製成疫苗,當訊息RNA進入人體細胞的細胞質中,就能轉譯出目標抗原蛋白,較DNA疫苗省去了轉錄的步驟,疫苗製造過程更快,使用上也更安全。目前大家較熟知的美國莫德納公司(Moderna Inc.) mRNA-1273及輝瑞藥廠(Pfizer-BioNTech)的BNT162b2皆是此類疫苗。
參、疫苗接種(Vaccination)
一、疫苗接種概念
能幫助預防傳染病的並非疫苗本身,而是完成接種疫苗,目前根據Advisory Committee on Immunization Practices (ACIP)建議下,以第一線醫療、長期照護體系人員為主,其次為75歲以上及第一線相關人員優先接種8。
二、國際認證疫苗簡介
以下針對各國際疫苗做介紹,並整理各疫苗如表二。
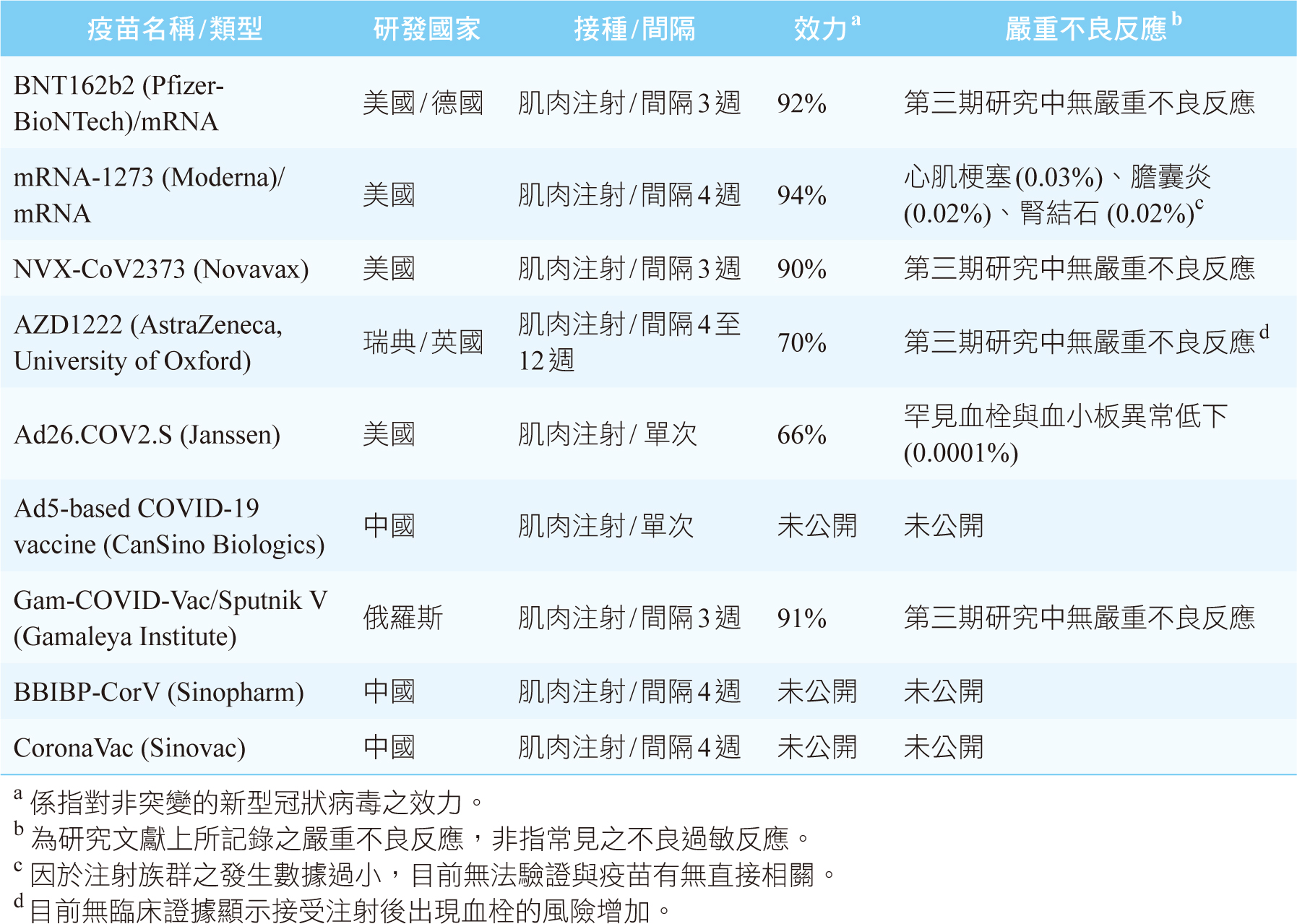
表二 國際認證疫苗簡介
(一) BNT162b2 (Pfizer-BioNTech)
通過美國FDA,適用於16歲以上族群,特殊族群(已感染過新冠病毒者、孕婦及免疫不全者)目前仍是建議可施打9。以間隔3週進行肌肉注射0.3mL,共需兩劑。根據目前研究,接受第一劑接種後產生過敏反應的比例約為百萬分之五8。在大於65歲以上的族群注射後產生免疫原性(Immunogenicity)的比例明顯低於年輕族群。另對於目前已知的突變病毒株(英國的B.1.1.7及南非的B.1.351)所產生的中和抗體濃度較未突變種來的低10。與安慰劑對照組相比,接受單一劑疫苗效用約為52%,注射完整兩劑效用可達約92%。接種疫苗後的不良反應絕大部分為輕至中度,包含疲倦、頭痛、發冷顫等,發生比率小於5%,雖有零星個案產生特發性顏面神經痲痹(Bell's palsy),但普遍認為與接種疫苗無關。
(二) mRNA-1273 (Moderna)
美國FDA認證,適用於18歲以上族群,特殊族群同上述可施打。間隔4週進行肌肉注射0.5mL,共需兩劑,建議第二劑施打期間至少間隔4週,至多勿超過6週。據研究,接受第一劑接種後產生過敏反應的比例約小於百萬分之三11,在大於65歲以上的族群注射後產生免疫原性的比例與年輕族群類似。對突變病毒株所產生的中和抗體濃度較未突變種來得低,約只有六分之一,但仍具保護力。接受單一劑量後效用不明,但注射完整兩劑疫苗後效用可達約94%11。接種疫苗後的不良反應多為輕至中度,約17%可能產生發燒,而疲倦、肌肉關節疼痛發生比率約小於10%。
(三) NVX-CoV2373 (Novavax)
以間隔3週肌肉注射接種,提供之疫苗效用約為90%,對於突變型病毒株的效用相差甚異,在第三期試驗中,對B.1.1.7效果約等同非突變種,但對B.1.351效用約只有一半12。
(四) AZD1222 (AstraZeneca, University of Oxford)
間隔4到12週,肌肉注射接種,接受第一劑量後產生的抗原性約等同於完整兩劑注射後效用,提供抗病毒效用約為70%,接種疫苗後的不良反應以發燒、疲倦、頭痛常見,發生比率約小於10%,但於第三期臨床試驗中有一個案發生疑與接種相關的貫穿性脊髓炎(Transverse myelitis)13。
(五) Ad26.COV2.S (Janssen)
單次注射,於接種後14天提供約66%的疫苗效用,預防重症感染的效用可高達85%,已知對於突變病毒的預防力較弱,但確切數據未知14。
(六) Ad5-based COVID-19 vaccine (CanSino Biologics)
單次肌肉注射,目前主要限於中國軍隊使用,臨床效用數據未明朗。
(七) Gam-COVID-Vac/Sputnik V (Gamaleya Institute)
俄國研發的疫苗,由兩劑不同的腺病毒作為載體,以間隔3週肌肉注射接種,第三期試驗證實在接種後21天可提供約91%的效用15。
(八) BBIBP-CorV (Sinopharm)
中國製去活化疫苗,兩劑間隔4週,肌肉注射,目前以中國與阿拉伯地區為主要接種地區,詳細效用需驗證。
(九) CoronaVac (Sinovac)
中國製去活化疫苗,兩劑間隔4週,肌肉注射,目前以中國與巴西地區為主要接種地區,仍待詳細效用報告。
肆、群體免疫力(Herd immunity)
一、群體免疫定義
當族群中大部分的人對特定病原有抵抗病原的抗體,就能達到群體保護的效果、阻止疾病傳播。疫苗能有效地讓相當比例的人具有免疫力,但若病毒突變迅速,施打疫苗所產生的抗體就可能只在短期內有效(如流行性感冒疫苗需年年施打)。
二、群體免疫於新冠病毒的角色
據WHO的報告,以新冠病毒的高傳染力,約需近四分之三以上的人免疫才能有效抵抗疾病傳播。大部分國家,已感染新冠病毒的人口比例皆小於百分之十,因此想藉「佛系防疫」讓大部分的人感染,而達到群體免疫是需要付出相當的代價,也是相當不道德的。
伍、結語
目前新冠肺炎的傳播在絕大部分地區都無法達到群體免疫,民眾對於疫苗的期待甚高,但疫苗的發展需嚴謹且反覆的測試,才能確保試驗階段受試者的安全及上市後接種的有效性,接種後也無法保證是否能終身免疫,因此理性地配合國家防疫政策,用積極且樂觀的心態面對,才能有效維持自己及周遭旁人的身心健康。
Introduction of vaccines against COVID-19
Chien-Yin Hung1, Jia-Jyun Wu2
1Department of Pharmacy, Yunlin Christian
Hospital
2Department of Family Medicine, Taichung
Veterans General Hospital
Abstract
The coronavirus disease 2019 (COVID-19) pandemic has caused widespread health and social-economic disruption. The development of a safe and effective vaccine is urgently needed. This article is aim to introduce vaccination principle and each vaccine under clinical settings to improve understandings about safety and efficacy.
參考資料:
1. 世界衛生組織網站。瑞士:世界衛生組織(World Health Organization, WHO),2021。Available from: https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines (Accessed on February 12, 2021)
2. College of Physicians of Philadelphia. The History of Vaccines: Vaccine Development, Testing, and Regulation. Available from: https://www.historyofvaccines.org/content/articles/vaccine-development-testing-and-regulation (Accessed on February 12, 2021).
3. Plotkin S, Robinson JM, Cunningham G, Iqbal R, Larsen S. The complexity and cost of vaccine manufacturing - An overview. Vaccine. 2017;35(33):4064-4071.
4. 中華民國衛生福利部疾病管制署網站。台北:中華民國衛生福利部,2021。Available from: https://www.mohw.gov.tw/cp-4628-55266-1.html (Accessed on February 12, 2021)
5. 中華民國衛生福利部疾病管制署網站。台北:中華民國衛生福利部,2021。Available from: https://www.mohw.gov.tw/cp-16-55430-1.html (Accessed on February 12, 2021)
6. 中華民國衛生福利部疾病管制署網站。台北:中華民國衛生福利部,2021。Available from: https://www.mohw.gov.tw/cp-16-55415-1.html (Accessed on February 12, 2021)
7. Yu J, Tostanoski LH, Peter L, et al. DNA vaccine protection against SARS-CoV-2 in rhesus macaques. Science. 2020;369(6505):806-811.
8. 美國疫苗接種諮詢委員會指引。U.S.: Advisory Committee on Immunization Practices (ACIP). COVID-19 vaccine safety update, Advisory Committee on Immunization Practices (ACIP) meeting, 2021.
9. 美國食品藥物管理局。U.S.: Food and Drug Administration, FDA Briefing Document. Pfizer-BioNTech COVID-19 Vaccine. Vaccines and Related Biological Products Advisory Committee Meeting. Available from: https://www.fda.gov/media/144245/download (Accessed on February 12, 2021).
10. Muik A, Wallisch AK, Sanger B, et al. Neutralization of SARS-CoV-2 lineage B.1.1.7 pseudovirus by BNT162b2 vaccine-elicited human sera. Science. 2021.
11. Baden LR, El Sahly HM, Essink B, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2021;384(5):403-416.
12. Mahase E. Covid-19: Novavax vaccine efficacy is 86% against UK variant and 60% against South African variant. BMJ. 2021;372:n296.
13. Voysey M, Clemens SAC, Madhi SA, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2021;397(10269):99-111.
14. Zhu FC, Guan XH, Li YH, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet. 2020;396(10249):479-488.
15. Logunov DY, Dolzhikova IV, Zubkova OV, et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia. Lancet. 2020;396(10255):887-897.
通訊作者:洪千茵/通訊地址:雲林縣西螺鎮648市場南路375號
服務單位:彰化基督教醫療財團法人雲林基督教醫院藥劑課/聯絡電話:(O) 05-5871111
ext 5151