新一代持續性藥效膠囊:劑型特點、藥物動力學及其在ADHD之療效
古貞庭
衛生福利部草屯療養院藥劑科
摘要
注意力不足過動症(attention deficit hyperactive disorder, ADHD)是兒童期常見的神經行為障礙,第一線藥物為methylphenidate (MPH)。治療時,醫師會依據病情及個別病人對藥物的反應調整劑量和服用方式,用藥方法通常會預留一些「藥物空檔」,於特定的工作及學習時段發揮藥效,其他時間則可減少使用,以減少副作用的發生。
市面上的MPH主要可分為短效型(immediate release, IR)與持續釋放劑型(extended release, ER)。新劑型的MPH製劑採用ORADUR®技術持續釋出藥物,兼具短效與長效藥物的優點。服用後,膠囊外層快速溶解釋放藥物,服藥兩小時內達到有效劑量;而內層的新一代持續性藥效膠囊在胃內環境會形成可控制MPH釋放速率的基質,藥效維持時間可達8~12小時;晚間則為「藥物空檔」,讓病人睡眠不至於受藥物影響而得以充分休息。
此外,其膠囊比市售其他產品小,更方便兒童服用。透過藥物動力學研究證明ORADUR®技術的藥物設計可抵抗可能導致控釋劑型失效和藥物傾倒性釋出的常見化學或物理問題,減少藥物濫用的風險。其療效也已在臨床試驗獲得證實,能顯著改善ADHD症狀,包括注意力集中度、持續注意力、抑制控制和衝動控制等都有明顯進步。且其安全性高,現階段觀察到的副作用較其他同類藥物輕微,失眠、頭痛的副作用較少,是治療ADHD的新選項。
關鍵字: 注意力不足過動症、methylphenidate、藥物動力學、劑型設計
壹、前言
注意力不足過動症是兒童期常見的神經行為障礙之一,其症狀持續到青春期和成年期的情況常因延遲治療而於普遍存在。ADHD需要長期的藥物控制與行為治療,第一線治療藥物為精神刺激劑(stimulants) methylphenidate (MPH)1,2,市面上主要有短效與長效型兩種,其中短效型產品Ritalin IR®為速放(immediate release, IR)劑型,作用時間較短,每天需服用2~3次,方可於上課時間和課後維持治療的效果。然而,此種給藥對病人來說較為不便,且可能有安全和隱私方面的顧慮,進而影響治療效果1。
據統計ADHD約半數病人在開始治療2~3年內未遵守治療指引或中止治療,這可能造成症狀控制不佳,日積月累形成嚴重的不良影響,包括社交和學習上的困難、濫用藥物或犯罪等行為問題以及意外傷害等,導致病人本身在經濟、社會和情感各方面都可能遭遇困境,其家人和社區也會受到影響3。精神刺激劑在臨床實務應用(real-world)的研究中發現,不良反應、反應不佳或藥效不足是ADHD病人無法持續藥物治療的最常見原因3。
持續釋放型藥物採用控釋技術,以達到持續藥效的作用,增加用藥方便性及順從性(compliance),但治療上仍有問題待解決1,2。臨床治療的難處在於,劑量太低則療效不足,太高則容易出現副作用。長效劑型雖可減少患者在學校因服藥而被汙名化(stigma)的問題及提升用藥順從性,但無法保證全天候的穩定療效。藥效不足最常發生的時間點有二,分別是尚未發揮藥效的早晨,以及藥效消退的傍晚。此外,食慾不振、睡眠障礙是常見的副作用,常因而降低病人接受治療的意願,短效劑型容易因用餐時間時藥物濃度偏高而食慾不佳,而長效劑型因晚上藥物濃度仍高而影響睡眠。
貳、新一代持續性藥效膠囊的劑型設計
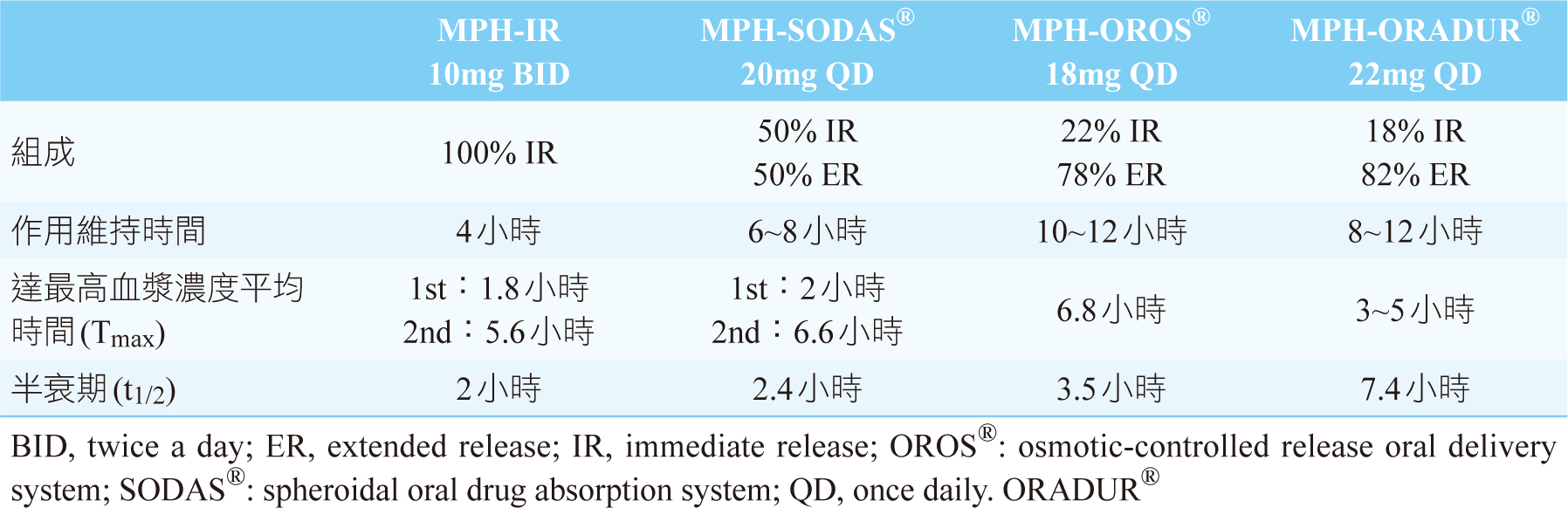
MPH的半衰期(half-life, t1/2)短,造成使用上有許多限制。許多持續釋放型藥物的設計成兼具快速產生作用及作用時間延長的特點,其中的IR組成快速溶解產生坡道效應(ramp effect)而產生速效,ER組成使得藥物濃度在中午時段降低,給藥後6~8小時出現第二個藥物濃度峰值,此後逐漸下降1。目前衛生福利部核准的速放劑型有MPH-IR;控釋劑型MPH 產品有MPH-OROS®、MPH-SODAS®及MPH-ORADUR®,三者的藥物釋放系統、藥物釋放模式及作用時間之比較如表一所示1,4-7。
表一 速放與控釋劑型MPH產品之比較1,4-7
治療時,醫師會依據病情及個別病人對藥物的反應調整劑量和服用方式。用藥方法通常會預留一些「藥物空檔」,於特定的工作及學習時段發揮藥效,其他時間則可減少使用,以降低副作用的發生2。符合臨床需求的體內藥物動力學曲線是新一代持續性藥效膠囊劑型設計的目標(圖一)8,9:
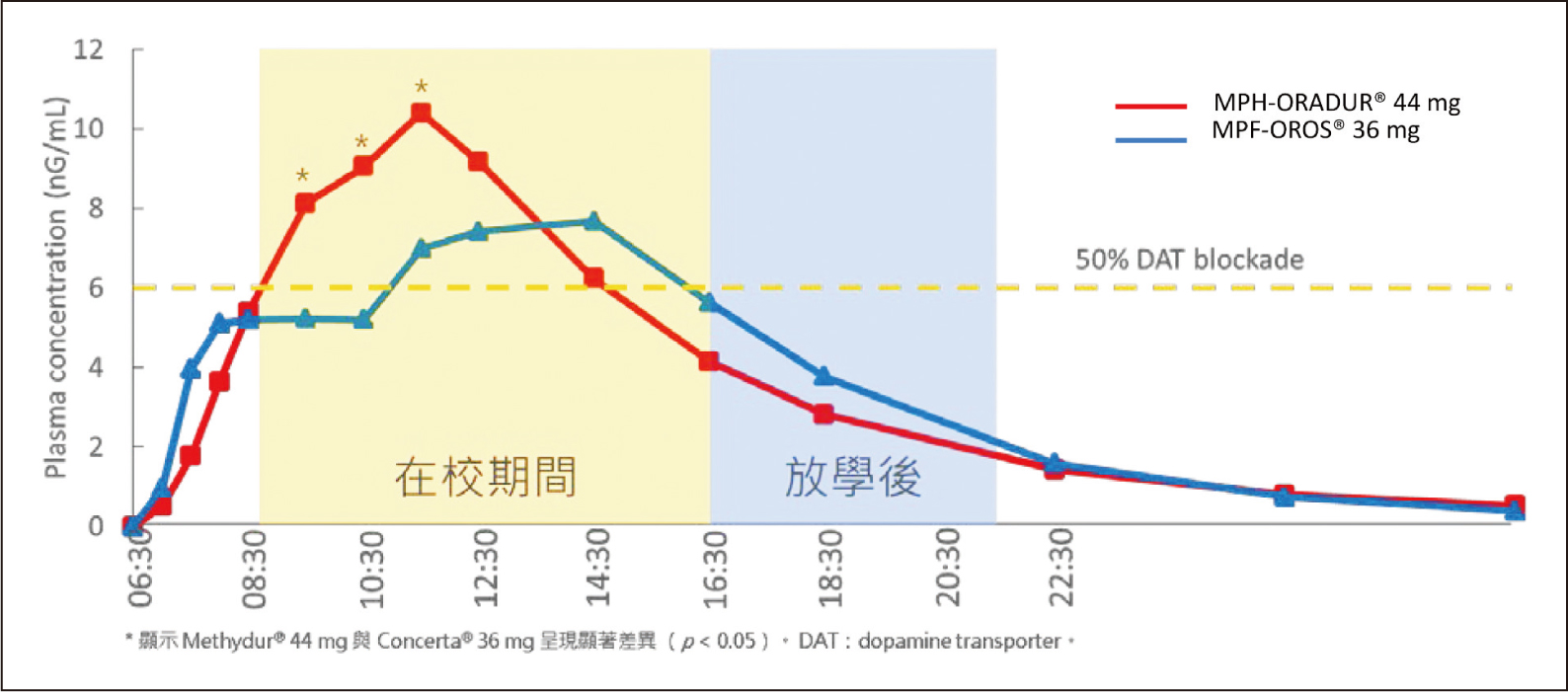
圖一 MPH-ORADUR® 44mg相較MPH-OROS® 36mg,呈現更快的吸收速率及較大程度的吸收10
一、控釋劑型
以控釋劑型的形式,確保每天服藥一次即可獲得有效治療量的MPH,以提高用藥順從性。
二、迅速產生作用
第一階段為初期加速釋藥(initial increasing-rate),可在2小時內血中濃度達6ng/ml,達到有效治療劑量[阻斷50%的多巴胺傳送體(dopamine transporters, DAT)〕。
三、持續作用階段
第二階段為給藥後2~6小時內,以非推升釋藥(non-ascending release)的方式在學童上課時間內提供有效治療劑量的藥物,MPH於3~6小時(Tmax 3~6小時)的血液濃度達8~10ng/ml,達到最大程度地阻斷80% DAT,其效果可持續作用8~12小時。
四、 晚間為「藥物空檔」,減少副作用
第三階段亦為非推升釋藥,在給藥6小時後藥物濃度即持續下降,配合學童放學時間,減少失眠、頭痛等副作用,讓學童得以充分休息。
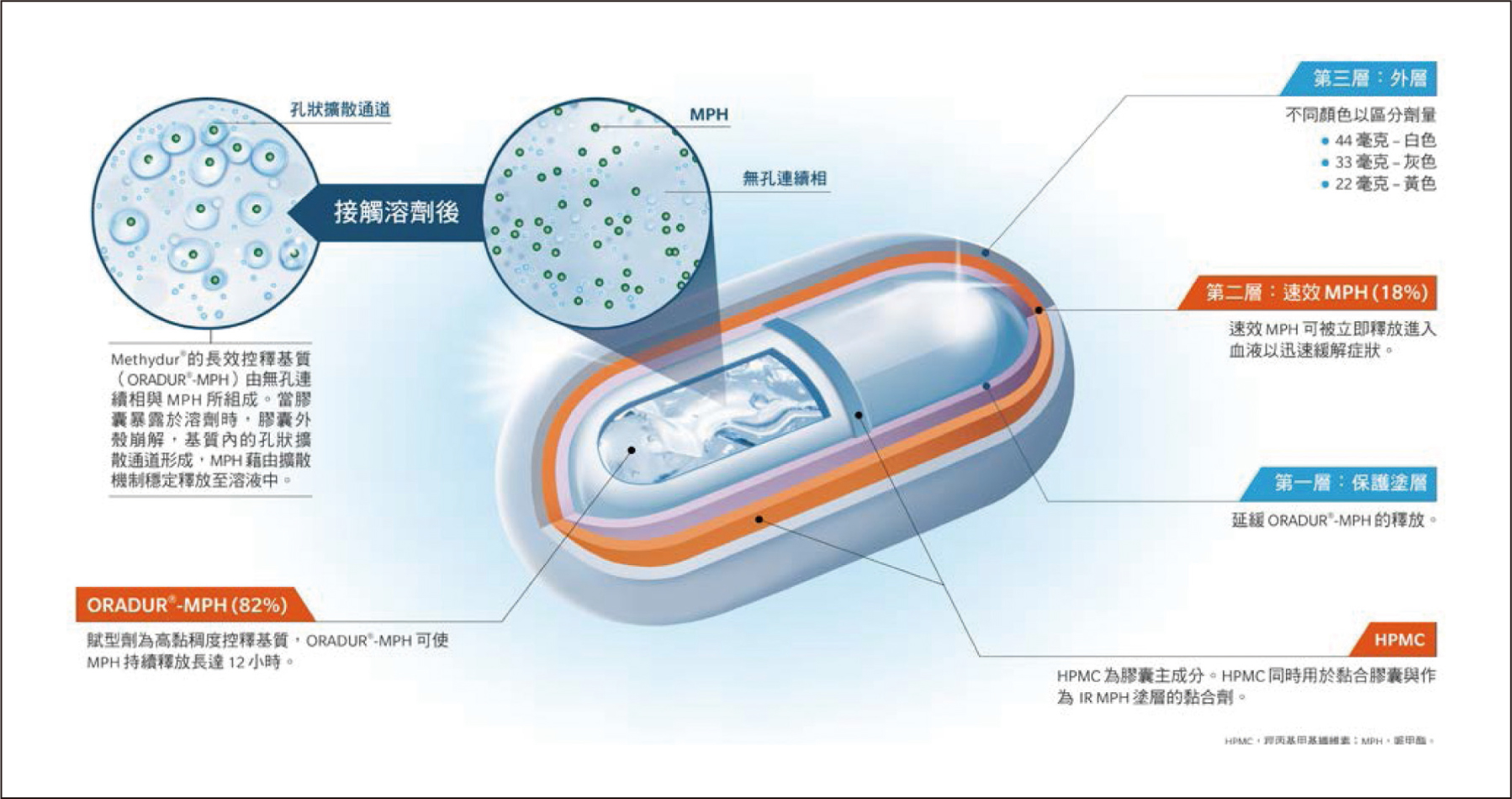
新一代持續性藥效膠囊經由新的藥物動力學型態──多層次熱融藥物釋放技術,可實現從一階到接近零階釋放的藥物動力學表現,達到符合患者臨床症狀治療的需求,並降低相關的副作用。ORADUR®持續性藥效膠囊透過配方工程設計出所需要的藥物釋放動力學,膠囊的主成分為HPMC (hydroxypropyl methylcellulose),最內層由sucrose acetate isobutyrate (SAIB)及其他賦形劑構成高黏度的基本組成,半固體凝膠在胃內環境會形成可控制MPH釋放速率的基質;速率控制保護塗層及IR層包覆在外,可迅速釋放藥物。經多次研究找出最佳的IR/ER藥物比例,以達到最佳體內藥物動力學曲線目標。MPH-ORADUR® 兼具作用快而持續時間長的優點,其設計可抵抗可能導致控釋劑型失效和藥物傾倒性釋出的常見化學或物理問題,也因此可避免有心人士濫用(圖二)。此外,新一代持續性藥效膠囊比市售其他產品小,採4號膠囊,更方便兒童服用。
圖二 MPH-ORADUR®持續性藥效膠囊的劑型設計
參、新一代持續性藥效膠囊的藥物動力學研究
自2009年起,製藥公司開始研發MPH-ORADUR®,於2018年正式上市,衛福部食藥署(TFDA)核定為新劑型、新使用劑量、新單位含量之新藥,並於2020年9月1日取得健保給付。在第三期臨床試驗之前進行了5項第一期臨床試驗,共有71名健康志願者參與,研究目的包括劑量確認、配方優化、藥物動力學特徵與安全性,最終成功開發多層次熱融藥物釋放技術─MPH-ORADUR®持續性藥效膠囊。
在MPH-ORADUR®開發過程的第一期,單劑量、單中心臨床試驗(PK NDA-T375-1206),結果顯示,相較於MPH-OROS® 36mg,MPH-ORADUR® 44mg的吸收速率更快(Tmax較短,且Cmax較高),吸收程度更大(曲線下面積[area under the curve, AUC]較大)。此研究中,MPH-ORADUR® 44mg表現出臨床所需的藥物動力學特徵,服藥2小時內即可達有效治療濃度(6ng/mL),並在有效治療濃度區間維持6小時(圖一)10,11。
後續的隨機、四向交叉藥物動力學研究(PK NDA-T375-1502)測試不同劑量MPH-ORADUR® (22、33和44mg)的藥物動力學與安全性。16位健康成人受試者參與並完成研究,結果顯示,無論在何種劑量下,中位Tmax和平均t1/2分別為4~5小時和約6~7小時,且不受進食與否影響。和空腹狀態相比,飯後單次口服MPH-ORADUR®的Cmax增加19%,AUC則保持不變。在進食條件下,MPH-ORADUR®在22mg至44mg劑量範圍內,其Cmax、AUC (0-t)與AUC (0-∞)呈劑量比例關係4。
肆、新一代持續性藥效膠囊臨床研究
在台灣進行之多中心、隨機分配、雙盲、安慰劑對照、雙向交叉設計的第三期臨床試驗(OP-2PN012-301)以6~18歲的ADHD病人為對象,評估MPH-ORADUR®用於兒童及青少年身上的安全性與療效。試驗包含四階段:
一、篩選期。
二、2週以上的開放性劑量調整期。
三、為期4週的雙盲治療期。
四、2週追蹤期。
在開放性劑量調整期,依受試者的臨床表現與安全性狀況調整至最適劑量,並以最適劑量連續治療2週,整個開放性劑量調整期為期2~7週。在雙盲治療期,受試者依隨機分配之順序接受每種治療(MPH-ORADUR®或安慰劑)各2週。符合治療意向(intent-to-treat, ITT)族群的100位受試者平均年齡約9歲,男性占七成以上,與臨床實務情況相近。以SNAP-IV量表教師版評分(Swanson, Nolan and Pelham Teacher and Parent Rating Scale Teacher Score)相較於基線期的變化做為療效評估指標,MPH-ORADUR®組與安慰劑組的得分變化分別為-1.3±8.3及3.0±10.6,兩組間有統計顯著差異(p=0.0044),顯示新一代持續性藥效膠囊可顯著改善ADHD症狀4,12。
在國內的MRI (magnetic resonance imaging)影像檢查研究中,比較ADHD病人與正常發展孩童的腦區活動,以及ADHD病人在使用MPH-ORADUR®之後的效果與腦區活動狀況。病人經過8週的治療後,右側額下迴(right inferior frontal gyrus, rIFG)、背側前扣帶迴皮質(dorsal anterior cingulate cortex, dACC)與右方背外側前額葉(right dorsolateral prefrontal cortex, rDLPFC)的腦區較為活化,而病人注意力集中度、持續注意力、抑制控制和衝動控制都有明顯改善,顯示病人症狀與觀察到的腦區活化程度呈現一致的變化13。
MPH-ORADUR®在第三期臨床試驗OP-2PN012-301中最常觀察到的副作用為:食慾減低(49.1%)、失眠(17.3%)、噁心(14.5%)、鼻咽炎(9.1%)、頭痛(8.2%)及頭暈(6.4%)12。在PK NDA-T375-1206和PK NDA-T375-1502研究中,單次劑量服用MPH-ORADUR®在 22~44mg的範圍內均未觀察到安全性問題12,14。
伍、藥物釋放機制在臨床使用上的影響
目前在臨床上普遍使用製劑之藥物動力學特性,無法提供ADHD病人最簡便且無同儕壓力的服用方式,以滿足「藥物空檔」的原則。使用短效劑型的病人需要在學校服用第二劑,因而面臨同儕壓力。早期的持續釋放劑型雖能於上課期間持續遞送以維持恆定的MPH濃度,然而並無法提供與短效劑型重複服用相同的療效,且可能產生耐藥性。反之,近期的持續釋放劑型具有加速釋藥動力學的藥物遞送曲線,可克服恆定遞送製劑所觀察到的耐藥性問題。
MPH-OROS®在一般治療劑量下常有前段藥效不足的問題。研究顯示,服用MPH-OROS®欲於2小時後達到6ng/mL的血中濃度5,所需劑量至少54mg,但病人並非整天都需要如此高的劑量。後續的MPH-SODAS®在服藥後1~4小時的血中濃度明顯高於MPH-OROS®6,成功克服上午藥物濃度不足的問題,血中濃度下降期間與午休時間吻合,但是效果只能維持6~8小時,後續的藥物濃度不足難以讓病人持續保持專心。
上述問題的解決辦法為早上合併使用MPH-OROS® + MPH-IR,藉此維持低劑量MPH-OROS®,並彌補前段藥效不足的問題。2019年一篇研究比較MPH-OROS® 27mg + MPH-IR 10mg與單用MPH-OROS® 36mg維持的有效濃度。在兩者藥量相近的情況下,合併療法的日間藥效維持面積(day therapeutic box, DTB)相對較大15。合併療法也適用於傍晚藥效不足的狀況,或是依個案的需求來挑選適合的劑型。
根據藥物動力學及現有的初步臨床研究證據來看,新一代持續性藥效膠囊符合理想上兼顧前段和後段劑量及療效,克服了MPH-OROS®和MPH-SODAS®在臨床上的不足之處,藥效發揮更快,持續時間更久。MPH-ORADUR® 44mg劑量高於MPH-OROS® 36mg,但在適當的劑型設計下,其副作用並未因劑量較高而變多。
陸、結論
ADHD的各種治療藥物與劑型都有其特性,臨床醫師的角色在於依病人狀況選擇適合的藥物及治療方案,盡可能滿足病人需求,以達到最佳治療成果。根據現有研究證據,新一代持續性藥效膠囊(Methydur®)的作用兼顧前、後段劑量及療效,突破了其他藥物在臨床上的侷限,是值得嘗試的ADHD治療新選擇。未來也需要累積更多的數據及使用經驗,再進一步確認Methydur®實際運用在臨床上的治療反應。
A new generation of sustained efficacy capsules: Dosage form characteristics, pharmacokinetics and its efficacy in attention deficit hyperactivity disorder
Chen-ting ku
Taso-Tun Psychiatric Center, Ministry of Health
and Welfare
Abstract
Methylphenidate (MPH) is one of the most commonly prescribed medications for first-line treatment of attention deficit hyperactive disorder (ADHD). There are two formulations available on the market—extended release (ER) and immediate release (IR). Physicians need to adjust the regimen based on individual clinical response in order to optimize therapeutic effects during specific work or school hours while reducing such effects accordingly at other times to avoid adverse events. Currently, the therapeutic effects offered by ER formulations are unable to satisfy the needs of daily routine activities. Along with the adverse events caused by high MPH levels, clinicians are faced with various challenges. The combination regimen of IR and ER formulations have been trialed to address these problems; however, issues of stigma and National Health Insurance coverage may pose further barriers.
The novel MPH formulation-Methydur® utilizes ORADUR® technology to provide sustained release of MPH. Upon ingestion, the capsule shell dissolves and the MPH-ORADUR® gel in the gastric environment forms a rate-controlling matrix. It provides a quick onset, followed by prolonged duration of action. The effective dose is achieved within 2 hours after dosing, with therapeutic effects sustaining for 8-12 hours. A "drug gap" emerges in the evening, thereby avoiding sleep disruption. Clinical trials demonstrate that Methydur® significantly improves ADHD symptoms, including concentration, sustained attention, inhibition control and impulsive symptoms. Once-daily Methydur® demonstrates an effective, well-tolerable, and safe treatment for children and adolescents with ADHD.
參考資料:
1. Yang X, Duan J: Application of physiologically based absorption modeling to characterize the pharmacokinetic profiles of oral extended release methylphenidate products in adults. PLoS One 2016;11(10):e0164641. doi: 10.1371/journal.pone.0164641
2. 楊雨哲、劉永傑:藥學雜誌。2011; 27(4):116-120。
3. Gajria K, Lu M, Sikirica V, et al: Adherence, persistence, and medication discontinuation in patients with attention-deficit / hyperactivity disorder – a systematic literature review. Neuropsychiatr Dis Treat 2014;10:1543-1569. doi: 10.2147/NDT.S65721
4. Methydur® 思有得仿單
5. Concerta® 專思達仿單
6. Ritalin LA® 利長能仿單
7. Maldonado R: Comparison of the pharmacokinetics and clinical efficacy of new extended-release formulations of methylphenidate. Expert Opin Drug Metab Toxicol 2013;9(8):1001-1014. doi: 10.1517/17425255.2013.786041
8. Markowitz JS, Straughn AB, Patrick KS, et al: Pharmacokinetics of methylphenidate after oral administration of two modified-release formulations in healthy adults. Clin Pharmacokinet 2003;42 (4):393-401. doi: 10.2165/00003088-200342040-00007
9. Martins S, Tramontina S, PolanczykG, et al: Weekend holidays during methylphenidate use in ADHD children: a randomized clinical trial. J Child Adolesc Psychopharmacol 2004;14(2):195-206. doi: 10.1089/1044546041649066.
10. Orient Pharma. Clinical Study Report (Protocol No. PK NDA-T375-1206).
11. Balcioglu A, Ren JQ, McCarthy D, et al: Plasma and brain concentrations of oral therapeutic doses of methylphenidate and their impact on brain monoamine content in mice. Neuropharmacology 2009;57(7-8): 687-693. doi: 10.1016/j.neuropharm.2009.07.025
12. Orient Pharma. Clinical Study Report (Protocol No. OP-2PN012-301).
13. Gau SS, Shang CY, Hsieh CY, et al: A randomized, double- blined, placebo-controlled clinical trial on ORADUR®-methylphenidate in drug-naïve children with ADHD: a control stroop dunction MRI study. TSCAP Annual Meeting 2006.
14. Gau SS, Shen HY, Soong WT, et al: An open-label, randomized, active-controlled equivalent trial of osmotic release oral system methylphenidate in children with attention- deficit/hyperactivity disorder in Taiwan. J Child Adolesc Psychopharmacol 2006;16(4):441-55. doi: 10.1089/cap.2006.16.441.
15. Soufsaf S, Robaey P, Bonnefois G, et al: A Quantitative Comparison Approach for Methylphenidate Drug Regimens in Attention-Deficit/Hyperactivity Disorder Treatment. J Child Adolesc Psychopharmacol 2019;29(3):220-34. doi: 10.1089/cap.2018.0093
通訊作者:古貞庭/通訊地址:南投縣草屯鎮玉屏路161號
服務單位:衛生福利部草屯療養院藥劑科/聯絡電話:(O) 049-2550800 ext 2400