Ixekizumab於乾癬性關節炎病人之療效
何振珮
佛教慈濟醫療財團法人花蓮慈濟醫院藥學部、慈濟科技大學全人教育中心
摘要
單株抗體是乾癬性關節炎治療新趨勢,ixekizumab是人類IgG4單株抗體,藉由與細胞激素白介素17A (IL-17A)選擇性結合,阻斷其與IL-17受體交互作用,進而抑制促發炎細胞激素與趨化素釋放,來減緩乾癬性關節炎發炎、腫脹病灶。Ixekizumab相較於傳統治療乾癬性關節炎藥物,已發現能顯著改善乾癬性關節炎病人疾病改善程度、關節疾病活動度與乾癬面積暨嚴重度。因此,ixekizumab不僅是乾癬性關節炎治療發展新希望,也帶給乾癬性關節炎病人一種治療新選擇。
關鍵字: ixekizumab、Taltz、單株抗體、乾癬性關節炎、monoclonal antibody、psoriatic arthritis
壹、前言
皮膚乾癬併發發炎性肌肉骨骼病變,稱之為乾癬性關節炎(psoriatic arthritis, PsA),20~30%的乾癬病人會演變為乾癬性關節炎,從發病到確診平均1.5年。此病好發於白種人,黃種人次之,黑種人最少。年發病率為2.7%,發病年齡層40~50歲最多。男、女發生率約1:1,但病灶表現方面,男女則有差異;男性好發於遠端指關節炎(distal interphalangeal predominant arthritis),並伴隨指甲病變,女性則常發生多發性關節病變(polyarthropathy)1,2,3。
貳、乾癬性關節炎致病機轉
乾癬性關節炎是一種自體免疫引發的慢性關節炎,但詳細致病機轉尚待釐清2,3。目前研究顯示可能有三種致病機轉:第一種是由多重基因遺傳而引發的關節發炎,乾癬性關節炎病人白血球抗原(HLA)-Cw6明顯增加,如發生末梢關節或脊椎薦腸關節發炎時,HLA-B27顯著上升;第二種是由感染引發的關節發炎,病人關節組織中,格蘭氏陽性菌細胞壁多胜肽會引發自體免疫反應,大量抗體攻擊此種多胜肽而引發關節發炎;第三種是由病人乾癬患部過度增生表皮細胞,造成發炎細胞大量聚集,引起CD8+T cell啟動自體免疫反應而引發關節發炎3,4,5,6。
參、乾癬性關節炎症狀
由於乾癬性關節炎屬於慢性進展的自體免疫疾病,疾病症狀可混合發生,其中67%的病人可能因疾病進展而陸續出現不同症狀3,7。一般乾癬性關節炎會引發周邊與軸向關節、脊椎(病灶類似僵直性脊椎炎)、手指骨、腳趾骨與肌腱滑膜發炎、腫脹;皮膚會發生乾癬病灶;指甲呈現點狀凹陷與甲床裂解(onycholysis)等症狀1,3,7。其次,乾癬性關節炎也可能引起葡萄膜炎、發炎性腸炎、骨髓炎、骨質疏鬆與心血管疾病等非關節病變1,3,7。
肆、乾癬性關節炎診斷
研究發現,80%的病人發生皮膚乾癬病灶早於肌肉骨骼發生病變,但20%的病人則相反,故導致診斷困難8。乾癬性關節炎診斷主要依據臨床病灶表現作為診斷標準,目前診斷分類標準,如:CASPAR (ClASsification criteria for Psoriatic Arthritis) criteria、Fournie criteria、Vasey criteria、Espinoza criteria、Bennett criteria、ESSG (the European Spondyloarthropathy Study Group) criteria、McGonagle criteria9。其中,CASPAR criteria診斷具極高特異度與較佳敏感度,最常作為診斷乾癬性關節炎分類標準 (表一),病人須有明確關節炎病灶,加上CASPAR criteria達三分以上者,即可確診為此疾病3,7,9。此外,其它檢查方法,如乾癬流行病學篩選工具(psoriasis epidemiology screening tool, PEST)問卷、乾癬性關節炎篩檢與評估(psoriatic arthritis screening and evaluation, PASE)、關節X光檢查、檢驗關節滑液多型核白血球含量、實驗室血液數值檢查(如血紅素、紅血球沉降率、非特異性抗核抗體、類風濕因子、尿酸),都有助疾病早期發現、早期治療3,8,9。
表一 CASPAR criteria
伍、 乾癬性關節炎療效指標
乾癬性關節炎療效指標主要為7:
一、 Disease activity score 28 (DAS 28)
全身28處關節疾病活動度,由四項指標(觸痛關節數、腫脹關節數、紅血球沉降率、整體健康狀態)構成全身28處關節疾病活動度。
二、 American College of Rheumatology (ACR) responses criteria
美國風濕病學會制定標準,分為ACR 20、ACR 50、ACR 70。如:ACR 20是指ACR分數改善20%的關節壓痛、腫脹數目減少20%,且疼痛感、病人綜合性評估、醫師綜合性評估、活動能力評估、發炎指數,至少有三項改善20%以上)。
三、 Psoriatic arthritis response criteria (PsARC)
乾癬關節炎反應標準,四項指標(疼痛關節數、腫脹關節數、醫師整體評估、病患整體評估)中,至少二項指標得到改善,且一項須為疼痛關節數或腫脹關節數。
四、 Psoriasis area severity index (PASI)
乾癬面積暨嚴重度指數下降比率作為療效指標,如PASI 50是指PASI分數下降達50%。
五、 Minimal disease activity (MDA)
最低疾病活動度,符合五項條件(週邊關節疼痛總數≦1、週邊關節腫脹總數≤1、乾癬面積暨嚴重度指數≤1或佔體表面積≤3%、病患關節疼痛分數≤15、病患的整體評估≤20、生活品質評估量表≤0.5、著骨點疼痛點≤1)以上,即達MDA標準。
陸、乾癬性關節炎治療
過去傳統治療乾癬性關節炎藥物,如非類固醇消炎止痛藥、糖皮質類固醇、抗風濕疾病調節藥物3,7,10。當病人為輕度乾癬性關節炎,只需使用非類固醇消炎止痛藥/+糖皮質類固醇治療5,7,10。一旦藥物療效不佳或病情持續加重(出現皮膚或關節病變)時,可考慮改用抗風濕疾病調節藥物,如methotrexate、azathioprine或leflunomide於嚴重乾癬性關節炎病人之治療3,7,10。不過,隨著生物製劑發展,其對於乾癬性關節炎的療效更優於抗風濕疾病調節藥物 7。
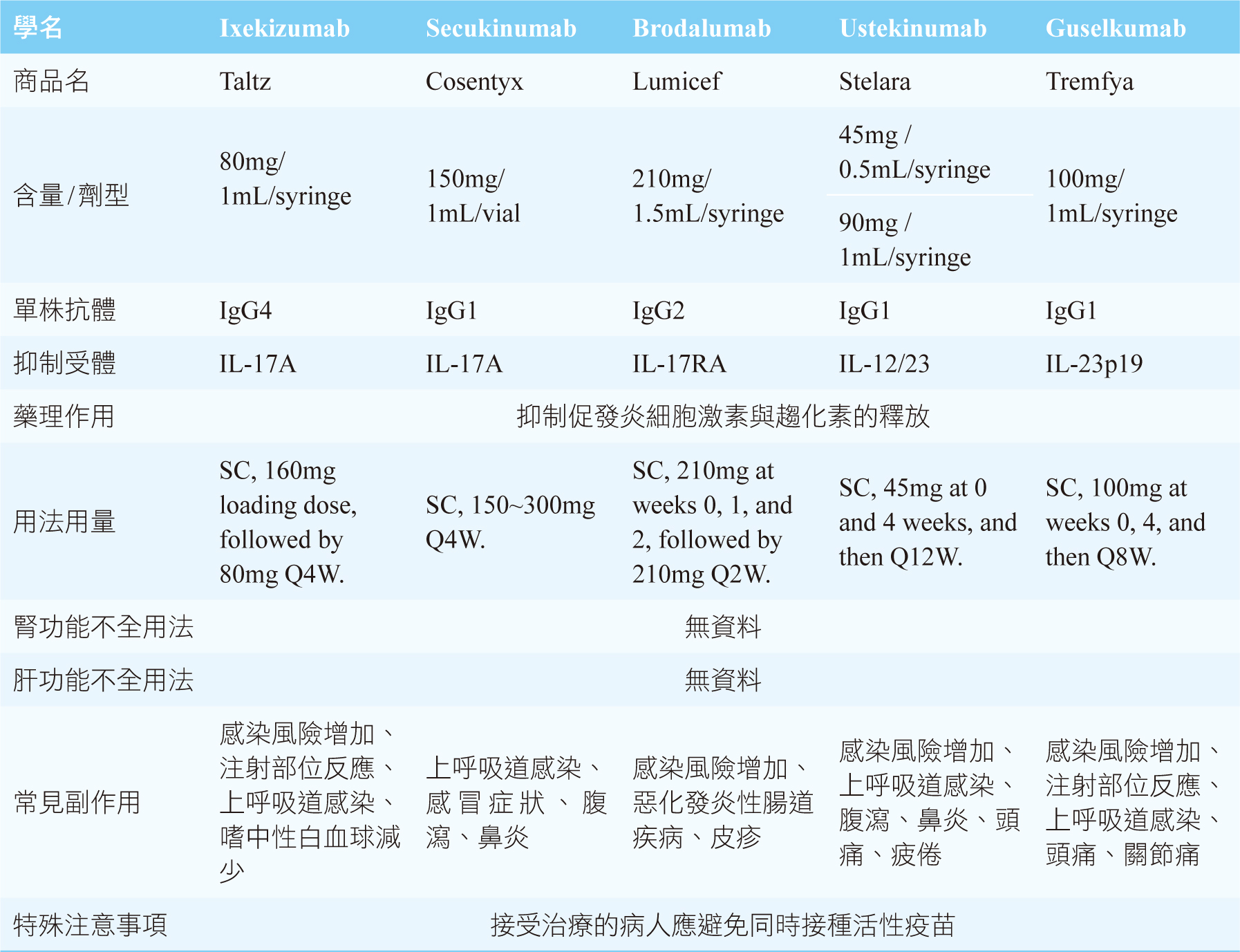
目前治療乾癬性關節炎的生物製劑,如腫瘤壞死因子(tumor necrosis factor-alpha, TNF-α)抑制劑(adalimumab、etanercept、golimumab、certolizumab)、介白素(interleukin, IL-23/IL-17A)抑制劑(表二)或協同刺激調節劑(abatacept)7,10。其中,ixekizumab (Taltz®)屬於介白素抑制劑,2016年美國食品藥物管理署(Food and Drug Administration, FDA)核准上市,開始用於治療皮膚乾癬11,12。
表二 IL-23/IL-17A抑制劑比較表
柒、Ixekizumab之藥物簡介
2017年美國食品藥物管理署與2020年台灣衛生福利部食品藥物管理署陸續核准ixekizumab可用於治療乾癬性關節炎10,11,12。
一、藥物機轉
Ixekizumab是人類IgG4單株抗體,藉由與細胞激素白介素17A (IL-17A)選擇性結合,阻斷其與IL-17受體交互作用,進而抑制促發炎細胞激素與趨化素釋放,來減緩乾癬性關節炎發炎、腫脹的病灶11,12。
二、藥物動力學
Ixekizumab分布體積為7.1L、生體可用率為60~81%、排除半衰期為13天、達到peak血中濃度時間為4天,其次,治療乾癬最佳起始作用時間約12週11,12。
三、藥物用法與用量
Ixekizumab施打方式為皮下注射11,12。目前ixekizumab治療乾癬性關節炎只建議成人使用,建議劑量為第0週施打160mg,之後每4週施打80mg,可單獨使用或併用抗風濕疾病調節藥物(如methotrexate)11,12。但如病人為中至重度斑塊狀乾癬合併乾癬性關節炎,ixekizumab建議劑量為第0週施打160mg,第2、4、6、8、10、12週施打80mg,之後每4週施打80mg 11,12。其次,ixekizumab無用於肝、腎功能不全病人的資料,故無劑量調整建議11,12。此外,病人於ixekizumab治療前,應進行結核病、B型肝炎、C型肝炎篩檢,並依上市後風險管理計畫書進行藥物治療11, 12。
四、懷孕與哺乳
由於ixekizumab是人類IgG4單株抗體,研究發現,隨著婦女懷孕期數增加,IgG進入胎盤量也會增加,但目前ixekizumab無於懷孕婦女使用的相關研究,並不清楚對胎兒的影響,故不建議用於懷孕婦女11,12。其次,目前未有ixekizumab是否分泌至乳汁的研究數據,並不清楚哺乳對嬰兒的影響,如母親使用此藥,應考慮哺乳對嬰兒益處與治療需求,再決定是否用藥11,12。
五、藥物交互作用
Ixekizumab可能降低活性疫苗療效,建議病人於治療前,應依現行疫苗接種指引完成各年齡適合的疫苗接種,治療後則須避免同時接種活性疫苗11, 12。其次,病人開始或停止使用ixekizumab時,若併用CYP450受質藥物(如warfarin或cyclosporine),可能影響CYP450酵素濃度,故須監測相關數值,且應考慮是否調整CYP450受質藥物劑量11, 12。
六、藥物副作用
Ixekizumab常見副作用為感染風險增加(27~38%)、注射部位紅腫(17%)、上呼吸道感染(14%)、嗜中性白血球減少(11%)、血小板減少(3%)、結膜炎(1~3%)、噁心(2%)、頭暈(2%)、流感症狀(≤1%)、克隆氏症(≤1%);其次,發生率<1%為蕁麻疹、發炎性腸道疾病、口腔念珠菌感染、潰瘍性結腸炎、血管性水腫、鼻炎12。
捌、Ixekizumab用於乾癬性關節炎之臨床試驗結果
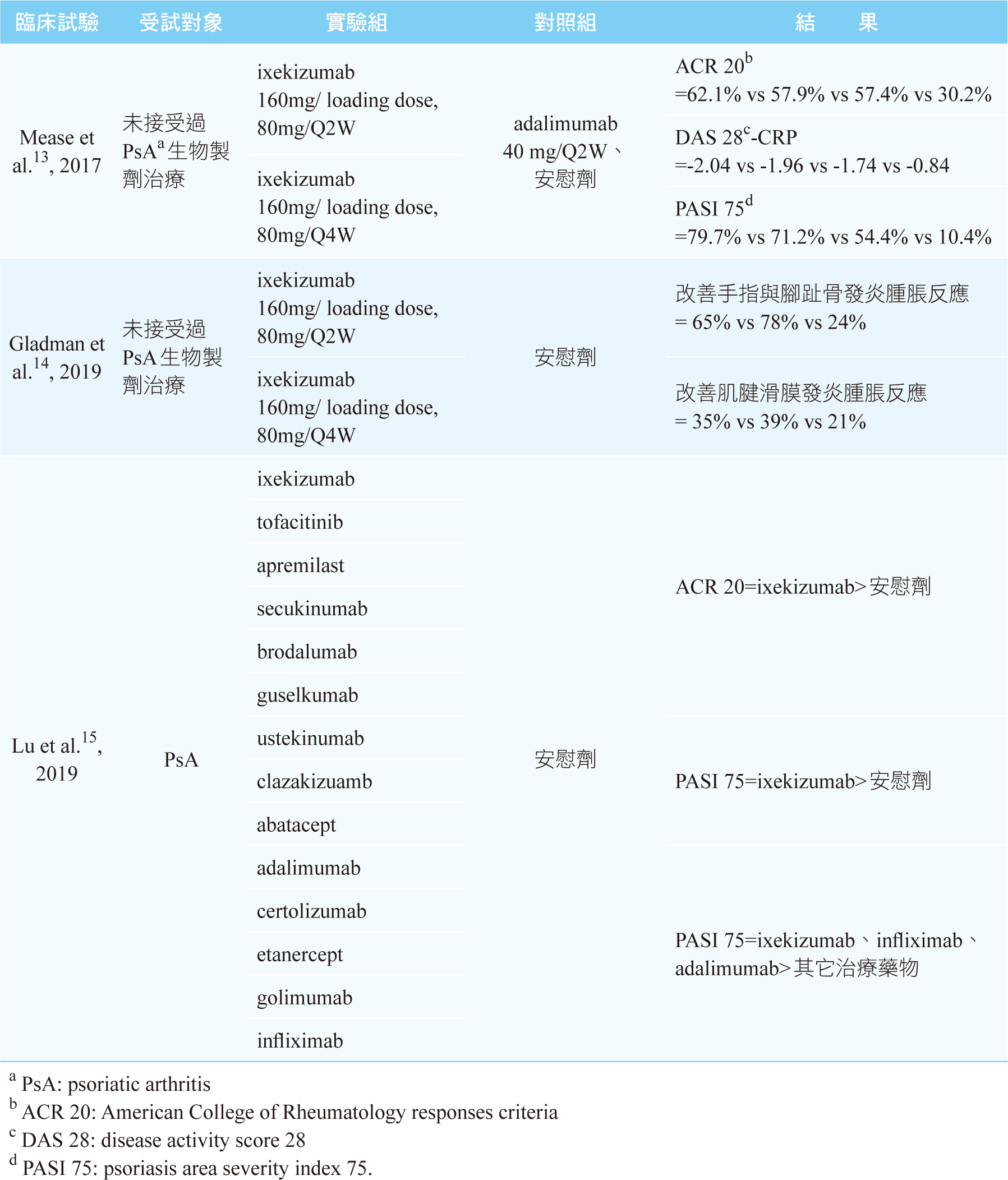
根據2017年,SPIRIT-P1、phase 3、double-blind、隨機控制試驗13。共納入417位未接受過乾癬性關節炎生物製劑治療的受試者,隨機分配至ixekizumab 160mg/ loading dose, 80mg/Q2W (n=103)或ixekizumab 160mg/ loading dose, 80mg/Q4W (n=107)、安慰劑(n=106)、adalimumab 40mg/ Q2W (reference group, n=101)。結果顯示,24週ACR 20反應、DAS 28-CRP關節疾病活動改善、PASI 75乾癬面積暨嚴重度指數下降比率,ixekizumab 80mg/Q2W (62.1%; -2.04; 79.7%)、ixekizumab 80mg/Q4W (57.9%; -1.96; 71.2%)、adalimumab 40mg/ Q2W (57.4%; -1.74; 54.4%)均顯著高於安慰劑(30.2%; -0.84; 10.4%)(all p ≤0.001)。在藥物安全性,ixekizumab (65.7~66.4%)、adalimumab (64.4%)皆較安慰劑(47.2%)更易發生藥物不良反應(all p<0.05);其中,ixekizumab最常見藥物不良反應為感染風險增加(23.5~28.0%)、注射部位反應(12.1~15.7%)、上呼吸道感染(2.9~4.7%)。
根據2019年,整合SPIRIT-P1與SPIRIT-P2、phase 3、double-blind、隨機控制試驗14。共納入679位受試者,隨機分配至ixekizumab 160mg/ loading dose+80mg/Q2W或ixekizumab 160 mg/ loading dose+80mg/Q4W、安慰劑。結果顯示,24週改善手指與腳趾骨、肌腱滑膜發炎腫脹反應,ixekizumab 80mg/Q2W (65%; 35%)、ixekizumab 80mg/Q4W (78%; 39%)均顯著優於安慰劑(24%; 21%)(all p ≤0.001)。
根據2019年,一篇系統性文獻回顧與網絡統合分析,共收納29篇隨機控制試驗、10204位受試者,17種治療藥物(ixekizumab 80mg/Q2W、ixekizumab 80mg/Q4W、tofacitinib、apremilast、secukinumab 150mg、secukinumab 300mg、brodalumab、guselkumab、ustekinumab 45mg、ustekinumab 90mg、clazakizuamb、abatacept、adalimumab、certolizumab、etanercept、golimumab、infliximab),平均每篇研究追蹤時間為3~15個月15。結果顯示,ixekizumab、ustekinumab、secukinumab、abatacept、certolizumab、tofacitinib、apremilast對於ACR 20反應均顯著高於安慰劑。對於PASI 75乾癬面積暨嚴重度指數下降比率而言,ixekizumab 80mg/Q2W、ustekinumab (90mg and 45mg)、secukinumab 300mg、tofacitinib療效皆優於安慰劑,且ixekizumab、infliximab、adalimumab較其它治療藥物相比,具較高PASI 75反應。在藥物安全性,ixekizumab 80mg/Q2W (1.79 [1.21, 2.65])、tofacitinib (1.42 [1.03, 1.95])、apremilast (1.53 [1.19, 1.97])藥物不良反應發生率均較安慰劑高,但整體嚴重藥物不良反應發生率皆與安慰劑無顯著差異。
玖、結論
利用人類IgG單株抗體,藉由與細胞激素白介素選擇性結合,阻斷其與IL受體交互作用,進而抑制促發炎細胞激素與趨化素釋放,來減緩乾癬性關節炎病灶,已成為乾癬性關節炎治療新趨勢。根據這些臨床試驗結果,藉由ixekizumab單用或併用抗風濕疾病調節藥物,能顯著減緩乾癬性關節炎病灶。因此,ixekizumab不僅是乾癬性關節炎發展新希望,也帶給乾癬性關節炎病人一種治療新選擇。
表三 Ixekizumab用於乾癬性關節炎研究結果
Efficacy of ixekizumab in patients with psoriatic arthritis
Chen-Pei Ho
Department of Pharmacy, Buddhist Tzu Chi General
Hospital
Holistic Education Center, Tzu Chi University of
Science and Technology
Abstract
The monoclonal antibodies therapy has become a crucial modality for psoriatic arthritis treatment. Ixekizumab (Taltz®), an IgG4-monoclonal antibody, has exhibited many beneficial effects in therapy for psoriatic arthritis. It has significantly increased the American College of Rheumatology (ACR) responses criteria, disease activity score, psoriasis area severity index with better compared to those of nonsteroidal anti-inflammatory drugs, corticosteroids or disease-modifying antirheumatic drugs in patients with psoriatic arthritis. Ixekizumab, is a highly expected option for treating patients with psoriatic arthritis.
參考資料:
1. Ocampo DV, Gladman D: Psoriatic arthritis. F1000Res 2019;8:F1000 Faculty Rev-1665.
2. Rech J, Sticherling M, Stoessel D, et al: Psoriatic arthritis epidemiology, comorbid disease profiles and risk factors: results from a claims database analysis. Rheumatol Adv Pract 2020;4(2):rkaa033.
3. 湯夢彬、溫增光、鍾承翰等:乾癬性關節炎。基層醫學2009;24(1):2-7。
4. Veale DJ, Fearon U: The pathogenesis of psoriatic arthritis. Lancet 2018;391(10136):2273-84.
5. Fitzgerald O, Winchester R. Psoriatic arthritis: from pathogenesis to therapy. Arthritis Res Ther. 2009;11(1):214.
6. Gladman DD, Ritchlin C: Pathogenesis of psoriatic arthritis. UpToDate, Waltham, MA. [4 February 2021].
7. 楊媛婷:乾癬性關節炎治療藥物的新趨勢。彰基藥訊2020;28(3):7-10。
8. Gladman DD, Ritchlin C: Clinical manifestations and diagnosis of psoriatic arthritis. UpToDate, Waltham, MA. [4 February 2021].
9. Taylor W, Gladman D, Helliwell P, et al: Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006;54(8):2665-73.
10. Gladman DD, Ritchlin C: Treatment of psoriatic arthritis. UpToDate, Waltham, MA. [4 February 2021].
11. Ixekizumab仿單.
12. UpToDate: Ixekizumab: Drug information. UpToDate, Waltham, MA. [4 February 2021].
13. Mease PJ, van der Heijde D, Ritchlin CT, et al: Ixekizumab, an interleukin-17A specific monoclonal antibody, for the treatment of biologic-naive patients with active psoriatic arthritis: results from the 24-week randomised, double-blind, placebo-controlled and active (adalimumab)-controlled period of the phase III trial SPIRIT-P1. Ann Rheum Dis 2017;76(1):79-87.
14. Gladman DD, Orbai AM, Klitz U, et al: Ixekizumab and complete resolution of enthesitis and dactylitis: integrated analysis of two phase 3 randomized trials in psoriatic arthritis. Arthritis Res Ther 2019;21(1):38.
15. Lu C, Wallace BI, Waljee AK, et al: Comparative efficacy and safety of targeted DMARDs for active psoriatic arthritis during induction therapy: a systematic review and network meta-analysis. Semin Arthritis Rheum 2019;49(3):381-8.
通訊作者:何振珮/通訊地址:花蓮市中央路三段707號
服務單位:佛教慈濟醫療財團法人花蓮慈濟醫院藥學部/聯絡電話:(O) 03-8561825 ext
13097