復發緩解型多發性硬化症的
口服免疫治療
施雅分、廖淑貞、陳薏如
彰化基督教醫院藥學部
摘要
多發性硬化症(Multiple Sclerosis, 簡稱MS)是中樞神經系統的慢性發炎自體免疫性疾病。目前雖沒有治癒MS的療法,但是最重要的是利用疾病緩解治療,降低疾病活動,減少復發的發生和延緩疾病進展,減緩神經功能障礙,並防止病人生活品質下降。目前台灣上市四種口服免疫治療藥品,包括fingolimod、dimethyl fumarate、teriflunomide及cladribine,可以用來治療復發緩解型多發性硬化症;不過每項藥品都有各自的優勢及使用限制,需根據病人個別性進行考量,選擇最適合病人的治療方式,以達到長期持續治療的目標,減緩疾病惡化。
關鍵字: 多發性硬化症、口服免疫治療、fingolimod、dimethyl fumarate、teriflunomide、cladribine
壹、前言
多發性硬化症(Multiple Sclerosis, 簡稱MS)是中樞神經系統的慢性發炎自體免疫性疾病。復發緩解型MS(Relapsing Remitting Multiple Sclerosis, 簡稱RRMS)的特徵是由炎性病變引起的臨床發作或復發,隨後是緩解期,這個過程會反覆發生。目前並沒有治癒MS的療法,最重要的是利用疾病緩解治療(disease modifying therapy, DMT)降低疾病活動,減少復發的發生和延緩疾病進展,減緩神經功能障礙,並防止病人生活品質下降。最早用於治療MS的第1代DMT為注射型interferon β-1b,interferon β-1a和glatiramer acetate,可有效降低復發率和疾病活動性,不過因需固定注射,仍造成病人生活上之不便,故逐步發展口服DMT,現今口服免疫治療已成為復發緩解型多發性硬化症的標準治療,能有效降低了復發率,疾病活動和殘疾進展1。本文介紹台灣已上市的四種口服免疫治療藥品。
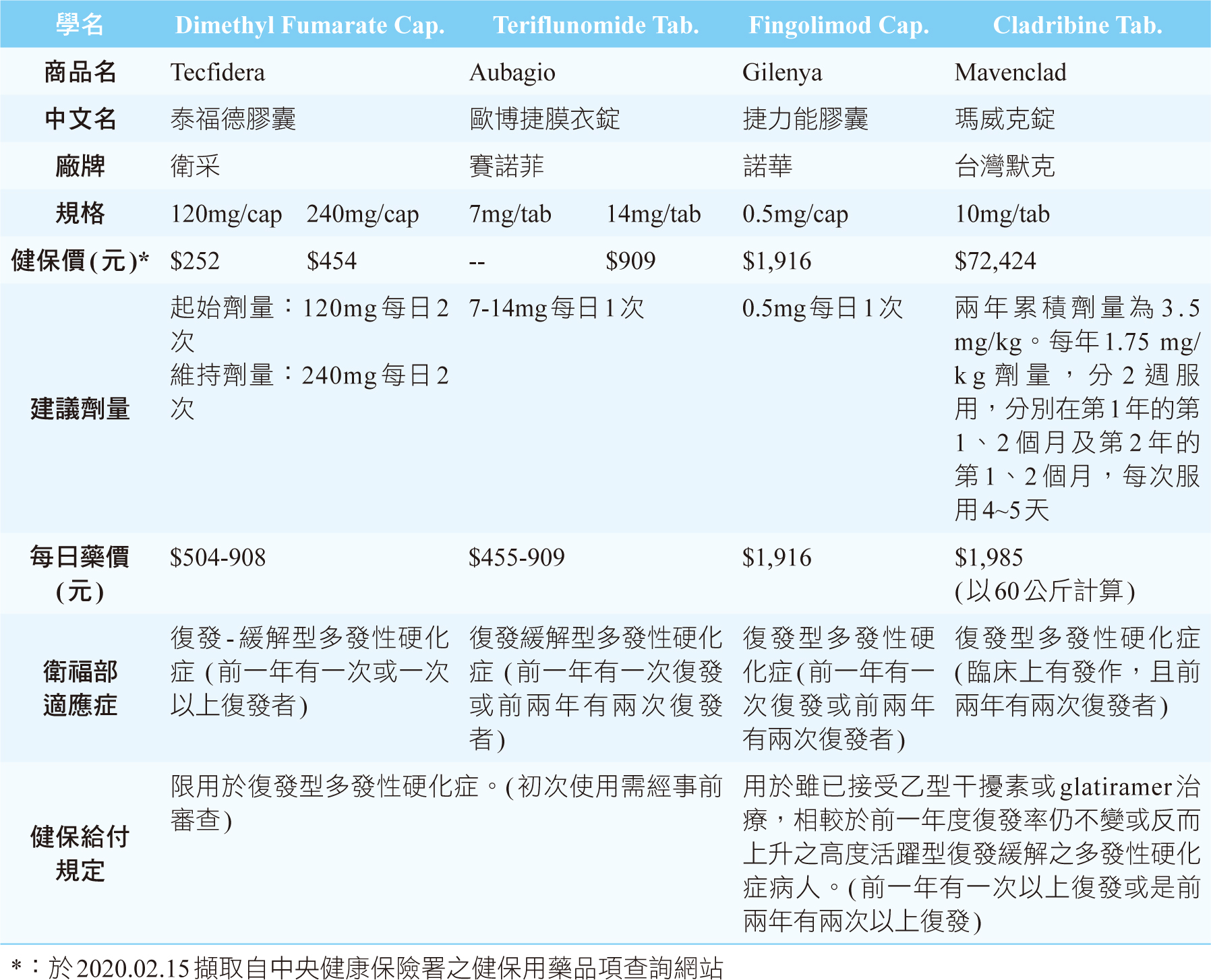
貳、口服免疫治療(表一)
表一 復發緩解型多發性硬化症的口服免疫治療
復發緩解型多發性硬化症的口服免疫治療,各項藥品簡述如下:
一、 Fingolimod Capsules (Gilenya®)2,3
Fingolimod的活性代謝物是淋巴球上S1P(sphingosine 1-phosphate)受體調節劑,阻斷淋巴球自淋巴結中移出,減少週邊血的淋巴球數,藉此減少淋巴球細胞滲透至中樞神經系統引起的去髓鞘作用。建議劑量為每日1次0.5mg,可單獨或與食物併服。
在TRANSFORMS延伸性研究,將原本使用interferon β-1a改成fingolimod,結果顯示相較於interferon β-1a,如改成使用fingolimod後,年復發率降低了50%,也能減少MRI腦部病灶量及延緩腦萎縮4。健保給付為第二線用藥,限用於雖已接受乙型干擾素或glatiramer acetate治療,相較於前一年復發率仍不變或反而上升之高度活躍型復發緩解之多發性硬化症病人。
因開始使用fingolimod會導致心跳速率降低,因而延長QT間隔,禁用於過去六個月曾發生心肌梗塞、不穩定型心絞痛、中風、心臟衰竭、房室傳導完全阻滯、QTc間隔值≧500 msec及有嚴重心律不整的病人。第一次給藥應接受觀察6小時,每小時測量脈搏及血壓,同時在給藥前及觀察6小時後做心電圖檢查。最常見的不良反應為頭痛、流行性感冒、咳嗽、鼻竇炎、腹瀉、背痛和肝指數上升。
對於fingolimod,有2項重要的用藥安全資訊,包括停藥疾病惡化及懷孕畸胎風險。2018/11/20美國食品藥物管理局(Food and Drug Administration, FDA)發布停用fingolimod可能發生失能程度嚴重增加的潛在風險,該不良反應雖罕見但可能導致永久性殘疾,提醒病人停藥風險,且若停藥後發現症狀惡化,應立即尋求醫療協助。2019/7/26歐盟醫藥管理局(European Medicine Agency, EMA)發布fingolimod會對胎兒造成傷害且可能會導致先天性缺陷,建議育齡婦女於治療前必須確認沒有懷孕,且於治療期間及停藥後2個月內必須採取有效的避孕措施5。
二、 Dimethyl fumarate Capsules(Tecfidera®)6
主要的作用機轉尚不清楚,可能是透過活化類紅血球衍生生長因子(nuclear factor- erythroid-derived 2-like 2;Nrf2)的路徑,而達到抗氧化作用,同時具有抗發炎及免疫調節的特性。建議起始劑量為120 mg,每日2次,7天後,增加為240 mg,每日2次,與食物併服可改善潮紅及胃腸道不良反應的發生。
在DEFINE研究,顯示病人發生復發的比例在dimethyl fumarate組(27%)顯著低於安慰劑(46%)(p<0.001);年復發率降低了53%。此外,對於殘疾進展分析,相較於安慰劑,可減少38%(p=0.005)7。在CONFIRM研究,dimethyl fumarate與安慰劑相比,在2年時顯著降低了年復發率44%(p<0.001),殘疾進展也顯示減少了21%8。
接受Dimethyl fumarate治療可能發展為嚴重長期淋巴細胞減少,在中度至嚴重長期淋巴細胞減少的情況下,可能發生JC(John Cunningham)病毒伺機感染腦部,造成進行性多發性腦白質病變(progressive multifocal leukoencephalopathy, PML)可能導致嚴重殘疾或致死。若病人有嚴重感染,應考量暫停用藥。治療前及治療期間,應定期進行全血細胞計數及肝腎功能檢查。最常見的不良反應為潮紅、胃腸道事件(噁心、腹痛、上腹痛、腹瀉)。育齡婦女未使用有效的避孕措施前,皆不建議服用。
三、 Teriflunomide Tablets(Aubagio®)9
Teriflunomide是leflunomide的活性代謝物,具有抗發炎作用的免疫調節劑,減少pyrimidine的合成,確切作用機轉不明,可能與減少中樞神經活化淋巴細胞數目有關。建議劑量為每日1次7 mg或14 mg,可單獨或與食物併服。
在TEMSO為期108週研究證實,與安慰劑相比,teriflunomide 7 mg及14 mg年復發率分別降低31.2%及31.5%,殘疾進展減少23.7%及29.8%,MRI腦部病灶亦有改善,同時減少因復發而需急診或住院的次數。TOWER研究,也證實teriflunomide療效10。另一項隨機雙盲TENERE為期48週研究,結果顯示teriflunomide與interferon β-1a療效相當,病人對於口服的teriflunomide,相較於注射interferon β-1a,有較佳的用藥滿意度11。
Teriflunomide具有肝毒性,禁用於嚴重肝功能不全的病人,故開始治療前與治療期間應監測肝功能。且有潛在的骨髓抑制作用,不建議用於嚴重免疫不全、骨髓疾病或嚴重控制不良感染病人,也不建議接種活性疫苗。另曾發生嚴重的皮膚反應,包括SJS(Stevens-Johnson Syndrome)及TEN(Toxic Epidermal Necrolysis)。最常見的不良反應為頭痛、ALT(Alanine aminotransferase)值上升、腹瀉、掉髮及噁心。根據動物試驗,有致畸胎風險,男性及女性病人皆應採取有效的避孕措施。此藥在最後一次劑量後可能留在血中長達2年,必要時可利用cholestyramine或活性碳加速藥品排出。
四、 Cladribine(Mavenclad®)12
Cladribine為去氧核苷酸類似物,雖然確切作用機轉不明,但是主要的作用被認為是與阻斷T及B淋巴球媒介的免疫過程有關。兩年累積劑量為3.5 mg/kg,於第1年及第2年服用,第3年及第4年不需服藥。每年1.75 mg/kg劑量,分2週服用,分別在第1年的第1、2個月及第2年的第1、2個月,每次服用4~5天,不受食物影響。如與其他口服藥品併用時,需間隔至少3小時。
在CLARITY研究,Cladribine 3.5 mg/kg年復發率顯著低於安慰劑組(0.14 vs. 0.33;p <0.001),無復發率較高(79.7% vs. 60.9%;p <0.001),3個月殘疾進展的風險較低(hazard ratio 0.67;p =0.02),MRI腦部病灶顯著降低(p <0.001)13。健保給付為第二線用藥,限用於雖已接受乙型干擾素或glatiramer acetate治療,相較於前一年復發率仍不變或反而上升之高度活躍型復發緩解之多發性硬化症病人。
Cladribine作用方式與淋巴球數量減少相關,增加感染的可能性,所以在治療前必須排除人類免疫不全病毒、結核病和肝炎的感染,若病人有嚴重感染,應考量暫停用藥。治療前及治療後的第2和第6個月應監測淋巴球數量,當病人淋巴球數量低於500 cells/mm3應主動監測是否有感染的徵兆及症狀。另有較高發生惡性腫瘤的機率,因此禁用於患有進行性惡性腫瘤的病人。常見的不良反應為淋巴球減少症、帶狀疱疹、皮疹及掉髮。男性及女性病人在療程期間及最後一劑後至少6個月內應採取有效的避孕措施。
參、口服免疫治療的選擇
對於治療復發緩解型多發性硬化症的四種口服免疫治療藥品,到底應該選擇哪個藥品呢?依國內健保給付規定,teriflunomide及dimethyl fumarate為第一線用藥,fingolimod及cladribine為第二線用藥(表一)。有一項追蹤平均2.5年研究,直接比較fingolimod(每日1次0.5mg)、dimethyl fumarate(每日2次240 mg)及teriflunomide(每日1次14mg)療效,結果顯示年復發率fingolimod明顯低於dimethyl fumarate(0.2 vs 0.26; p=0.01)及teriflunomide(0.18 vs 0.24; p=0.05),而dimethyl fumarate及teriflunomide兩者間沒有差異(0.19 vs 0.22; p=0.55);至於殘疾進展或改善則3種藥品間沒有差異。再者,fingolimod的治療持續性也明顯優於另2種藥品14。依據國際治療準則,上述三項藥品都可用於復發緩解型多發性硬化症的初始治療,也具有降低復發率及減緩MRI腦部病灶量的療效,而cladribine由於其不良反應,通常用在經接受其他MS治療無效或無法耐受時的第二線療法15。總之,每項藥品都有各自的優勢及使用限制,需依病人的個別性進行考量,包括疾病的嚴重程度、藥品的禁忌及副作用等,且同時須考量病人偏好及價值觀選擇適當的藥品。
肆、結論
口服免疫治療已成為復發緩解型多發性硬化症的標準治療,能有效降低了復發率,疾病活動和殘疾進展,不過仍需根據病人個別疾病的進展情況,藥品不良反應的風險及潛在性疾病等多方面考量,與醫師共同討論選擇最適合病人的治療方式,同時遵循醫囑用藥,以達到長期持續治療的目標,減緩疾病惡化。
Oral Immunotherapies for the Treatment of Relapsing-Remitting Multiple Sclerosis
Ya-Fen Shih, Shu-Chen Liao, Yi-Ju Chen, Su-Yu
Chien
Department of Pharmacy, Changhua Christian
Hospital
Abstract
Multiple sclerosis (MS) is a chronic inflammatory disease of the central nervous system. There's currently no cure for multiple sclerosis, but it's important to treat with disease-modifying therapies (DMTs) that reduce disease activity, reduces the occurrence of relapses, delay disease progression, slows neurological disability and prevents the decline of patients’quality of life. The Taiwan Ministry of Health and Welfare approved four oral immunotherapies (fingolimod, dimethyl fumarate, teriflunomide and cladribine) for the treatment of relapsing remitting MS. Each medicine has its own advantages and restrictions on use. According to the individuality of the patient, select the most appropriate treatment for the patient to achieve long-term continuous treatment and delay disease progression.
參考資料:
1. Ontaneda D, Nicholas J, Carraro M, et al: Comparative effectiveness of dimethyl fumarate versus fingolimod and teriflunomide among MS patients switching from first-generation platform therapies in the US. Mult Scler Relat Disord. 2019 Jan;27:101-111.
2. Pelletier D HD: Fingolimod for multiple sclerosis. N Engl J Med. 2012;366:339-47.
3. Fingolimod: Drug Package Insert. USPI 09-May-2012 & Apr-2014, EMA SmPC Sep-2014, JPPI Mar-2012, IPL-17-May-2018.
4. Cohen JA, Khatri B, Barkhof F, et al: Long-term (up to 4.5 years) treatment with fingolimod in multiple sclerosis: results from the extension of the randomised TRANSFORMS study. J Neurol Neurosurg Psychiatry. 2016 May;87(5):468-75.
5. 衛生福利部食品藥物管理署: Fingolimod藥品安全資訊風險溝通表[cited 2020 Jan 11]. Available from: https://www.fda.gov.tw/tc/siteList.aspx?sid=1571&key=Fingolimod
6. Dimethyl Fumarate: Drug Package Insert. TW201710.
7. Gold R, Kappos L, Arnold DL, et al: Placebo-Controlled Phase 3 Study of Oral BG-12 for Relapsing Multiple Sclerosis. N Engl J Med. 2012 Sep 20;367(12):1098-107.
8. Fox RJ, Miller DH, Phillips JT, et al: Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis. N Engl J Med. 2012 Sep 20;367(12):1087-97.
9. Teriflunomide: Drug Package Insert. TW201706-USPI201611.
10. Guarnera C, Bramanti P, Mazzon E: Comparison of efficacy and safety of oral agents for the treatment of relapsing-remitting multiple sclerosis. Drug Des Devel Ther. 2017 Jul 28;11:2193-2207.
11. Vermersch P, Czlonkowska A, Grimaldi LM, et al: Teriflunomide versus subcutaneous interferon beta-1a in patients with relapsing multiple sclerosis: a randomised, controlled phase 3 trial. Mult Scler. 2014 May;20(6):705-16.
12. Cladribine: Drug Package Insert. TW201906.
13. Giovannoni G, Comi G, Cook S, et al: A placebo – controlled trial of oral cladribine for relapsing multiple sclerosis. N Engl J Med. 2010 Feb 4;362(5):416-26.
14. Kalincik T, Kubala Havrdova E, Horakova D, et al: Comparison of fingolimod, dimethyl fumarate and teriflunomide for multiple sclerosis. J Neurol Neurosurg Psychiatry. 2019 Apr;90(4):458-468.
15. Disease-modifying treatment of relapsing-remitting multiple sclerosis in adults. In: UpToDate, Post TW(Ed), UpToDate, Waltham, MA. (Accessed on February 15, 2020).
通訊作者:施雅分/通訊地址:彰化市南校街135號
服務單位:彰化基督教醫院藥學部/聯絡電話:(O) 04-7238595 ext 3154