兒童r/r B-ALL最新治療藥物
林于婷1、鄭吉元1、蔡慈貞1, 2
1林口長庚紀念醫院藥劑部藥師、2新生醫護管理專科學校長期照護科
摘要
過去二十年,兒童B細胞急性淋巴性白血病(B-ALL)的存活率大幅提高,但仍有2~3%的頑固型患者在初次誘導治療即失敗,以及即使疾病完全緩解後仍有10~15%的患者會復發。傳統上,高強度的化療組合和造血幹細胞移植可用來治療兒童頑固型和復發型(refractory/relapsed,r/r) B-ALL,但其預後不盡理想。近年來,有不少新興藥物被核准用於治療r/r B-ALL,包含化療藥物clofarabine、蛋白酶體抑制劑bortezomib、抗體藥物複合體inotuzumab ozogamicin、免疫治療藥物blinatumomab(BiTE產品)和tisagenlecleucel(CD19 CAR-T 產品)。本文將詳述這些藥物。
關鍵字: 兒童B細胞頑固型/復發型急性淋巴性白血病、clofarabine、bortezomib、blinatumomab、inotuzumab ozogamicin、tisagenlecleucel
壹、 前言
急性淋巴性白血病(acute lymphoblastic leukemia, ALL)是兒童最常見的癌症,好發於0-4歲1。 ALL患者診斷當下其骨髓中有超過20%之分化不成熟的芽細胞 (blast cell)。 ALL依據淋巴細胞表面的免疫分型(immunophenotype),可分為B細胞ALL (B-ALL)和T細胞ALL (T-ALL)。 B-ALL占ALL的85%,而T-ALL占15%2。由於治療計畫推陳翻新以及支持性治療的改善,兒童B-ALL的五年存活率,在美國和台灣分別為89%和81.6%3, 4,其成效顯著。然而,兒童B-ALL仍有2~3%的頑固型患者在初次誘導治療即失敗,以及即使疾病完全緩解後仍有10~15%的患者會復發3, 5, 6。本文將探討兒童頑固型/復發型(refractory/relapsed)B-ALL(r/r B-ALL)之最新治療藥物。
貳、新診斷兒童B-ALL治療簡介
對於新診斷兒童B-ALL患者,依據發病的年紀、白血球的數量、芽細胞的免疫表現特徵、染色體的表現(cytogenetics)和對於初始治療的反應,可預測治療失敗的風險,再藉由風險的評估來決定治療的強度。兒童B-ALL的標準治療包括誘導期、鞏固期和維持期6。依據TPOG ALL 2013年治療指引(TPOG: Taiwan Pediatric Oncology Group protocol)4,共四週誘導期的主要治療藥物包括prednisolone、vincristine、L-asparaginase、epirubicin。針對復發風險高的患者,為預防中樞神經系統復發,需在誘導期及鞏固期給予脊髓腔內(intrathecal)注射methotrexate、cytarabine 及 hydrocortisone。在鞏固期使用高劑量methotrexate (每次劑量大於500 mg/m2)、6-mercaptoprine(6-MP),8至11週後即進入維持期,定期注射及口服抗癌藥物約二至三年,並預防骨髓復發,使用藥物為口服6-MP、methotrexate、vincristine、dexamethasone。非常高危險群則需再加上etoposide、cyclophosphamide、cytarabine。
參、 兒童頑固型/復發型B-ALL(r/r B-ALL)之最新治療藥物
至今,兒童r/r B-ALL治療沒有最佳的治療計畫。在新興藥物問世前,高強度的化療和造血幹細胞移植(hematopoietic stem cell transplantation, HSCT)是這個族群的選擇。除了再次進行誘導期和鞏固期的化療外,需增加為期四週再強化的治療,並且依照病人的風險評估,決定執行造血幹細胞移植或是繼續進行化療。共四週誘導期的主要治療藥物包括prednisolone、vincristine、L-asparaginase、idarubicin。在鞏固期使用dexamethasone、vincristine、高劑量methotrexate、L-asparaginase、cyclophosphamide、etoposide。為期四週的強化期主要治療藥物包含dexamethasone、vincristine、cytarabine、L-asparaginase、高劑量methotrexate。此外,後續還需進行74週的治療,藥物包含有dexamethasone、vincristine、6-MP、methotrexate,以及在不同治療階段多次給予脊髓腔內注射methotrexate、cytarabine 及 hydrocortisone7。40%的兒童r/r B-ALL患者可藉由接受高強度的化療組合和HSCT治療成功,但也顯示這群病人有60%治療失敗甚至死亡8, 9。由此可見,兒童r/r B-ALL仍存在治療不佳的問題。近年來,有不少新興藥物被核准用於治療兒童r/r B-ALL,以下將詳細介紹這些藥物:
一、Clofarabine (Evoltra)
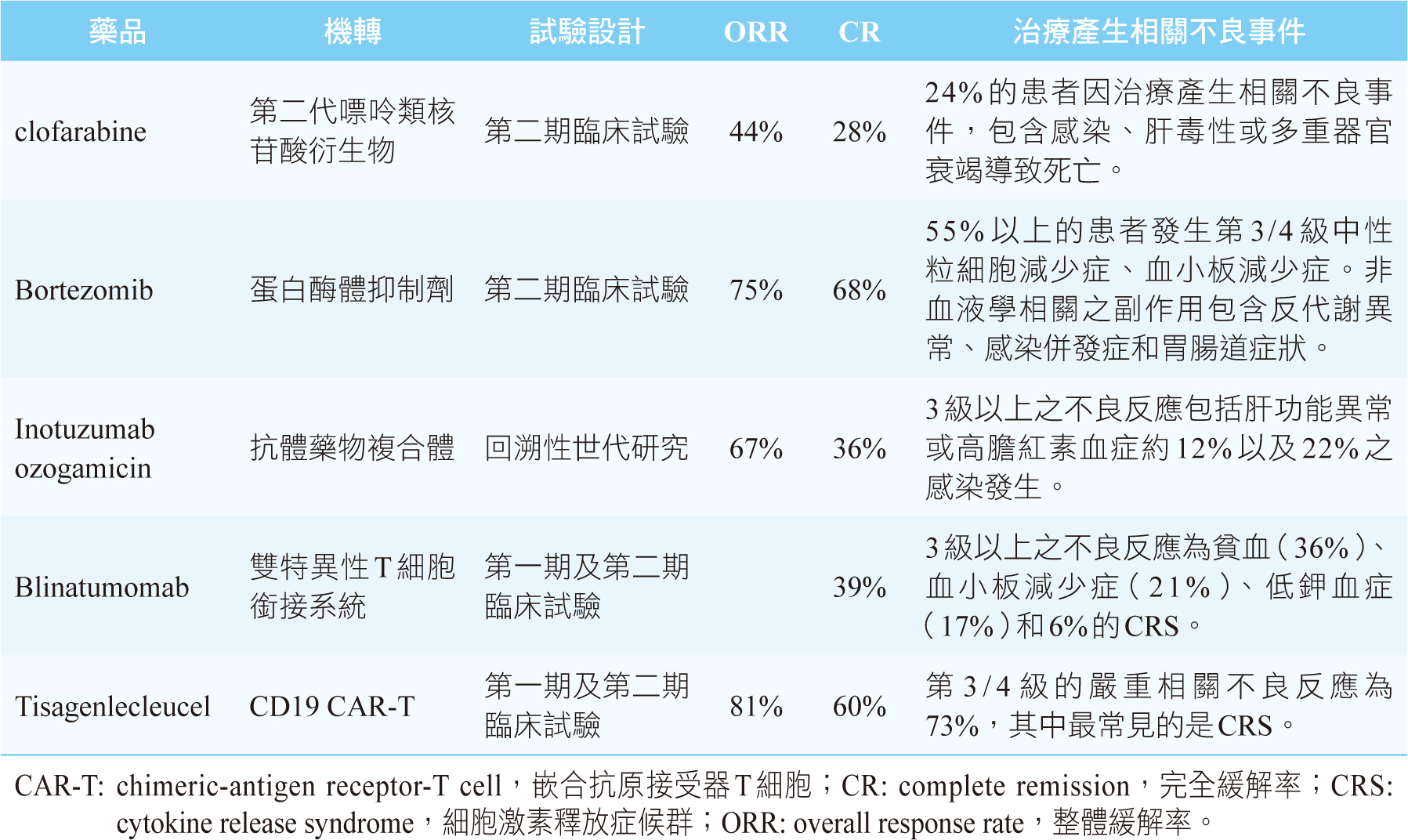
Clofarabine為第二代的嘌呤類核苷酸衍生物(purine nucleoside analog),可阻斷細胞DNA的合成或修復,造成細胞死亡。此藥於2004年經美國食品藥物管理局(FDA)核准用於治療兒童r/r B-ALL。一項第二期臨床試驗,納入25位兒童r/r B-ALL,在誘導期及鞏固期分別給予5天以及4天的clofarabine 40 mg/m2、cyclophosphamide 440 mg/m2和 etoposide 100 mg/m2,結果顯示整體緩解率(overall response rate, ORR)為44%,其中完全緩解率(complete remission, CR)為28%9。在可評估微量殘餘疾病(minimal residual disease, MRD) 之4位患者中,有3位為MRD陰性,即MRD小於0.01%9。緩解持續時間(duration of response,DOR)之中位數為67.3週,中位無事件存活期 (median event-free survival, mEFS)為10.7週9。有24%的患者因治療產生相關不良事件,包含感染、肝毒性或多重器官衰竭導致死亡10。
二、Bortezomib (Velcade)
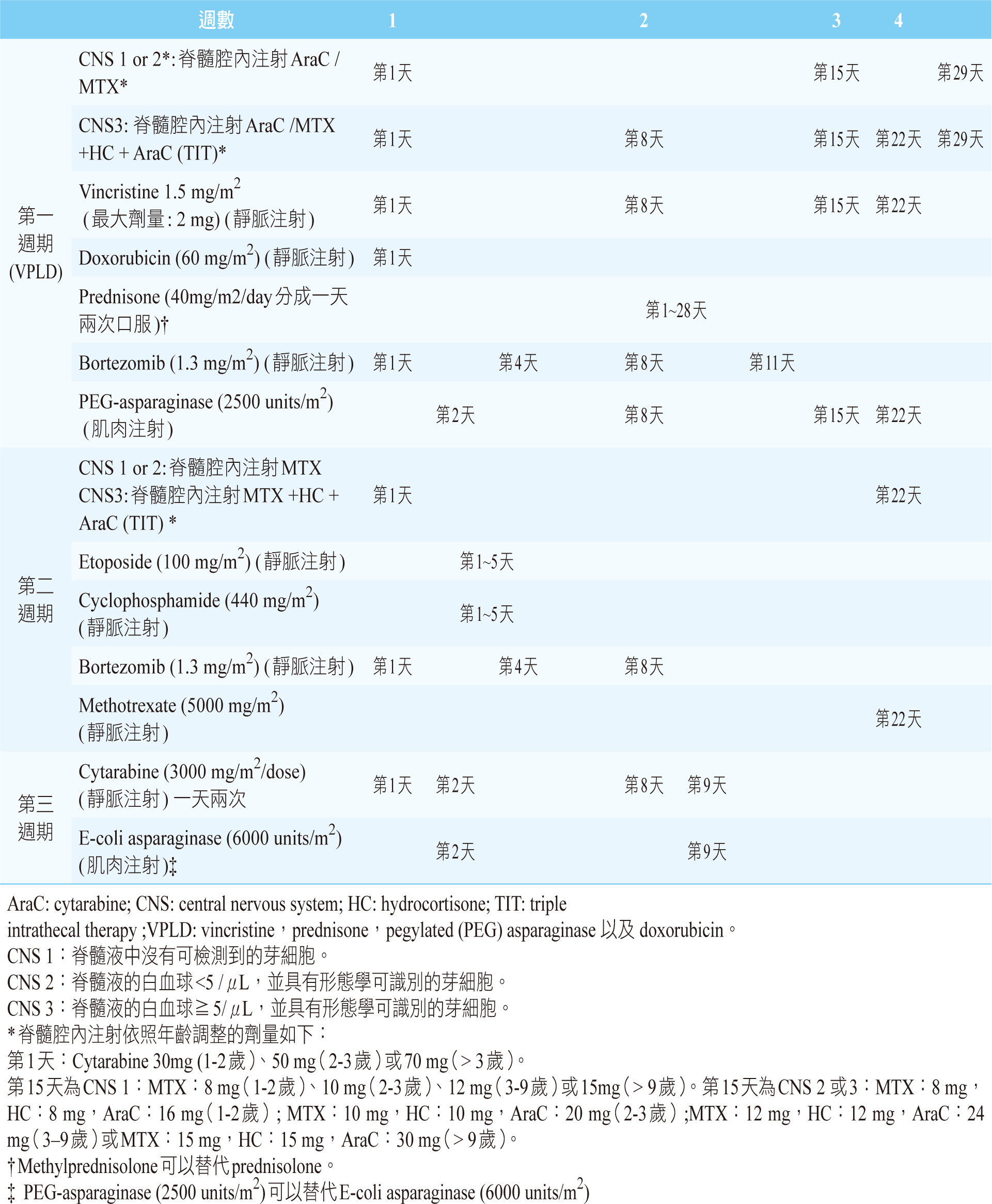
Bortezomib屬於蛋白酶體抑制劑(proteasome inhibitor),是藉由抑制NF-κb (nuclear factor kappa-light-chain-enhancer of activated B cells) 的傳導路徑,導致癌細胞死亡。2019年,美國兒童癌症研究小組(Children's Oncology Group, COG)主導一項研究,將bortezomib合併化療vincristine, doxorubicin, PEG-asparaginase以及類固醇dexamethasone與脊髓腔內注射methotrexate(表一)11。此研究納入135位1~31歲患者,其中103位是復發型B-ALL。結果顯示,針對復發型B-ALL之ORR為75%,其中CR為68%;4個月EFS比率為54%,4個月存活率為83%;早期復發患者之MRD陰性為43%11。135位的患者中,治療相關不良事件包括55%以上的患者發生第3/4級中性粒細胞減少症、血小板減少症。非血液學相關之副作用包含反代謝異常、感染併發症和胃腸道症狀11。
表一 Bortezomib治療計劃書11
三、Inotuzumab ozogamicin (Besponsa)
Inotuzumab ozogamicin(InO)的設計是屬於抗體藥物複合體 ( antibody-drug conjugate),其中inotuzumab為CD22的單株抗體(monoclonal antibody),連接化療藥物ozogamicin。CD22是B-ALL之芽細胞上的表面抗原。InO可辨識CD22並與其鍵結而進入芽細胞內,接著釋放出化療藥物,造成芽細胞的DNA斷裂,最終導致其死亡12。2017年8月,InO獲得FDA核准用於治療成人r/r B-ALL。InO使用在兒童的經驗有限,在台灣尚無使用經驗,一篇發表於2019的回溯性世代研究,探討InO使用在兒童r/r B-ALL的效果及毒性。結果顯示,51位病童之ORR為67%,CR為36%。其中71%的患者達到MRD陰性。在副作用方面,3級以上肝功能損傷或高膽紅素血症約12%; 22%的患者發生第3/4級之感染12。2019年底,InO用在兒童族群之第二期臨床試驗,初步統計至2019年6月30號,納入1~21歲共48位r/r B-ALL兒童。病童接受第一個週期1.8mg / m2的InO(第1天為0.8mg / m2,第8天和第15天為0.5mg / m2),且需依據中樞神經系統復發的狀況評估脊髓腔內注射methotrexate、cytarabine 及 hydrocortisone的給予,並於第28天評估療效。初步結果指出,接受第一個InO週期之ORR為58%,其中有 65.4% 達成MRD陰性。使用InO第1週期中最常見的治療相關不良事件是嗜中性白血球減少症合併高體溫(27%)和感染(18.8%)13。InO用在兒童族群第二期臨床試驗結果已證實其療效和安全性,其第三期研究現正在進行中。期待未來有更多研究來證實InO在兒童族群之有效性及安全性。
四、 Blinatumomab (Blincyto)
Blinatumomab的設計是屬於雙特異性T細胞銜接系統(bi-specific T cell engager, BiTE),它一方面可活化帶有CD3表面抗原的T細胞,另一方面可與B細胞上CD19表面抗原結合,如此可引導T細胞去毒殺帶有CD19 表面抗原的B細胞。所以blinatumomab是CD3/CD19 BiTE。在一項針對18歲以下共49名之兒童r/r B-ALL的第一期及第二期臨床試驗,給予blinatumomab的劑量在前7天為5µg / m2 / day,隨後21天為15 µg / m2 / day,一個週期為28天,接著停藥2週,再進行第2個週期。結果顯示,使用2個週期治療後,CR為39% ( 95% CI 27%~51%),達到完全MRD反應(complete MRD response, 即骨髓細胞檢體測不到芽細胞)為52%( 95% CI 32%~ 71%),無復發中位存活期 (median relapse-free survival, mRFS)為 4.4 個月(95% CI 2.3 ~ 7.6個月),中位存活期(median overall survival, mOS)為7.5個月(95% CI 4.0 ~11.8 個月)14。副作用方面,3級以上之不良反應為貧血(36%)、血小板減少症(21%)、低鉀血症(17%)和6%的細胞激素釋放症候群(cytokine release syndrome, CRS)14。關於blinatumomab的用藥安全,需注意到致死性CRS以及神經毒性。若出現這些副作用,建議中斷、調整劑量或停用blinatumomab,並給予介白素6 (interleukin-6,IL-6)抑制劑tocilizumab以及類固醇治療15(如表二)。
表二 使用Blinatumomab產生 CRS之不良反應的分級和處置15, 16
五、Tisagenlecleucel (Kymriah)
Tisagenlecleucel是屬於CD19 CAR-T產品。CAR-T(chimeric-antigen receptor-T cell,嵌合抗原接受器T細胞)是一種免疫細胞療法,其作法是將患者本身的T細胞利用遺傳工程技術加上能夠辨認腫瘤特定抗原的片段抗體後,再輸注回病人的體內,使其自身的免疫系統活化,攻擊腫瘤細胞。研究發現,B細胞上特有的表面抗原CD19會在r/r B-ALL族群中大量表現,於是研發可對抗CD19的CAR-T。在一項第二期研究中,共納入75位年齡3~23歲的患者,使用CD19 CAR-T產品tisagenlecleucel追蹤3個月,結果發現ORR為81%,其中60%患者達CR;追蹤至第6個月時, EFS比率和OS比率分別為73%、90%;追蹤至第12個月時,EFS比率和OS比率分別為50%、76%17。副作用方面,第3/4級的嚴重相關不良反應為73%,其中最常見的是CRS,占所有嚴重不良反應的77%,其中48%的患者接受tocilizumab治療;神經系統相關不良事件發生率為40%,患者需接受支持治療,但無腦部水腫發生17 。Tisagenlecleucel於2017年8月取得美國FDA 核准用於小於25歲的r/r B-ALL患者18。面對此新療法,在藥師端需要關注病人用藥之不良反應,收集藥品相關安全資訊。對於嚴重不良反應發生時,尤其是CRS和神經毒性,能及時提供治療的建議以及通報藥品不良反應。
肆、 結語
對於兒童r/r B-ALL的治療,由於副作用的考量,傳統細胞毒性藥物不建議進行劑量的再提高。近年來,有不少新興藥物被核准用於治療r/r B-ALL (表三),包含化療藥物clofarabine、蛋白酶體抑制劑bortezomib、抗體藥物複合體inotuzumab ozogamicin、免疫治療藥物blinatumomab(BiTE產品)和tisagenlecleucel(CD19 CAR-T 產品)。這些藥物的加入,確實提升了兒童r/r B-ALL的治療成效。未來如何將這些新興藥物加入標準治療以發揮協同作用,以及在其安全劑量下達到最大療效,則需要更多研究以及真實世界的證據來解答。
表三 兒童頑固型/復發型之最新治療藥物
Novel Therapies for Pediatric Refractory/Relapsed B-cell Acute Lymphoblastic Leukemia (B-ALL)
Yu-Ting Lin1, Chi-Yuan Cheng1, Tzu-Cheng Tsai1,
1Department of Pharmacy, Chang Gung Memorial
Hospital, Linkou
2Department of Long Term Care, Hsin Sheng
College of Medical Care and Management
Abstract
In the past two decades, the survival rate of childhood B-cell acute lymphoblastic leukemia (B-ALL) had increased significantly. However, 2 to 3% of refractory patients were still found treatment failure after the first induction therapy; 10 to 15% of patients had disease relapsed even complete remission achieved. Traditionally, a combination of high-intensity chemotherapy and hematopoietic stem cell transplantation was used to treat pediatric refractory/relapsed (r/r) B-ALL, but its prognosis was not good enough. In recent years, a bunch of novel drugs had been approved for the treatment of pediatric r/r B-ALL, including the cytotoxic drug clofarabine, the proteasome inhibitor bortezomib, the antibody conjugate inotuzumab ozogamicin, the immunotherapies with BiTE blinatumomab and CD19 CAR-T tisagenlecleucel. This article will discuss these medications in detail.
參考資料:
1. Katz AJ, Chia VM, Schoonen WM, et al. Acute lymphoblastic leukemia: an assessment of international incidence, survival, and disease burden. Cancer Causes Control. 2015;26(11):1627-1642.
2. Bhojwani D, Yang JJ, Pui CH. Biology of childhood acute lymphoblastic leukemia. Pediatric clinics of North America. 2015;62(1):47-60.
3. Brown P, Inaba H, Annesley C, et al. Pediatric Acute Lymphoblastic Leukemia, Version 2.2020, NCCN Clinical Practice Guidelines in Oncology. Journal of the National Comprehensive Cancer Network : JNCCN. 2020;18(1):81-112.
4. Li MJ, Liu HC, Yen HJ, et al. Treatment for childhood acute lymphoblastic leukemia in Taiwan: Taiwan Pediatric Oncology Group ALL-2002 study emphasizing optimal reinduction therapy and central nervous system preventive therapy without cranial radiation. Pediatr Blood Cancer. 2017;64(2):234-241.
5. Khan M, Siddiqi R, Tran TH. Philadelphia chromosome-like acute lymphoblastic leukemia: A review of the genetic basis, clinical features, and therapeutic options. Semin Hematol. 2018;55(4):235-241.
6. Santiago R, Vairy S, Sinnett D, et al. Novel therapy for childhood acute lymphoblastic leukemia. Expert Opin Pharmacother. 2017;18(11):1081-1099.
7. Parker C, Waters R, Leighton C, et al. Effect of mitoxantrone on outcome of children with first relapse of acute lymphoblastic leukaemia (ALL R3): an open-label randomised trial. The Lancet. 2010;376(9757):2009-2017.
8. Arakawa A. Relapsed Pediatric ALL. In Kato M, (Ed). Pediatric Acute Lymphoblastic Leukemia 2020:123-139.
9. Tallen G, Ratei R, Mann G, et al. Long-term outcome in children with relapsed acute lymphoblastic leukemia after time-point and site-of-relapse stratification and intensified short-course multidrug chemotherapy: results of trial ALL-REZ BFM 90. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2010;28(14):2339-2347.
10. Hijiya N, Thomson B, Isakoff MS, et al. Phase 2 trial of clofarabine in combination with etoposide and cyclophosphamide in pediatric patients with refractory or relapsed acute lymphoblastic leukemia. Blood. 2011;118(23):6043-6049.
11. Horton TM, Whitlock JA, Lu X, et al. Bortezomib reinduction chemotherapy in high-risk ALL in first relapse: a report from the Children's Oncology Group. Br J Haematol. 2019;186(2):274-285.
12. Bhojwani D, Sposto R, Shah NN, et al. Inotuzumab ozogamicin in pediatric patients with relapsed/refractory acute lymphoblastic leukemia. Leukemia. 2019;33(4):884-892.
13. O'Brien M, Ji L, Shah N, et al. A Phase 2 Trial of Inotuzumab Ozogamicin (InO) in Children and Young Adults with Relapsed or Refractory (R/R) CD22+ B-Acute Lymphoblastic Leukemia (B-ALL): Results from Children's Oncology Group Protocol AALL1621. Blood. 2019;134:741-741.
14. von Stackelberg A, Locatelli F, Zugmaier G, et al. Phase I/Phase II Study of Blinatumomab in Pediatric Patients With Relapsed/Refractory Acute Lymphoblastic Leukemia. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2016;34(36):4381-4389.
15. Jain T, Litzow MR. No free rides: management of toxicities of novel immunotherapies in ALL, including financial. Hematology Am Soc Hematol Educ Program. 2018;2018(1):25-34.
16. Frey NV, Porter DL. Cytokine release syndrome with novel therapeutics for acute lymphoblastic leukemia. Hematology Am Soc Hematol Educ Program. 2016;2016(1):567-572.
17. Maude SL, Laetsch TW, Buechner J, et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. The New England journal of medicine. 2018;378(5):439-448.
18. Pehlivan KC, Duncan BB, Lee DW. CAR-T Cell Therapy for Acute Lymphoblastic Leukemia: Transforming the Treatment of Relapsed and Refractory Disease. Current hematologic malignancy reports. 2018;13(5):396-406.
通訊作者:林于婷/通訊地址:桃園市龜山區復興街五號
服務單位:林口長庚紀念醫院藥劑部/聯絡電話:(O) 0978835358