抗體藥物複合體抗癌藥的進展
鄭吉元1、蔡慈貞1,2、張文震3
1林口長庚紀念醫院藥劑部藥師
2新生醫護管理專科學校兼任講師
3林口長庚紀念醫院腫瘤科醫師
摘要
抗體藥物複合體 (antibody-drug conjugate,ADC) 抗癌藥的結構包括:單株抗體—連接子—化療藥物,透過連接子 (linker) 將抗體和藥物相連,其作用機轉是單株抗體 (mAb) 先與癌細胞表面特定的腫瘤抗原結合,然後內吞進入癌細胞內再釋出藥物以毒殺癌細胞。由於ADC抗癌藥兼具抗體專一性和強效化療藥物,因而治療癌症療效佳。截至目前有8個ADC抗癌藥經美國FDA核准上市,其中4個有取得台灣衛福部許可證,分別是Adcetris、Kadcyla、Besponsa、Polivy。mAb絕大多數是人源化 (humanized) 和全人源 (fully human) mAb。最常用的連接子是胜肽 (peptide)。化療藥物最常見的是auristatin中的MMAE (monomethyl auristatin E) 以及maytansine中的emtansine (DM1)。ADC抗癌藥的未來挑戰主要是抗藥性、實體腫瘤的可近性和穿透性以及ADC藥品異質性 (heterogeneity)。
關鍵字: 抗體藥物複合體、antibody-drug conjugate
壹、前言
化療藥物 (chemotherapy) 在癌症治療上占有重要一席,此法雖可殺死癌細胞,但也會傷害正常細胞,正如《孫子兵法》中說的:「殺敵一萬,自損三千。」一些在體外和動物實驗發現對癌細胞毒性甚強、效果奇佳的化合物卻無法用於人體,而可以用於治療癌症病人的化療藥物,也因最大容忍劑量 (maximum tolerated dose,MTD) 限制其療效;另一方面,單株抗體雖然能精準辨識腫瘤抗原,但單獨使用抗癌效果不佳,往往需合併化療藥物。因此,抗體藥物複合體 (antibody-drug conjugate,ADC) 能夠結合兩者優點,彌補不足之處,增加藥物作用效果和安全性。
貳、ADC抗癌藥的結構及其作用機轉
ADC抗癌藥的結構包括:單株抗體—連接子—化療藥物,透過連接子 (linker) 將抗體和藥物相連。每個單株抗體上能攜帶的藥物數量,即DAR (drug-to-antibody ratio),DAR越大表示攜帶的藥物數量越多1。ADC的作用機轉是單株抗體 (mAb) 先與癌細胞表面特定的腫瘤抗原結合,然後內吞 (internalization) 進入癌細胞內再釋出藥物以毒殺癌細胞1。利用mAb辨識腫瘤抗原的專一性來引導化療藥物,較能夠避免誤殺到正常細胞,如此可降低化療藥物的全身副作用。ADC結構中的小分子藥物,常被稱為「payload」意指飛彈攜帶的爆炸物或「warhead」意指 (炸彈或飛彈的) 彈頭,又ADC被稱為「神奇子彈 (magic bullet)」或「聰明炸彈 (smart bomb)」,這可由其作用機轉略見一斑了。有關ADC組成之mAb、連接子和化療藥物的詳細說明,見本文之「肆」。
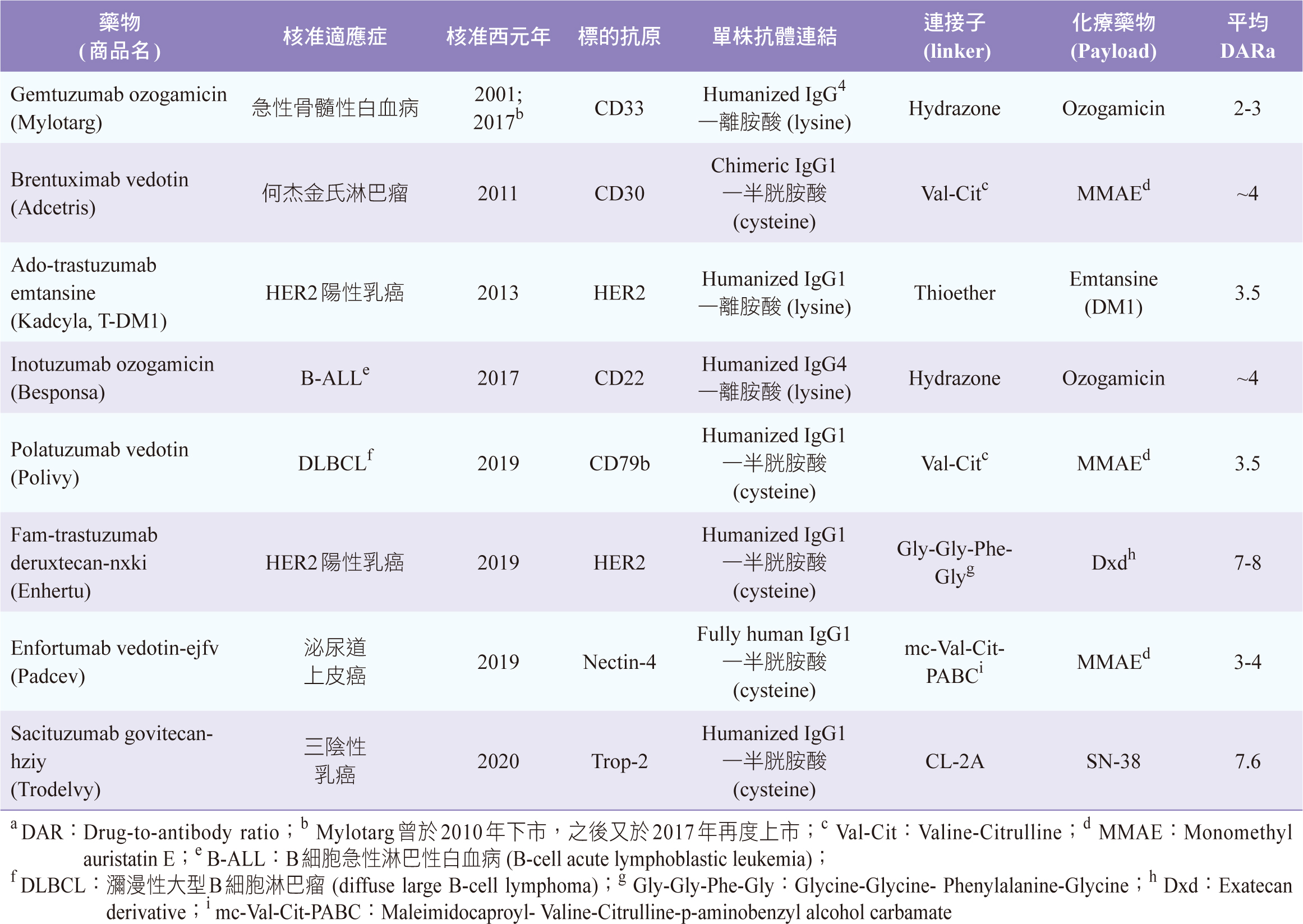
參、核准上市的ADC抗癌藥2,3
截至目前有8個ADC抗癌藥經美國FDA核准上市 (表一),其中4個有取得台灣衛福部許可證,分別是Adcetris、Kadcyla、Besponsa、Polivy。用於血液科癌症有4個ADC,4項適應症;用於實體腫瘤有4個ADC,3項適應症;皆是用於後線治療。目前核准上市的ADC抗癌藥,其(1)mAb絕大多數是人源化 (humanized) mAb,即抗體架構來源90-95%來自人類,5-10%來自老鼠;大部分mAb是以半胱胺酸 (cysteine) 和連接子—化療藥物連結;(2)最常用的連接子是胜肽 (peptide),即胺基酸組成的短鏈,例如:纈胺酸-瓜胺酸(Valine-Citrulline,Val-Cit);(3)化療藥物幾乎都是選用毒殺細胞作用非常強的小分子藥物,例如:monomethyl auristatin E (MMAE)、Emtansine (DM1);若是選擇強度稍弱的化療藥物,則會提高DAR,表一中Enhertu和Trodelvy的DAR可達將近8。
表一 美國FDA核准上市的ADC抗癌藥2,3
肆、ADC抗癌藥的進展
目前ADC的發展多數是用於治療癌症,其他用途主要是自體免疫疾病,例如:類風濕性關節炎、多發性硬化症2。以下將從四方面來說明ADC抗癌藥的進展:
一、腫瘤抗原的選擇
mAb辨識的腫瘤抗原需符合(1)高度表現在癌細胞上,而正常細胞不表現或低表現。例如:HER2陽性癌症,其癌細胞上HER2表現是正常細胞的100倍4;(2)mAb和抗原結合後能藉胞吞作用 (endocytosis),將ADC內吞入癌細胞內。除了熟知的HER2、CD19、CD33等,文獻指出有328種抗原可當作標的抗原的選項4。許多腫瘤相關抗原或多或少也會在正常細胞上表現,未來找出嶄新可用的腫瘤專一性抗原是ADC發展重點之一。
二、mAb
ADC抗癌藥結構中mAb的功能是與腫瘤抗原結合,如此有標靶治療的特性;此外,mAb本身也有治療效果,像是抗體依賴型細胞介導的細胞毒性作用 (antibody-dependent cell-mediated cytotoxicity,ADCC)和補體依賴型細胞毒性作用 (complement-dependent cytotoxicity,CDC)。ADC中mAb應具備(1)抗原專一性;(2)結合抗原的親和力 (affinity) 高;(3)免疫原性 (immunogenicity) 低,免疫原性是指mAb誘發免疫排斥使得mAb藥效難以維持,人源化和全人源 (fully human) mAb的免疫原性低。mAb結合抗原的親和力也不能太強,因為親和力太強會造成大量ADC聚集在腫瘤處但卻不易進入腫瘤內5,以及考量到許多腫瘤相關抗原或多或少也會在正常細胞上表現,若親和力太強會連帶傷害到正常細胞;因此,將親和力減弱些可增進mAb對癌細胞的選擇性以減低正常細胞的毒性。
雙特異性 (bispecific) ADC的設計,即一個mAb可結合兩個不同的抗原。體外實驗顯示,結合c-MET和EGFR的雙特異性ADC能夠有效的殺死c-MET和EGFR過度表現的癌細胞,也可降低帶有EGFR表現之正常細胞的毒性6。人類乳癌細胞實驗也發現,結合HER2和PRLR ( prolactin receptor,泌乳素受體) 的雙特異性ADC殺死乳癌細胞的效果比HER2 ADC或PRLR ADC都要來得好4。雙特異性ADC正在開發中,期盼能增加ADC對癌細胞的選擇性以及抗癌療效。
由於mAb的分子量大,如此大分子並不容易到達實體腫瘤部位或至腫瘤內部,研究發現,ADC真正釋放在癌細胞內的小分子藥物劑量只有投予小分子藥物劑量的1.56%7。另一項研究也發現,注射至人體的ADC,只有0.001%-0.01%的量可以真正結合在癌細胞上4。和全長mAb相比,將mAb砍半有更好的抗腫瘤活性4。因此,ADC中mAb的設計將趨向小型化4,期望對實體腫瘤有更佳療效。
三、連接子 (linker)
連接子必須在血液中穩定存在,以避免藥物過早釋放造成毒性;而當ADC進入癌細胞內又必須斷開連接子以迅速釋放藥物。連接子有兩類—不可裂解 (non-cleavable) 和可裂解 (cleavable),詳述如下:
(一) 不可裂解的連接子 (non-cleavable linker,NL)
此類連接子的作用機轉是當ADC內吞進入癌細胞後,mAb被溶酶體(lysosome) 分解導致留下帶有連接子的藥物。NL並不常用,Kadcyla的連接子thioether即屬於NL。
(二) 可裂解的連接子 (cleavable linker,CL)
CL是ADC主要的連接子。CL在血液循環中維持穩定狀態,當ADC進入癌細胞內,會因酸鹼值 (pH)、細胞電位的改變或是特定酵素而斷開連接子,於是藥物被釋放。其中最常被使用的CL是胜肽,其中又以Val-Cit最常見4。胜肽連接子會被細胞內的組織蛋白酶B (cathepsin B) 分解,此酵素會高度表現於癌細胞4。
胜肽連接子再連接PABC (表一的Padcev) 的目的是增加ADC親水性 (hydrophilic),如此可降低ADC的抗藥性4。癌細胞可藉由上調多重抗藥性基因 (multidrug resistance gene 1,MDR1)的表現而產生抗藥性4。此基因轉譯的MDR1蛋白對厭水性 (hydrophobic) 藥物的親和力高。因此,增加ADC的親水性可降低抗藥性。
四、化療藥物
目前,ADC結構中的化療藥物主要有三類:微小管 (microtubule) 抑制劑、造成DNA損害的藥物、轉錄 (transcription) 抑制劑。由於ADC能夠進入細胞內的量非常低,因此化療藥物幾乎都是選用毒殺細胞作用非常強的小分子藥物;也可選擇強度稍弱的化療藥物,但需提高DAR。DAR越高,細胞毒殺作用越強,但在體內越容易被清除,使得半生期越短4。
(一) 微小管抑制劑
抑制微小管的聚合可造成細胞週期停止在G2/M期導致細胞死亡。屬於此類藥物最常見的是auristatin中的MMAE與MMAF (monomethyl auristatin F) 以及maytansine中的emtansine (DM1) 與ravtansine (DM4),它們毒殺細胞作用非常強,作用強度是一般化療藥物的1000倍。此外,新穎的微小管抑制劑tubulysin也正在進行臨床試驗4。
(二) 造成DNA損害的藥物
包括calicheamicin中的ozogamicin、duocarmycin、拓樸異構酶 (topoisomerase) 抑制劑中的SN-38與Dxd、pyrrolobenzodiazepine (PBD) 中的tesirine與talirine、indolinobenzodiazepine (IGN) 中的DGN5494。PBD的作用強度極強,是auristatin或maytansine的1000倍,PBD適用於有腫瘤專一性抗原或腫瘤抗原高度表現在癌細胞上的癌症8。PBD也較不會產生抗藥性4。目前有六個ADC臨床試驗是以PBD為化療藥物,分別為ADCT-601 (標的抗原是Axl)、ADCT-402 (CD19)、Camidanlumab tesirine (CD25)、ADCT-401 (PSMA)、DHES0815A (HER2)、MED17247 (ASCT2)8。拓樸異構酶抑制劑的作用強度稍弱,適用於該腫瘤抗原也相當程度表現在正常細胞上。
(三) 轉錄 (transcription) 抑制劑
轉錄是由DNA到mRNA的過程,需要RNA聚合II (RNA polymerase II)。α-amanitin可抑制RNA聚合II而造成細胞死亡8。此外,RNA剪接 (RNA splicing) 抑制劑thailanstatin A和spliceostatin C也有很強的細胞毒殺作用4。此機轉的藥物皆處在臨床前實驗階段。
伍、 國內核准上市ADC抗癌藥的療效及安全性
目前國內核准上市ADC抗癌藥有4個,其療效及安全性分別簡述如下:
一、Brentuximab vedotin (Adcetris)
治療復發型或頑固型何杰金氏淋巴瘤的整體反應率可達75% 9。常見的副作用有周邊神經病變、噁心、疲倦、嗜中性白血球低下及腹瀉9。
二、Ado-trastuzumab emtansine (Kadcyla,T-DM1)
乳癌治療在後線給予T-DM1,相較於lapatinib併用capecitabine,T-DM1不論在無惡化存活期 (progression-free survival,PFS) 和整體存活期 (overall survival,OS) 皆明顯優於後者 (PFS:9.6個月 vs. 6.4個月,HR 0.65,p < 0.001;OS:30.9個月 vs. 25.1個月,HR 0.68,p < 0.001) 10。T-DM1主要的副作用是血小板低下和肝功能異常10。
三、Inotuzumab ozogamicin (Besponsa)
治療復發型或頑固型B細胞急性淋巴性白血病的完全緩解率可達80.7%11。副作用方面,大於3級以上之不良反應最常見的是嗜中性白血球低下合併發燒 (11%) 以及肝臟小靜脈閉塞疾病 (veno-occlusive disease) (9%) 11。
四、Polatuzumab vedotin (Polivy)
治療復發型或頑固型瀰漫性大型B細胞淋巴瘤,Polivy併用bendamustine及rituximab,相較於bendamustine併用rituximab,前者之完全緩解率明顯優於後者 (40.0% vs. 17.5%,p = 0.026),且加入Polivy可降低58%死亡風險12。主要的副作用包括嗜中性白血球低下、貧血、血小板低下、感染及周邊神經病變12。
陸、ADC抗癌藥的未來挑戰
ADC抗癌藥需結合mAb、連接子和化療藥物,複雜度高,進入人體後的變數大。未來挑戰主要是抗藥性、實體腫瘤的可近性和穿透性、ADC藥品異質性 (heterogeneity)。抗藥性機轉包括:MDR1表現增加、微小管組成改變、腫瘤抗原不表現或低表現、ADC與腫瘤抗原結合後無法內吞進入癌細胞內等4。針對抗藥性的對策有增加ADC和連接子的親水性、選擇不易產生抗藥性的化療藥物 (例如PBD)等。另外,Centrose公司最近發展「細胞外藥物複合體 (exracellular drug conjugate,EDC」,EDC的組成也是抗體、連接子和藥物,和ADC最大的差異是EDC不需進入癌細胞內即可殺死癌細胞,目前EDC還在臨床前實驗階段13。將mAb小型化,期望能改善對實體腫瘤的可近性和穿透性。至於ADC藥品異質性也是需要解決的難題:傳統上,ADC是使用mAb結構中的半胱胺酸或離胺酸和連接子—化療藥物連結,此方式使得每個mAb上連結的化療藥物數目是不固定的。以Mylotarg為例,只有50%的mAb和連接子—化療藥物相連,連結藥物數目平均2-3個,但實際上卻是1-8個不等14,這樣的異質性是造成臨床使用時療效不穩定的原因之一。目前朝向利用基因工程採專一性結合點連結 (site-specific conjugation),例如:利用基因工程在mAb上額外連上半胱胺酸做為專一性結合點位置,如此可提高ADC的同質性 (homogeneity)15。
柒、結論
近年來,ADC抗癌藥快速成長,除了已上市的8個藥物外,目前有關ADC抗癌藥在全球有91項臨床試驗和超過200項臨床前實驗正在進行中8。由於ADC抗癌藥兼具抗體專一性和強效化療藥物,因而治療癌症療效佳。不過,ADC抗癌藥也面臨諸多挑戰,未來開發重點包括:抗體和小分子化療藥物的接合更為穩定、朝向專一性結合點連結以提高ADC的同質性、連接子在血液循環中的穩定性、開發新潁有效的化療藥物、抗體的小型化、標的腫瘤抗原更具專一性、抗藥性機轉的深入瞭解及突破。
Advancements in Antibody-Drug Conjugates for Cancer Therapy
Chi-Yuan Cheng1, Tzu-Cheng Tsai1,2, Wen-Cheng
Chang3
1Department of Pharmacy, Chang Gung Memorial
Hospital, Linkou
2Department of Long Term Care, Hsin Sheng Junior
College of Medical Care and Management
3Department of Oncology, Chang Gung Memorial
Hospital, Linkou
Abstract
Antibody-drug conjugate (ADC) is composed of the monoclonal antibody (mAb), the cytotoxic drug (chemotherapy), and the linker connects the cytotoxic drug to the mAb. Mechanism of action of the ADC is the mAb binds to the target antigen present on the tumor cell surface, and then internalization into the tumor cell, where the cytotoxic drug being released to kill the tumor cell. Owing to specificity of the mAb and the potent chemotherapy, ADC shows clear benefit in cancer treatment. To date, 8 ADCs are in clinical use approved by US FDA for treating cancers, and 4 of them are approved by TFDA, namely Adcetris, Kadcyla, Besponsa and Polivy. The vast majority of mAbs used in ADC are humanized and fully human mAbs. Peptide-based linkers are the most commonly used in ADC. MMAE in aurisatin class of drug and emtansine (DM1) in maytansine class of drug are the most widely used cytotoxic drugs in ADC design. The future challenges of ADCs for cancer therapy are the acquired resistance, tumor antigen accessibility, tumor penetration and heterogeneity of ADCs.
參考資料:
1. Thomas A, Teicher BA, Hassan R: Antibody-drug conjugates for cancer therapy. Lancet Oncol 2016;17:e254-62.
2. Gingrich J: How the next generation antibody drug conjugates expands beyond cytotoxic payloads for cancer therapy. J ADC 2020 April 7.
3. Goldenberg DM, Cardillo TM, Govindan SV, et al: Trop-2 is a novel target for solid cancer therapy with sacituzumab govitecan (IMMU-132), an antibody-drug conjugate (ADC). Oncotarget 2015;6:22496-512.
4. Khongorzul P, Ling CJ, Khan FU, et al: Antibody–drug conjugates: A comprehensive review. Mol Cancer Res 2020;18:3-19.
5. Tsumura R, Manabe S, Takashima H, et al: Influence of the dissociation rate constant on the intra-tumor distribution of antibody–drug conjugate against tissue factor. J Control Rel 2018;284:49–56.
6. Sellmann C, Doerner A, Knuehl C, et al: Balancing selectivity and efficacy of bispecific epidermal growth factor receptor (EGFR) × c-MET antibodies and antibody–drug conjugates. J Biol Chem 2016;291:25106–19.
7. Teicher BA, Chari RVJ: Antibody conjugate therapeutics: challenges and potential. Clin Cancer Res 2011;17:6389-97.
8. Mysliwy J: Advancements in antibody–drug conjugate technology for cancer treatment. Future Drug Discov 2020;2(2):FDD35.
9. Younes A, Gopal AK, Smith SE, et al: Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin's lymphoma. J Clin Oncol 2012;30:2183-9.
10. Verma S, Miles D, Gianni L, et al: Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012;367:1783-91.
11. Kantarjian HM, DeAngelo DJ, Stelljes M, et al: Inotuzumab ozogamicin versus standard therapy for acute lymphoblastic leukemia. N Engl J Med 2016;375:740-53.
12. Sehn LH, Herrera AF, Flowers CR, et al: Polatuzumab vedotin in relapsed or refractory diffuse large B-cell lymphoma. J Clin Oncol 2020;38:155-65.
13. Exracellular drug conjugate (EDC). Available from: https://www.centrosepharma.com. Accessed May 18, 2020.
14. Bornstein GG: Antibody drug conjugates: preclinical considerations. AAPS J 2015;17:525-34.
15. Dickgiesser S, Kellner R, Kolmar H, et al: Site-specific conjugation of thiol-reactive cytotoxic agents to nonnative cysteines of engineered monoclonal antibodies. Method Mol Biol 2019;2033:1-14.
通訊作者:鄭吉元/通訊地址:桃園市龜山區復興街五號林口長庚醫院病理大樓6樓化療藥局
服務單位:林口長庚紀念醫院藥劑部/聯絡電話:(O) 0975367860