BRCA突變卵巢癌標靶新藥:Olaparib
楊軍建1、石祐安1、歐盈如2、黃微瑄1、張秀美1
1高雄市立大同醫院藥學科藥師、2高雄醫學大學附設中和紀念醫院藥學部藥師
摘要
卵巢癌是臺灣常見的婦科癌症,傳統的療法為鉑金類烷基化藥物(alkylating agents),病人除須忍受傳統化療伴隨之不適症狀外,逾50%病人的腫瘤大多在三年內復發。近年來poly (ADP-ribose) polymerase (PARP)抑制劑被認為是治療卵巢癌的重要策略之一,其可干擾癌細胞的DNA修復,抑制癌細胞生長。Olaparib為臺灣FDA唯一核准且獲得健保給付之PARP抑制劑,對於BRCA1/2基因變異且先前使用含鉑藥物敏感且復發之高度卵巢癌、輸卵管癌或原發性腹膜癌之病人,文獻證實可顯著延長無惡化存活期。Olaparib透過合成致死之機轉增加病人存活期也降低抗藥性的發生,是一嶄新對抗卵巢癌的新剋星。
關鍵字: Olaparib、PARP抑制劑、卵巢癌、合成致死
壹、前言
卵巢癌是女性最致命的癌症,素有女性的『寧靜殺手』之稱。根據美國國家癌病署統計,2018年全球平均每年新增約24萬名卵巢癌病人,列全球女性常見癌症疾病第七位。卵巢癌早期無徵兆不易被診斷,超過7成以上的病人確診時已進入晚期病程,5年存活率剩不到5成1;在臺灣,2019年卵巢癌已然超越子宮頸癌名列女性國人癌症十大死因第七位,近五年死亡率逐年攀高,死亡人數年增率達6%,為婦科癌症之最2。過去卵巢癌治療僅以手術治療及含鉑傳統化學藥物cisplatin、carboplatin等為主。
近年研究發現,BRCA1及BRCA2 (breast cancer susceptibility gene 1/2)是著名的抑癌基因(tumor suppressor gene),BRCA能透過同源重組(homologous recombination repair; HR)的機制來修復缺損的DNA,以維持細胞功能和基因穩定;若BRCA1及BRCA2 基因發生突變將大幅提升罹患卵巢癌之風險。在一項超過8000人之大型分離分析(segregation analysis)研究探討BRCA與卵巢癌發生之風險相關性,顯示帶有BRCA1基因突變者發生卵巢癌風險值(cumulative ovary cancer risk)為39% (95% CI, 22%-51%),BRCA2基因突變者則為11%(95% CI, 4.1%-18%) 3。此一重大發現讓卵巢癌治療有了新突破,為病人帶來希望的曙光。
目前新藥開發重點為利用癌細胞易造成基因突變之特性,經由合成致死(synthetic lethality)方式,透過干擾癌細胞修復途徑,達到殺死癌細胞目的。非聚腺嘌呤二磷酸核醣聚合酶(polyadenosine 5-diphosphoribose polymerase; PARP)抑制劑即是代表藥物,現今國際上已有4種PARP抑制劑分別於2014-2018年間陸續取得美國食品藥物管理局藥證,並應用於多種癌症治療。本文將介紹卵巢癌,說明新藥olaparib對抗卵巢癌之作用機制、其臨床療效、藥動學特性、用法及安全性加以評估探討。
貳、卵巢癌介紹
卵巢癌早期無徵兆或只有不正常的陰道出血,以至於後期當腫瘤壓迫到鄰近器官時,容易被誤認為是腸胃或泌尿相關的不適,因此不易察覺,其症狀包括腹脹、下腹痛、便祕、不正常子宮出血、浮腫、體重減輕及頻尿等。根據國際婦產科聯盟(The International Federation of Gynecology and Obstetrics; FIGO)建議,卵巢癌可大致分成四期(表一)4,因缺乏篩檢方法,多數病人確診時已是第三或第四期卵巢癌,尤其第四期預後為最差,癌細胞侵犯範圍已由血管轉移至肝臟內部或腹腔之外(例如肋膜或肺臟內)。定期陰道內觸診仍被認為是早期發現卵巢癌最好的方法,其他檢測如超音波掃描檢查,可以正確看出卵巢腫瘤的位置、大小及堅實度;腫瘤標記抗原CA125檢查,則可用來追蹤或鑑別復發。
表一 FIGO卵巢癌分期4
按照病理組織分類,卵巢癌可分成三種類型,以上皮性卵巢癌最為常見(佔95%),其次為生殖細胞癌及性腺細胞特定間質細胞癌。上皮性卵巢癌亞型分類中,又屬高分化漿液性卵巢癌(high-grade serous epithelial ovarian carcinoma; HGSOC)佔多數,此族群病人常伴有BRCA突變而導致基因缺陷1。
參、嶄新卵巢癌標靶藥物機轉-合成致死(synthetic lethality)
Hartwell等人於西元1997年,首次將合成致死提出並運用在癌症治療上,核心概念係指兩個非致死特定基因(如PARP、BRCA)同時被抑制而促進細胞死亡的機制5。
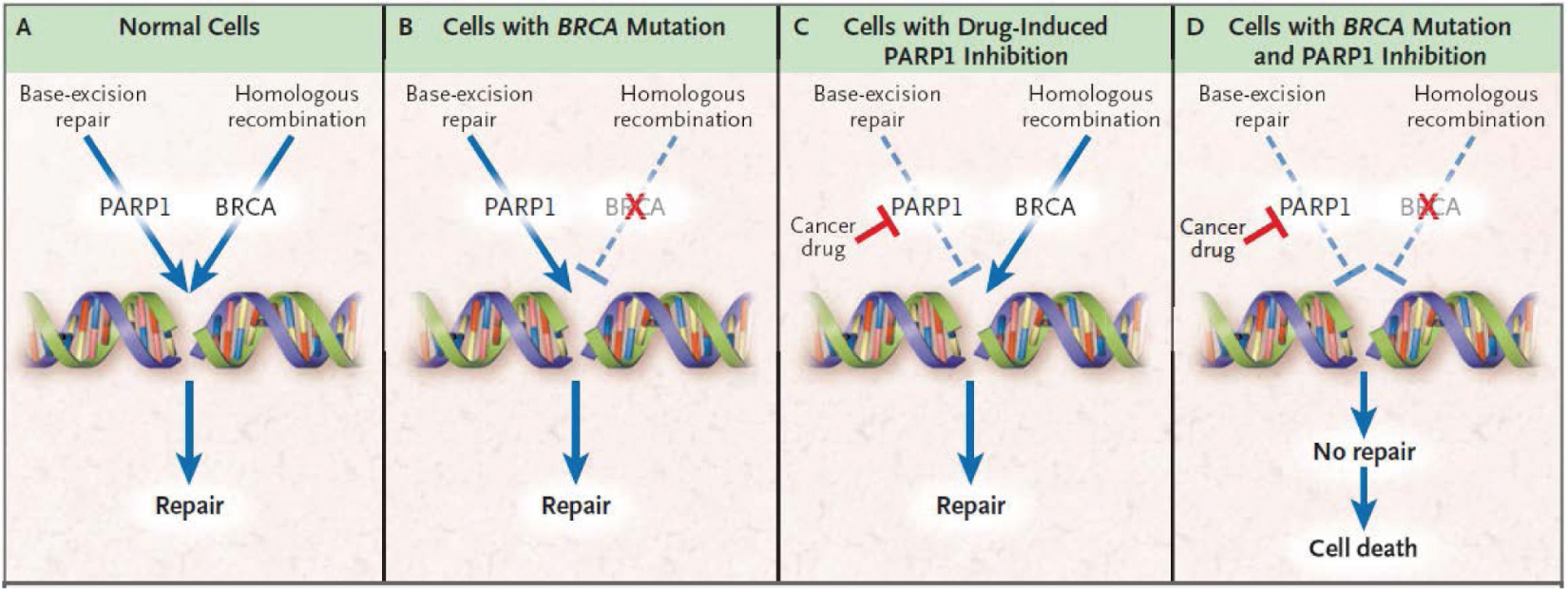
PARP是著名的DNA受損修復酵素,目前已知PARP蛋白家族共有17個,其中又以PARP1主要參與正常細胞DNA單股斷裂(single strand breaks; SSB)修復為主。PARP主要是透過鹼基剪除(base excision repair)方式來修復DNA雙股螺旋中之單股DNA修復6。當具有BRCA1/2基因突變之細胞給予PARP抑制劑,則會造成雙股DNA斷裂無法修復,導致癌細胞死亡。這種利用癌細胞本身的先天性DNA修復功能缺損,而達到抗癌的效果,稱之為合成致死7,8 (圖一)。
圖一 BRCA突變與PARP抑制劑誘導合成致死導致細胞死亡的機制8。
mechanism of cell death from synthetic
lethality, as induced by inhibition of
poly(adenosine diphosphate [ADP]–ribose)
polymerase 1 (PARP1).
近年來,受矚目的卵巢癌標靶新藥PARP抑制劑- olaparib(Lynparza)®便是合成致死機轉最佳代表藥物。Olaparib是第一個被發現的小分子強效PARP抑制劑。因BRCA突變卵巢癌細胞對PARP抑制劑具有高度親合之特性,olaparib透過選擇性抑制PARP酵素活性,進一步阻絕其調控之鹼基剪除DNA修復途徑,造成受損DNA無法得到修復,最後引起因BRCA突變而失去DNA修復功能的卵巢癌細胞走向細胞凋亡6, 9。
肆、Olarparib臨床試驗介紹
2012年Ledermann等人發表之STUDY 19試驗,核准了olaparib用於對含platinum(鉑)化療藥物具有反應之復發性卵巢癌、腹膜癌及輸卵管癌之成年病人之維持療法。該研究屬隨機分布、雙盲,安慰劑與olaparib對照之phase 2臨床試驗,共收錄265位介於21-89歲(平均年齡58歲)之復發性、高分化漿液性卵巢癌(HGSOC)病人,使用過至少兩次以上含鉑化療後具有部分或完全反應,分別使用olaparib 400毫克(n=136)或安慰劑(n=129)每日兩次。研究追蹤8星期後,疾病無惡化存活期(progression-free survival; PFS)比較結果發現,olaparib組明顯優於安慰劑組(PFS 8.4個月vs 4.8個月,HR 0.35 [95% CI, 0.25-0.49], p<0.001)10。
針對具BRCA突變卵巢癌病人進行進一步探討,2017年發表之SOLO2研究,屬隨機、雙盲、跨國多中心,安慰劑與olaparib對照之phase 3臨床試驗,受試者為具有gBRCA突變之復發性、高分化漿液性卵巢癌,同樣使用過至少兩次以上含鉑化療後具有部分或完全反應之病人,共納入295位。分別使用olaparib 300毫克(n=196)或安慰劑(n=99)每日兩次做為單一維持療法。研究結果顯示,olaparib組之PFS明顯優於安慰組(19.1個月vs 5.5 個月,HR 0.30 [95% CI, 0.22-0.41], p<0.0001)11。
2018年Moore等人發表之多中心、隨機分配、雙盲之SOLO-1 phase 3臨床試驗結果,更使得olaparib治療地位涵蓋至具有致病性的生殖細胞或是體細胞具有BRCA突變之晚期復發性卵巢癌、腹膜癌及輸卵管癌之成年病人。該研究共納入391位BRCA1/2突變且對含鉑藥品有反應之第三、四期(International Federation of Gynecology and Obstetrics stage III or IV)復發卵巢癌病人,分別使用olaparib 300毫克(n=260)或安慰劑(n=130)每日兩次做為單一維持療法並追蹤41個月。研究結果發現,使用olaparib組相較於安慰劑組可明顯降低疾病惡化及死亡風險值達70% (HR 0.30 [95% CI, 0.23-0.41], p<0.001)12。
表二 Olaparib於卵巢癌治療之重要臨床研究
伍、Olarparib藥物動力學、副作用及用藥注意事項
一、藥物動力學特性
Olaparib經口服給藥後可快速被吸收,並於1-3小時內達最高血漿濃度,達穩定狀態時,其平均分佈體積為158-167 L,蛋白質結合率為82%。Olaparib主要經肝臟代謝,平均體內排除半衰期是11.9小時13。
二、常見副作用
Olaparib常見副作用(>10%)有噁心、疲勞、嘔吐、貧血等,骨髓造血不良症候群(myelodysplastic syndromes)與急性骨隨性白血病(acute myeloid leukemia)則是罕見但嚴重之副作用,平均發生率低於1.5%,使用前及治療期間須監測血球指數。若病人先前之化療藥物或進行放射療法已造成血液毒性尚未復原,須待絕對嗜中性白血球數(absolute neutrophil count; ANC)恢復至1000-2000/mm3 (Grade 1 neutropenia)以上達4週後才可進行治療;若仍未能恢復,須經醫師評估是否需要中止olaparib治療14, 15。
三、使用劑量及注意事項
Olaparib建議劑量為300毫克每日口服兩次,可隨餐或空腹服用,每日總劑量600毫克。適用於對第一線含鉑藥物有反應且具BRCA突變之卵巢癌作為維持治療,建議療程為兩年或出現無法忍受的毒性及疾病惡化為止。服藥療程中需完整吞服整粒錠劑,不可咀嚼、壓碎、溶解或剝半使用14。
輕度腎功能不全者不需調整劑量,中度腎功能不全者(Clcr 31-50 mL/min)建議劑量為200毫克每日兩次(每日總劑量400毫克),重度腎功能不全者(Clcr ≤ 30 mL/min)無相關資料14。
藥物交互作用方面,olaparib主要透過肝臟酵素CYP3A代謝,應避免併用強效或中效CYP3A酵素作用劑及抑制劑。如須併用強效CYP3A抑制劑(如:itraconazole等)須降低劑量至 100毫克每日兩次(每日總劑量200毫克);如須併用中效CYP3A抑制劑(如:fluconazole等),則須將劑量降低至150毫克每日兩次(每日總劑量300毫克)14。
四、懷孕及哺乳
目前無確切藥物相關風險文獻可說明olaparib用於懷孕婦女之影響,但在動物試驗中觀察到有致畸胎性,因此建議女性在治療期間及服用最後一次劑量後六個月內應採取避孕措施。目前沒有證據顯示olaparib是否會排入人類乳汁,建議服藥期間及服用最後一個劑量之一個月內避免哺乳14。
五、台灣目前核准使用條件與安全性
Olaparib是臺灣目前唯一納入健保給付BRCA突變的局部晚期或轉移性卵巢癌、輸卵管癌或原發性腹膜癌之維持治療,並對第一線含鉑化療有治療反應後使用之PARP抑制劑,限用2年,須經事前審查核准後使用。考量其用藥安全,olaparib應避免與肝臟酵素CYP3A之中、強效作用劑及抑制劑併用,用藥期間定期監測血球指數可減少病人發生骨髓造血不良症候群之罕見副作用。
陸、結論
回顧過去卵巢癌治療多半依賴非專一性之傳統化學療法,不分敵我地攻擊快速分裂細胞,也因此帶給卵巢癌病人抗癌治療以外的副作用。Olaparib除了具有專一性的標靶治療,更能藉由與BRCA突變所導致的合成致死的嶄新機轉來殺死癌細胞。Olaparib對於接受傳統化學治療病人之疾病惡化可明顯得到改善並降低死亡率,對病人產生副作用也具耐受性,此突破性的進展於先前卵巢癌治療中前所未見。在其他癌症治療領域,olaparib於極惡性三陰性乳癌及胰臟癌之臨床試驗也正積極地發展中,期待未來此藥能作為卵巢癌第一線之維持治療選項,為病人帶來一個嶄新的治療契機。
A Novel Targeted Therapy for Ovarian Cancer: Olaparib
Chun-Chien Yang1, You-An Shih1, Ying-Ju Ou2,
Wei-Hsuan Huang1, Hsiu-Mei Chang1
1Department of Pharmacy, Kaohsiung Municipal
Ta-Tung Hospital
2Department of Pharmacy, Kaohsiung Medical
University Hospital
Abstract
Ovarian cancer (OC) is the most common gynecologic malignancy among females in Taiwan. Platinum therapy has been the backbone of chemotherapy for a long time and often results in significant cytotoxic side effects. More than 50% of patients suffer a tumor recurrence after the first-line therapy within three years. Inhibition of poly(ADP-ribose)polymerases (PARPs) has been considered one of the important therapeutic strategies of ovarian cancer in recent years. PARPi disrupts the process of DNA repair pathways, prohibiting growth and larger tumor formation. Olaparib is the only PARPi which has received TFDA approval and covered by National Health Insurance. Studies confirmed that Progression-Free Survival (PFS) was significantly extended by Olaparib in BRCA1/2 mutation carriers with relapsed‘platinum-sensitive’ high-grade ovarian, fallopian tube or peritoneal cancer. Through the mechanism of synthetic lethality, Olaparib, a first-in-class kryptonite to ovarian cancer, improves the disease outcome and reduces resistance to chemotherapy in women with mutated BRCA function.
參考資料:
1. Stewart C, Ralyea C, Lockwood S: Ovarian Cancer: An Integrated Review. Semin Oncol Nurs 2019; 35: 151-156.
2. 行政院衛生福利部:108年死因統計年報。臺北:衛生福利部,2020.
3. Neff RT, Senter L, Salani R: BRCA mutation in ovarian cancer: testing, implications and treatment considerations. Ther Adv Med Oncol 2017; 9: 519-531.
4. Prat J: FIGO's staging classification for cancer of the ovary, fallopian tube, and peritoneum: abridged republication. J Gynecol Oncol 2015; 26: 87-89.
5. Kaelin WG, Jr.: The concept of synthetic lethality in the context of anticancer therapy. Nat Rev Cancer 2005; 5: 689-698.
6. Franzese E, Centonze S, Diana A, et al: PARP inhibitors in ovarian cancer. Cancer Treat Rev 2019; 73: 1-9.
7. Tewari KS, Eskander RN, Monk BJ: Development of Olaparib for BRCA-Deficient Recurrent Epithelial Ovarian Cancer. Clin Cancer Res 2015; 21: 3829-3835.
8. Iglehart JD, Silver DP: Synthetic lethality--a new direction in cancer-drug development. N Engl J Med 2009; 361: 189-191.
9. Farmer H, McCabe N, Lord CJ, et al: Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature 2005; 434: 917-921.
10. Ledermann J, Harter P, Gourley C, et al: Olaparib maintenance therapy in platinum-sensitive relapsed ovarian cancer. N Engl J Med 2012; 366: 1382-1392.
11. Pujade-Lauraine E, Ledermann JA, Selle F, et al: Olaparib tablets as maintenance therapy in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2017; 18: 1274-1284.
12. Moore K, Colombo N, Scambia G, et al: Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med 2018; 379: 2495-2505.
13. Lheureux S, Bowering V, Karakasis K, et al: Safety evaluation of olaparib for treating ovarian cancer. Expert Opin Drug Saf 2015; 14: 1305-1316.
14. Olaparib藥品仿單。
15. Deeks ED: Olaparib: first global approval. Drugs 2015; 75: 231-240.
通訊作者:張秀美/通訊地址:高雄市前金區中華三路68號 大同醫院藥學科
服務單位:高雄市立大同醫院藥學科/聯絡電話:(O) 07-2911101 ext 8371