癌症精準醫療的契機與挑戰
鄭吉元1、蔡慈貞1,2、張文震3
1林口長庚紀念醫院藥劑部藥師
2新生醫護管理專科學校兼任講師
3林口長庚紀念醫院腫瘤科醫師
摘要
精準醫療就是在對的時間用對的治療一位對的病人。早期癌症精準醫療成功的例子有針對BCR-ABL融合基因的標靶藥imatinib以及針對HER2過度表現之標靶藥trastuzumab。近年來,因著次世代基因定序 (next-generation sequencing,NGS) 技術的應用,揭開了腫瘤的基因圖譜,更讓癌症精準醫療開了新窗。本文將從五方面來探討癌症精準醫療的契機與挑戰,包括(1)針對異常基因之標靶藥物;(2)生物標記;(3)基因定序分析技術;(4)癌症精準醫療臨床試驗;(5)大數據資料。隨著基因檢測技術的進步,並且結合基因資料庫的數據分析,精準醫療已成為可能;但在檢測後如何選擇適當的藥物,以及如何整合國內基因資料庫等諸多議題,都是我們必須面對的挑戰。
關鍵字: 精準醫療、癌症精準醫療、precision medicine、precision oncology
壹、前言
精準醫療就是在對 (right) 的時間用對的治療一位對的病人。早期癌症精準醫療成功的例子有針對BCR-ABL融合基因的標靶藥imatinib治療慢性骨髓性白血病 (chronic myeloid leukemia,CML) 以及針對HER2過度表現之乳癌的標靶藥trastuzumab等,由於它們的出現,大大的延長了病人的存活時間。現今,因為分子生物學的進步、次世代基因序列 (next-generation sequencing,NGS) 技術的應用、大數據的分析和政府贊助的大型計畫 (例如:Precision Medicine Initiative)等,更讓癌症精準醫療開了新窗,將標靶藥和免疫治療各種不同的癌症,其中成果最顯著的是黑色素細胞瘤 (melanoma) 和非小細胞肺癌的精準醫療。然而,癌症精準醫療也面臨許多挑戰,例如:找出主導基因 (driver gene)、安全有效的藥物選擇及藥物組合、臨床試驗的設計、資料的透明與分享等。本文將從五方面來探討癌症精準醫療的契機與挑戰。
貳、針對異常基因之標靶藥物的契機與挑戰
Imatinib可以有效治療具有BCR-ABL融合基因的CML,也被核准用於治療帶有c-kit基因表現的胃腸道基質瘤。然而,同樣帶有c-kit基因表現之唾液腺adenoid cystic carcinoma病人使用imatinib則無效1。
BRAF突變佔所有癌症約15%。單獨使用能抑制BRAF V600E的標靶藥vemurafenib用於治療黑色素細胞瘤,其客觀治療反應率 (objective response rate,ORR) 高達57% 2;然而用在同樣具有BRAF V600E突變的大腸直腸癌,則其ORR不到10% 3。
肺腺癌的精準醫療是具有代表性的例子。臨床上,對於診斷為肺腺癌的患者,進行EGFR、ALK和ROS-1基因分析已是常態作法,一旦發現異常,即可給予針對異常基因之標靶藥物,其成效卓著。
以上例子指出:針對相同的異常基因,使用相同的標靶藥物去治療不同的癌症,其結果可能有很大的差異,這意味著腫瘤微環境可能也是決定藥效的因素之一。由此也可看出,癌症精準醫療絕不是只要找到異常基因再給予相對應的標靶藥物那麼簡單,此治療策略遠比我們想的還要複雜。
參、生物標記的契機與挑戰
一、檢體來源
值得信賴的生物標記 (biomarker) 在精準醫療中扮演十分重要的角色。傳統上是取腫瘤組織作為生物標記的檢體來源。這種作法的缺點是有時腫瘤組織取得不易 (例如:胰臟癌、肺癌)、無法經常進行組織切片以有效監測具有抗藥性突變基因的出現、腫瘤異質性 (heterogeneity)。其中腫瘤異質性是相當大的挑戰,由於腫瘤異質性,使得即使是同一腫瘤組織但切片的位置不同、檢體取自癌症原發部位或轉移部位,或是在不同的治療期間採樣,這些都可能會有不同的結果。因此,抽血作為生物標記的檢體來源,也就是液態切片 (liquid biopsy)應運而生。
現今抽血檢測腫瘤游離DNA (cell-free circulating tumor DNA,ctDNA) 已應用在許多癌症的監測和評估治療效果。使用此方法,取得一系列的資料,使得有機會可以在影像學上尚未發現癌症惡化之前就預先知道治療藥物已出現抗藥性。這個方法也可以解決腫瘤異質性的議題,因為出現在血液循環中的腫瘤細胞是最終整體的結果呈現。目前並不清楚當癌症病人治療後,ctDNA要隔多久時間測一次,以及完整的時間表。由於ctDNA測定的敏感度 (sensitivity) 較低,因此有時需要同時做組織切片才能確定。
二、預測免疫檢查點抑制劑治療效果的生物標記
近年來,免疫檢查點抑制劑 (immune checkpoint inhibitor,ICI) 已廣泛使用在各種不同的癌症。現階段,證實可用來預測ICI治療效果的生物標記有腫瘤突變負荷 (tumor mutational burden, TMB) 和DNA錯誤配對修復 (mismatch repair,MMR)。研究結果發現,相較於TMB低的患者,TMB高的患者使用ICI治療有較高的ORR以及更長的疾病無惡化存活期 (progression-free survival,PFS) 4-6。然而,判斷TMB高或低的臨界值 (cut point) 尚未確定。目前研究朝向是否不同的腫瘤組織學應有不同的TMB臨界值。
DNA錯誤配對修復基因缺陷 (defective MMR, dMMR)又稱為『高度微衛星不穩定 (high microsatellite instability,MSI-H)』之不同型態癌症病人單獨使用pembrolizumab的ORR相當好,其中大腸直腸癌為36%,另外14種癌症為46%。FDA從未核准一個藥物可以治療所有的實體腫瘤 (solid tumor,也就是所有的癌症,除了血液科癌症之外),直到pembrolizumab,但是必須是MSI-H實體腫瘤7。
肆、基因定序分析技術的契機與挑戰
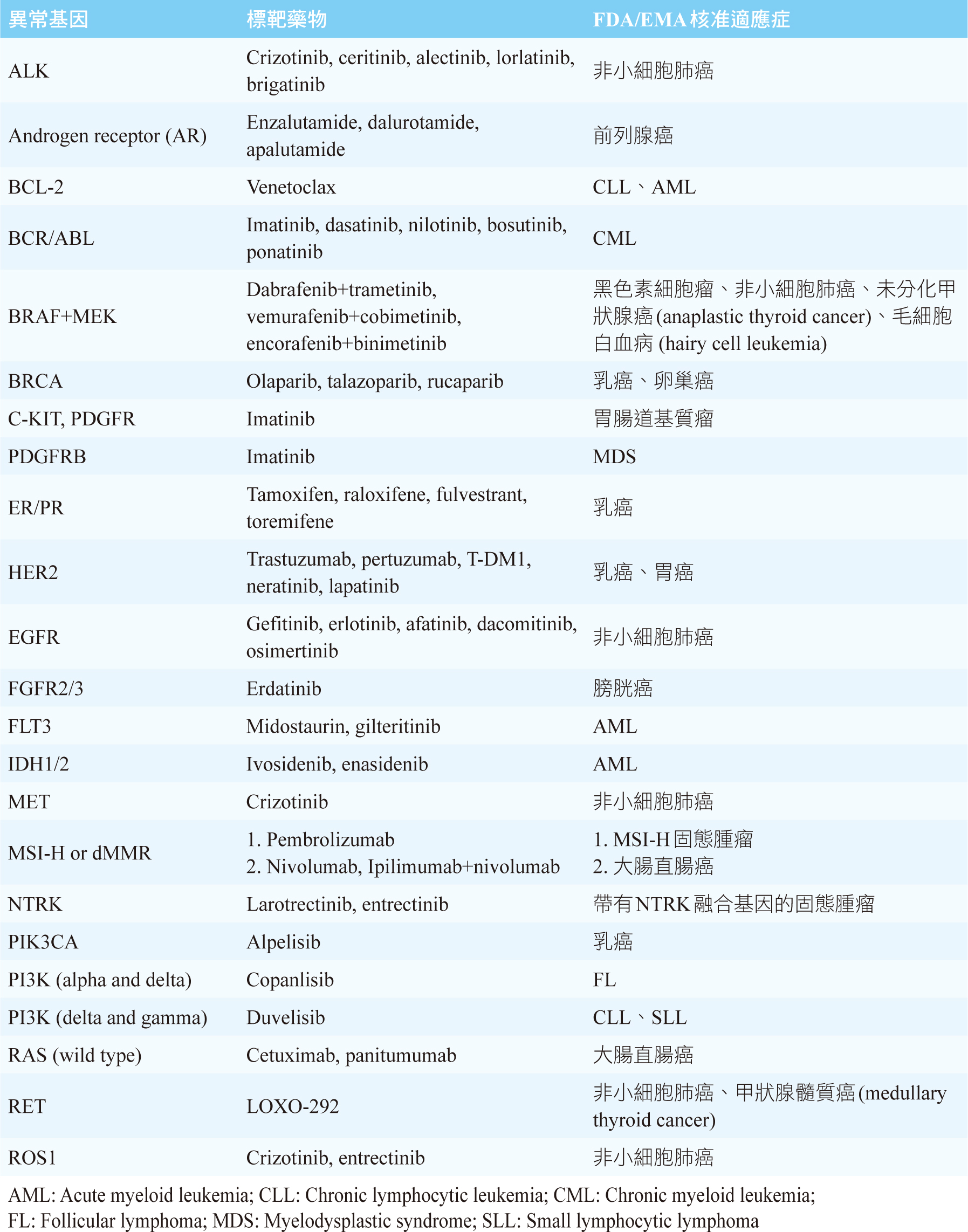
近年來,因著次世代基因定序 (next generation sequencing,NGS) 技術的應用,揭開了腫瘤的基因圖譜。資料顯示,與癌症相關的基因不到300個8,其中只有23個基因,目前有相對應之FDA/EMA核准的標靶藥物可以使用,詳情見表一9。雖然NGS可以提供該病人所有的異常基因,但是無法確認何者是主導基因,以及很多異常基因也無相對應的標靶藥物。因此,藥物是否有效及安全必須要進行臨床試驗才能得知。
表一 針對異常基因之相對應的FDA/EMA核准標靶藥物9
伍、癌症精準醫療臨床試驗的契機與挑戰
由於癌症精準醫療是針對特定的異常基因給予相對應的標靶藥物以達到療效,因此臨床試驗設計不同於以往,以下將介紹4種臨床試驗設計是癌症精準醫療臨床試驗常用的手法:
一、 籃子型試驗 (basket trial) 設計
籃子型試驗 (basket trial,BT) 是精準醫療臨床試驗中最具代表性的。其方法是針對不同的癌症但具有共同的異常基因,給予一樣的藥物。2017年5月,pembrolizumab經FDA核准用來治療MSI-H固態腫瘤就是一個例子7。隨後,larotrectinib也在2018年11月核准用於治療帶有NTRK (neurotrophin tropomyosin receptor kinase) 融合基因的固態腫瘤7。
第一個BT是針對不同的癌症但具有共同的BRAF V600E突變,給予BRAF抑制劑vemurafenib7。結果顯示,此精準醫療對非小細胞肺癌、卵巢癌及一些中樞神經系統癌症有效7。MyPathyway是一項開放性第IIa期的BT,評估pertuzumab併用trastuzumab (針對HER2過度表現)、erlotinib (針對EGFR突變)、vemurafenib (針對BRAF突變)、vismodegib (針對Hedgehog路徑) 去治療各種不同的癌症10。結果發現,HER2過度表現的癌症中,唾液腺癌ORR 80%、大腸直腸癌ORR 38%;BRAF突變的癌症中,非小細胞肺癌ORR 43%10。
BT的優點是可以測試某種標靶藥物對不同腫瘤的治療效果,先找出哪些癌症使用該異常基因相對應的標靶藥物有不錯的療效,或是一些罕見的異常基因可以透過全球性、多中心的BT來進行藥物試驗7。不過,BT的缺點是只針對單一異常基因給予單一藥物治療,以這個策略來對抗癌症很有可能會無效;沒有對照組;某些罕見的異常基因,由於人數太少,可能會導致偽陰性 (false-negative) 結果7。
二、雨傘型試驗 (umbrella trial) 設計
不同於BT,雨傘型試驗 (umbrella trial,UT) 設計乃是針對同一個癌症,不同的異常基因,使用不同之相對應的標靶藥物。例如:乳癌的I-SPY1/2、非小細胞肺癌的BATTLE 1/2、大腸直腸癌的FOCUS-4和MoTriColor7。UT的好處是有可能找對該癌症特別有效的標靶藥物;UT的不利點則是缺乏彈性,研究期間只能依循最初制定的治療策略進行,有時該治療策略可能已過時7。目前,I-SPY2和BATTLE-2是使用可以彈性調整治療計畫的調整型試驗 (adaptive trial) 設計,詳情見下文第四點。
三、混合型臨床試驗設計
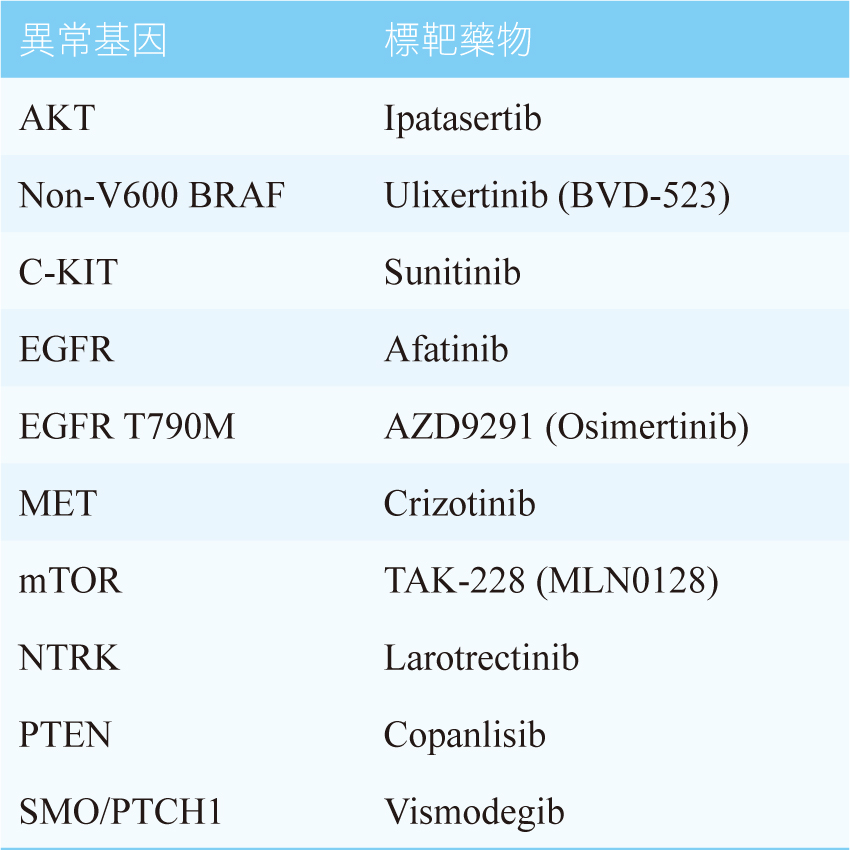
有一些大規模的臨床試驗,是合併BT和UT的設計。例如:耗資三千萬美元的NCI-MATCH (National Cancer Institute-Molecular Analysis for Therapy Choice) 將納入不同腫瘤型別的病人,每一個腫瘤分別根據各自獨特的分子標記(基因體變異) 來測試對不同標靶藥物的治療反應。這個臨床試驗,希望能同時測試多種標靶藥物對不同型別腫瘤的療效11。NCI-MATCH開放試驗的標靶藥物有10個,見表二11。
表二 NCI-MATCH開放試驗的標靶藥物11
四、調整型試驗 (adaptive trial) 設計
不同於傳統的試驗設計其試驗計畫不能中途更改,調整型試驗 (adaptive trial,AT) 設計則是看治療效果可彈性調整計畫內容。例如:原本1:1隨機分配標靶藥物組和標準治療組,若在試驗期間發現標靶藥物組的療效較好,則可以增加標靶藥物組的比例至2:1→3:1→….;反之,若在試驗前期發現標靶藥物組無效也可提早停用7,12。BATTLE-2隨機分配各種不同的標靶藥物或藥物組合於相對應的異常基因,若在試驗過程中發現某些異常基因相對應的標靶藥物組別的療效好,則增加這些組別的隨機分配比例,即加權 (weighed);反之,對於療效不佳的組別則縮減收納人數甚至提早結束7。AT的優點包括可以增加有效藥物的統計檢定力 (power) 即p值、受試者人數可減少、花費低、更多的病人可以用到有效藥,以及可以縮短藥物研發時間12。不過,AT仍存在有實驗偏差 (bias) 問題,以及如何跟受試者說明異動和病患同意書的調整7。
陸、大數據資料的契機與挑戰
大型資料庫的分享亦是精準醫療中重要的一環。美國癌症基因體圖譜計畫 (The Cancer Genome Atlas,TCGA)資料庫儼然已成為研究癌症精準醫療的標準參考來源13。TCGA大規模地蒐集特定癌症病人的相關臨床記錄、腫瘤組織以及相對應的正常組織,進行基因定序以及資訊分析,並公開資料與分析結果於官方網站供大家瀏覽及下載。又為了結合個人化醫療,提供癌症研究與資料分享,美國國家癌症研究所 (National Cancer Institute,NCI) 建置GDC portal (Genomic Data Commons portal),提供研究者資料檢索與下載。除了TCGA,國際癌症基因體協會 (International Cancer Genome Consortium,ICGC) 也是重要的全球性組織,會公開癌症基因體資料給研究者使用。此外,cBioPortal、COSMIC、MyCancerGenome也可提供不少資訊。MyCancerGenome是由美國范德堡大學 (Vanderbilt University) 研發的資料庫,可提供你給定的異常基因之臨床概要及其相對應可能的標靶藥物,同時也可取得與該異常基因相關的臨床試驗內容14。未來,如何將這些資料整合、更新和解讀,有賴一共同的完整平台來完成。
柒、結論
癌症精準醫療將癌症治療又向前推進了一步,但是仍然存在許多挑戰。癌症精準醫療絕不是只要找到異常基因再給予相對應的標靶藥物那麼簡單。我們需要更多大型前瞻性、以生物標記基因檢測為基礎的藥物臨床試驗 (例如NCI-MATCH) 來提供紮實的證據。我們需要不同領域的專家一起共同合作,包括臨床和基礎科學者。我們需要推廣教育訓練,其對象不只是醫療人員,還要包括病人,以維持良好的醫病關係。此外,資料的分享交流也可以支持有效藥物儘快用在臨床上。總而言之,目前癌症精準醫療很多還在實驗階段,除了臨床試驗外,對於藥效和安全性未經證實的藥物治療,我們並不建議直接使用在病人身上,用一句英文來說,就是” Dont try precision oncology at home!”。
Precision Oncology: Opportunities and Challenges
Chi-Yuan Cheng1, Tzu-Cheng Tsai1,2, Wen-Cheng
Chang3
1Department of Pharmacy, Chang Gung Memorial
Hospital, Linkou
2Department of Long Term Care, Hsin Sheng Junior
College of Medical Care and Management
3Department of Oncology, Chang Gung Memorial
Hospital, Linkou
Abstract
Precision medicine aims to match the right patient with the right treatment at the right time. Early successes in precision oncology included imatinib targeting BCR-ABL fusion gene, and trastuzumab targeting HER2 amplification. In recent years, improvements in next-generation sequencing (NGS) technologies have unveiled the cancer genomic atlas leading to open a new window of precision oncology. This article will explore the opportunities and challenges of precision oncology from five aspects, including targeted therapies for genetic alterations, biomarkers, genes sequencing technologies, clinical trial designs in precision oncology, and big data analytics.
參考資料:
1. Hotte SJ, Winquist EW, Lamont E, et al: Imatinib mesylate in patients with adenoid cystic cancers of the salivary glands expressing c-kit: a Princess Margaret Hospital phase II consortium study. J Clin Oncol 2005;23:585-90.
2. McArthur GA, Chapman PB, Robert C, et al. Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3):extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol 2014;15:323-32.
3. Hyman DM, Puzanov I, Subbiah V, et al. Vemurafenib in multiple nonmelanomac with BRAF V600 mutations. N Engl J Med 2015;373:726-36.
4. Carbone DP, Reck M, Paz-Ares L, et al: First-line nivolumab in stage IV or recurrent non–small-cell lung cancer. N Engl J Med 2017;376:2415-26.
5. Hellmann MD, Nathanson T, Rizvi H, et al: Genomic features of response to combination immunotherapy in patients with advanced non-small-cell lung cancer. Cancer Cell 2018;33:843-52.
6. Hellmann MD, Ciuleanu TE, Pluzanski A, et al: Nivolumab plus ipilimumab in lung cancer with a high tumor mutational burden. N Engl J Med 2018;378:2093-104.
7. Garralda E, Dienstmann R, Piris-Giménez A, et al: New clinical trial designs in the era of precision medicine. Mol Oncol 2019;13:549-57.
8. Futreal PA, Coin L, Marshall M, et al: A census of human cancer genes. Nat Rev Cancer 2004;4:177-83.
9. Malone ER, Oliva M, Sabatini PJB, et al: Molecular profiling for precision cancer therapies. Genome Med 2020;12:8.
10. Hainsworth JD, Meric-Bernstam F, Swanton C, et al: Targeted therapy for advanced solid tumors on the basis of molecular profiles: results from MyPathway, an open-label, phase IIa multiple basket study. J Clin Oncol 2018;36:536-542.
11. NCI-MATCH Trial (Molecular Analysis for Therapy Choice) Available from: https://www.cancer.gov/about-cancer/treatment/clinical-trials/nci-supported/nci-match Accessed April 13,2020.
12. Zang Y, Lee JJ: Adaptive clinical trial designs in oncology. Chin Clin Oncol 2014; 3:49.
13. Tomczak K, Czerwiska P, Wiznerowicz M: The Cancer Genome Atlas (TCGA): an immeasurable source of knowledge. Contemp Oncol (Pozn). 2015;19:A68-A77.
14. My Cancer Genome. Available from: https://www.mycancergenome.org. Accessed April 13, 2020.
通訊作者:鄭吉元/通訊地址:桃園市龜山區復興街五號林口長庚醫院病理大樓6樓化療藥局
服務單位:林口長庚紀念醫院藥劑部/聯絡電話:(O) 0975367860