探討青光眼之高血壓藥物選擇
張鈺笛1、張玉慧1、柯美蘭2
1新竹臺大分院新竹醫院藥劑部
2新竹臺大分院新竹醫院眼科部
摘要
關於高血壓治療指引中,對於特殊族群,大多有合適高血壓藥物選擇,像是糖尿病患者首選治療藥物選擇通常是ACEIs(angiotensin-converting-enzyme inhibitor) 或ARBs(angiotensin receptor blocker)等,就是缺乏青光眼族群的病人。
為什麼要針對青光眼族群,討論血壓藥物的選擇呢?青光眼大多數的原因是眼內壓的上升,但也有約40%的患者會出現青光眼神經病變,而沒有眼壓升高的證據,其原因可能與視神經損傷和動脈血壓異常有關, 因此眼壓太低、太高或眼灌注壓(ocular perfusion pressure, OPP)問題,被認為是可能的危險因素。近幾年來,也有一些對於青光眼病人同時有高血壓的問題,相關的藥物研究文獻有鈣離子阻斷劑和乙型阻斷劑。 而常用的局部製劑中的乙型阻斷劑,像是betaxolol,carteolol,timolol其抗交感神經作用,減少房水形成達到降低眼內壓(intraocula pressure, IOP)的目的,用於治療青光眼,是過去普遍藥師熟知的藥理機轉。鈣離子阻斷劑雖然目前國內沒有局部製劑,但其用於青光眼治療的研究發現,可能是透過調節血壓,促進眼部血流以供給眼睛營養等機轉,達到治療青光眼的目的。如何選擇合適的藥物來降血壓,又可預防眼壓,即青光眼病變的研究。本篇分析幾篇文獻,來探討青光眼之高血壓藥物選擇。
關鍵字: 青光眼、鈣離子阻斷劑 、乙型阻斷劑
壹、 簡介眼睛基本生理構造與青光眼病理生理特徵
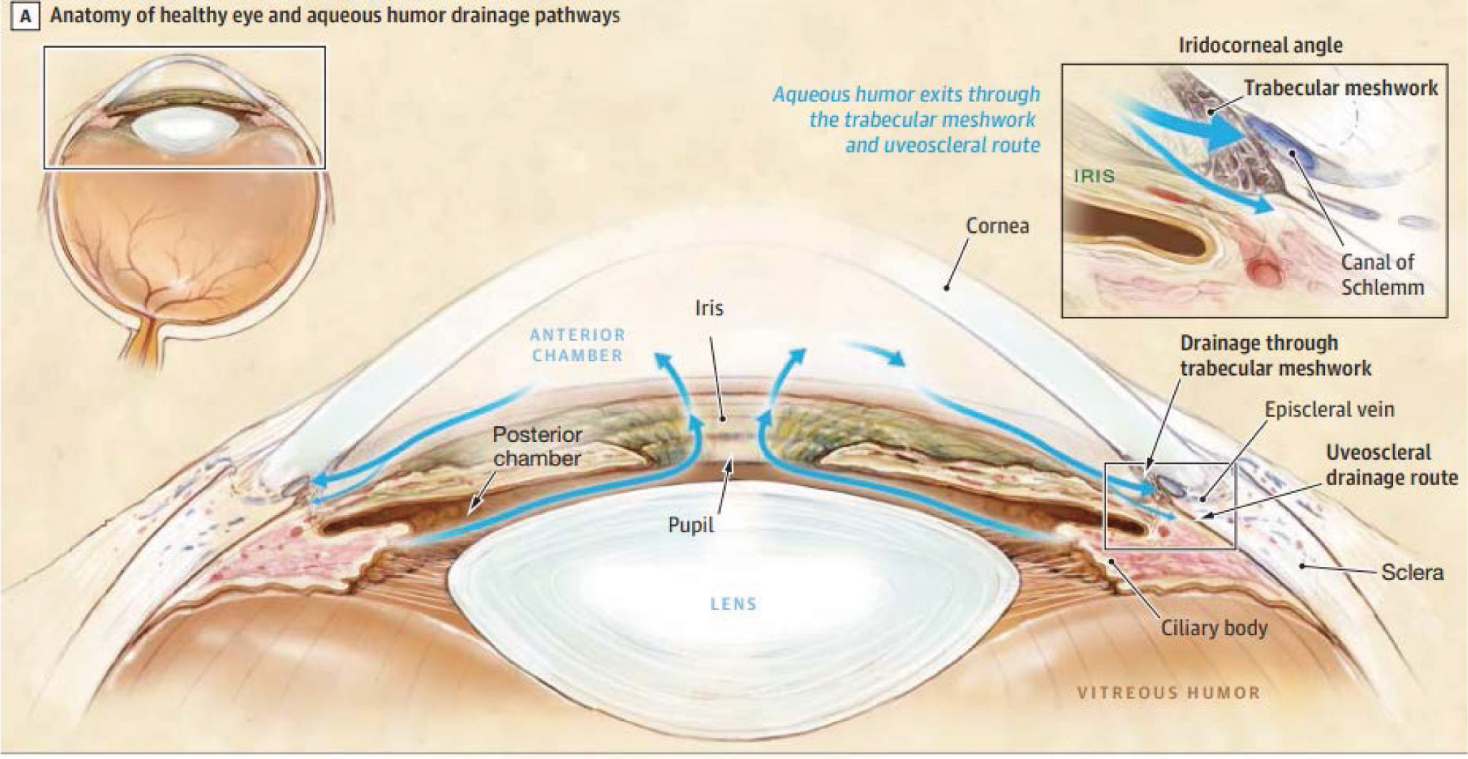
一、健康人的眼睛和房水流動的路徑(圖1)
圖一
眼球內是一個封閉的結構,前房(Anterior chamber)是位於角膜(Cornea)之後、虹膜(Iris)和瞳孔(Pupil)之前的空隙,後房(Posterior chamber)則在虹膜、瞳孔之後,晶狀體(Lens)之前。前、後房內充滿了透明的液體,我們稱之為房水(humor),房水通過房角在前、後房內不斷地微循流動,並且不斷地生成、排出,使眼壓維持在一個穩定的水準。眼球為保有其正常的形狀及功能,必須分泌房水,以維持適當的眼內壓力,我們稱為眼內壓(IOP)。
二、青光眼患者的眼睛生理構造(圖2)
圖二
青光眼的分類依解剖學而分為隅角閉鎖性青光眼(primary angle closure glaucoma, 圖2右)、隅角開放性青光眼(primary open angle glaucoma, 圖2左)及先天性青光眼三種。此三種又分別包括原發性及次發性青光眼:原發性青光眼:發病機制未完全闡明,是主要的青光眼型別,在成年以後人群多見;本文主要介紹原發性青光眼;次發性青光眼:由眼部其他疾病或全身疾病等明確病因所致的一類青光眼,可見於各年齡層。
(一) 隅角閉鎖性青光眼 (primary angle closure glaucoma)
原先就存在的異常虹膜結構,前房角被周邊異常的虹膜組織機械性阻塞,導致房水流出受阻,造成眼壓升高的一類青光眼。
(二) 隅角開放性青光眼(primary open angle glaucoma(POAG))
具有以下特徵: ① 兩眼中至少一隻眼的眼壓持續 ≥ 21mmHg ; ② 房角是開放的,具有正常外觀,且沒有與眼壓升高相關的病因性眼部或全身其它異常; ③ 存在典型的青光眼性視神經乳頭和視野損害。這類青光眼的病程進展較為緩慢,且多數沒有明顯症狀,因此不易早期發現,具有更大的危險性。
貳、血壓與青光眼的關係
一、青光眼的成因
造成青光眼的原因有很多,舉凡年紀,黑人 ,家族史,眼內壓上升,高血糖,高血壓等等,其中眼內壓(IOP, intraocular pressure )上升,是占大多數的原因。一般定義是IOP > 21 mmHg。但約有1/3到1/2的青光眼族群,是IOP低於21mmHg但其視野檢查是受損的。值得注意的是血壓問題,確實可能引發青光眼危機,根據2019 Cardiology Journal2,高血壓跟青光眼彼此之間密不可分,原因在於高血壓會影響眼內壓,當收縮壓每上升10mmHg,相對地眼內壓會上升0.21 mmHg。
二、血壓與眼內壓
血液的循環是由於動脈壓與靜脈壓造成的流體力學現象,主要是依據Ohm's law的定義。在Ohm's law有提到關於眼部血液循環,有一個專有名詞:Ocular Perfusion Pressure(眼部灌注壓,俗稱營養壓),它與全身血壓有相關性。通常評估眼內壓的方式會使用MOPP(mean ocular perfusion pressure,平均眼部灌注壓),其值計算為MOPP = 2/3 (MAP-IOP)。而此公式中MAP(平均動脈血管壓, mean brachial artery blood pressure)指的是眼部的平均動脈壓會比全身血壓低,有特定的公式: MAP = 1/3 x SBP + 2/3 x DBP。我們可以由此公式(MOPP = 2/3 (MAP-IOP))看出一些端倪,當血壓低,而眼內壓也同時低的時候,營養壓容易過低,導致眼部灌流不足,也是極容易造成青光眼。所以,在兩者間要取得平衡,考驗醫師如何針對病患個別性選擇適合他的降血壓藥物。
三、血壓藥物服用時機點
有研究指出,夜間服用血壓藥易造成營養壓不足,導致眼睛無法得到充足的營養,易有青光眼危機。文獻2提到一般人24 小時動態血壓測量,得到夜間平均動脈血壓會下降至少 10 mmHg,此是正常血壓範圍。也提到非生理性過度低血壓(夜間下降超過 20%者)才會造成引發視神經損傷,不是生理性夜間低血壓,原因前面有提及「血壓低,而眼內壓也同時低的時候,營養壓容易過低。」的概念。病人在服用降血壓藥物時,應該注意其夜間血壓下降多少比例,如下降太多應注意是否有青光眼病變發生(視覺異常或視網膜病變)。病人情況各異,正常人視神經血管會自動調節血管收縮,可調節視神經血液供應,此種病人的降血壓藥物就可依病人自身情況服用高血壓藥物。但青光眼患者視神經調節血流的功能是有些異常,如果夜間血壓下降幅度過大,可能會因為前述原因造成青光眼惡化,建議有這種狀況的病人盡可能將高血壓藥物移至白天時間服用或降低劑量。
四、神經病變
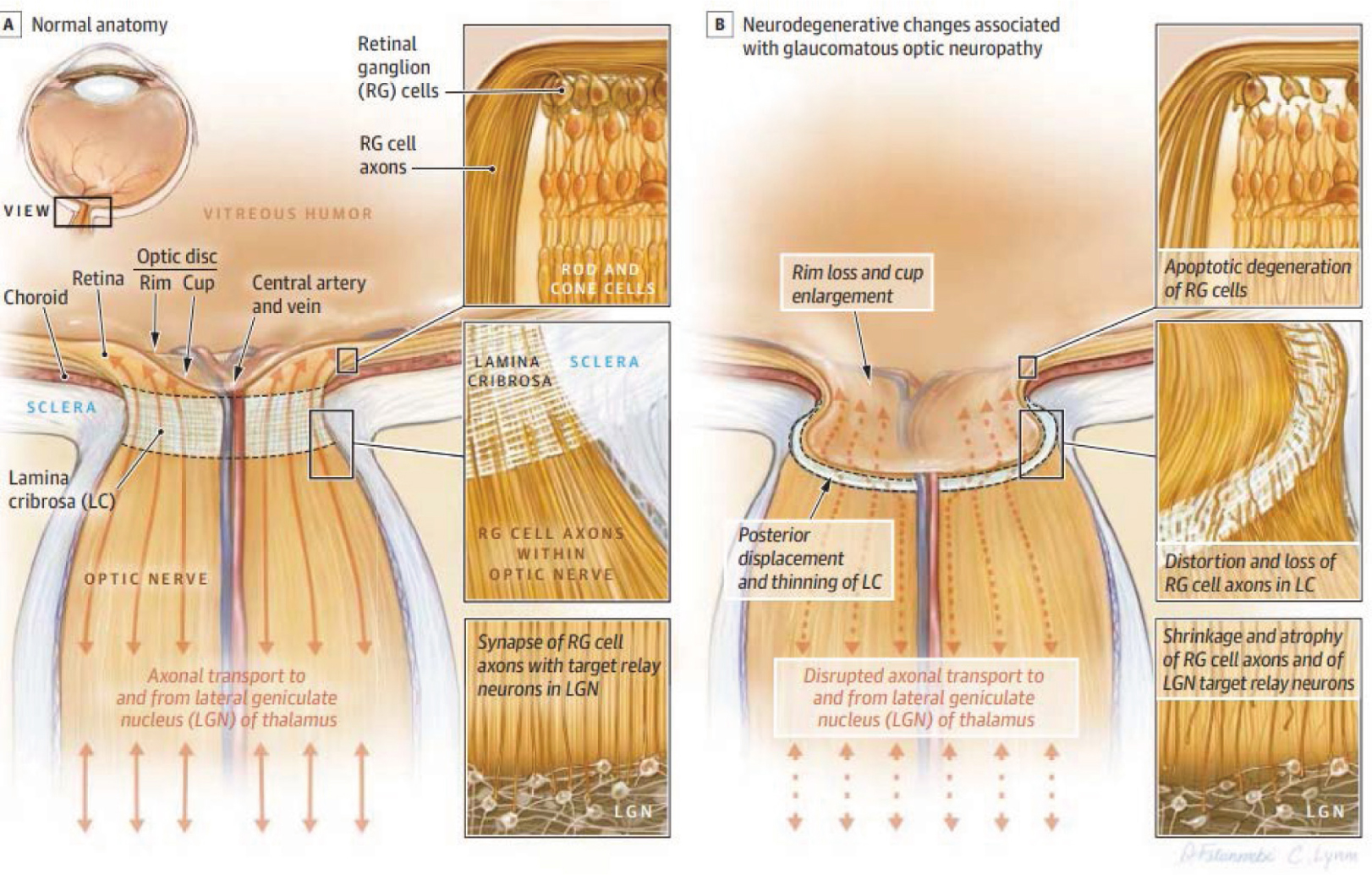
青光眼是由於視網膜神經節細胞進行性退化,導致視神經病變形成的疾病。換句話說,青光眼症狀本身就是進行性的視神經病變,其特徵是視網膜神經節細胞退化並導致視神經乳頭的變化。生理構造上來看(圖3),早期青光眼的改變是篩板層(lamina cribrosa, LC)的神經軸突、血管和膠原纖維細胞喪失,形成青光眼性杯凹,伴篩板板片結構的壓縮和融合。隨著病程進展,組織結構的改變擴張到篩板後區,使篩板弓狀後凹,最終視神經乳頭呈現凹陷。常發生在像是以下列舉的病理現象中,像是視神經中腦脊液壓力異常低、神經蛛網膜下腔導致跨椎板的大壓力梯度。另外個體眼內的微循環受損、免疫改變、細胞遭受興奮性毒性和氧化反應也可能導致青光眼,這些因素導致眼內環境改變和眼睛損傷造成細胞的病理病變過程導致視神經續發性病變,而形成青光眼。
圖三
參、藥物的研究
依據2019 Cardiology Journal2提到,針對青光眼患者高血壓藥物最佳選擇有CCB (calcium channel blockers) 和β-blockers。為什麼呢?利用一些關鍵字在pubmed搜尋文獻,來補充說明。
本篇就文獻5中,分析有哪些藥物是同時兼顧血壓與青光眼的,並解釋其相關機轉。
一、波蘭醫療保險資料分析5
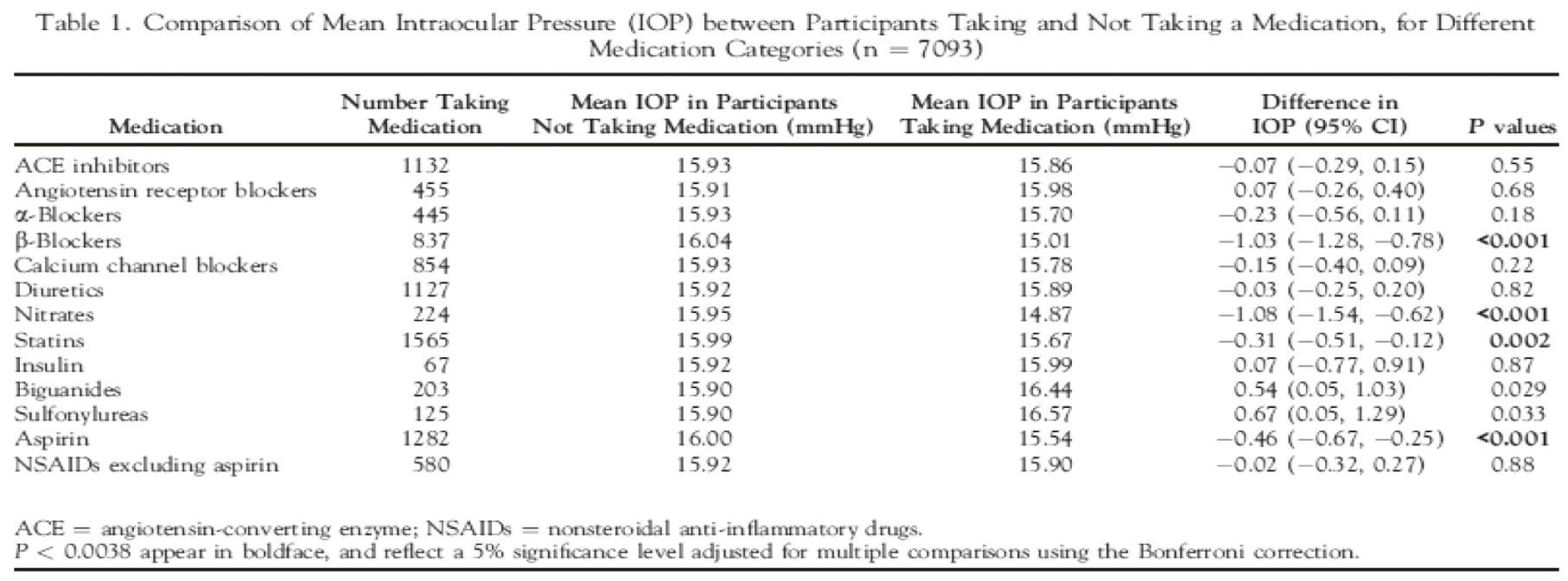
(一)研究收案對象及條件: 共7093位病人,平均年齡為68歲,年齡範圍: 48-92歲,有56%是女性,排除青光眼的問題而使用一些高血壓藥物(見下方table 15)如 ACEIs, ARBs, α-blockers, β-blockers, CCB, diuretics, nitrates,降血脂藥物 (statins),血糖藥物(如:insulin, biguanides, sulfonylureas), 阿斯匹靈(aspirin)和其他止痛藥 (nonsteroidal anti-inflammatory drugs, NSAIDs)。
(二)研究結果: 由Table 15可以看出來,人群研究結果顯示,整體看起來有在服用心血管藥物的病人其IOP是明顯低於未服用心血管藥物的病人,值得一提的是有服用β-blockers、nitrates、aspirin的人,在IOP的表現上,明顯較低於未服用β-blockers、nitrates、aspirin的人(p<0.001),差距有>1mmHg。
所收案的對象並非僅使用一種藥物控制疾病,所以針對單一藥物在進行分析( 見Table 25 & Fig 15), 發現β-blockers和nitrates,是可以降低眼內壓,減緩青光眼發病的機會,其中β-blockers表現是所有藥物最好的。
但可惜的是,nitrates 算是有爭議性的藥品,早期nitrate使用在青光眼患者身上,是禁忌症。曾有研究專門使用nitrate在青光眼病人身上,但結果顯示出nitrate並無法有效令IOP下降;只有當它能確實使病人心跳血壓下降時,IOP才可能有明顯的下降。β-blockers看資料庫的分析結果,雖然不錯。但是,由於口服,仍有全身性的作用,尤其可能造成心跳過慢,或心律不整的風險,綜合考量下,不建議貿然使用在青光眼暨高血壓病人身上。
二、關於β-blockers
目前青光眼的普遍治療藥物,多為局部眼藥水。像是Betaxolol (Betoptic®)、Timolol(Timoptic®)、Carteolol(Arteoptic®)等,而Betaxolol和Carteolol也有口服劑型用來降血壓用。文獻3中也有提及Betaxolol及部分的β-blockers用於青光眼的研究,提出兩種作用機轉的解釋(以下闡述的藥物多是局部眼用製劑):
(一) 具有似鈣離子阻斷劑作用
Betaxolol3, 它是選擇性β-1腎上腺素能受體拮抗劑(selective β-1 adrenoceptor antagonist),Betaxolol有別於其他的β-blockers可以直接作用於血管床,降低血管阻力達到降壓的目的。而propranolol或 atenolol則沒有直接作用於血管床的作用,propranolol類似verapamil的作用機轉,可以改善眼睛的血流循環,但文獻有提及它的效果是劑量依賴性(dose-dependent)。動物實驗亦說明Betaxolol作用於視網膜動脈讓血管鬆弛的強度約10 mM,比timolol 或carteolol更強。Betaxolol與其他β-blockers降眼壓的機轉類似CCB抑制鈣離子進出細胞膜,讓血管壁放鬆。
(二) 神經保護的效果
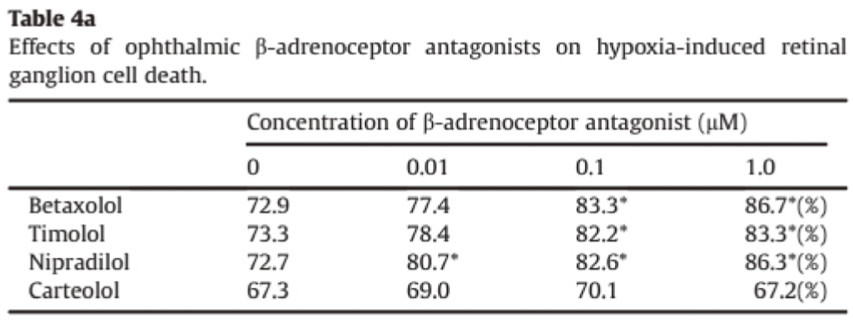
文獻3也是以Betaxolol為例,不僅可以降低眼壓還可以抵消對視網膜神經元的細胞(Retinal ganglion cells, RGCs)毒性損傷。在眾多的動物性實驗得到證實,例如: Betaxolol (10μM)減弱 NMDA誘導的 Ca2+流入大鼠分離出的視網膜標本其效力比Timolol高十倍。另外,對於缺氧或氧化損傷的大鼠RGCs,在不同濃度間的β-blockers眼用製 劑,在0.1和1μM的濃度下具有顯著的神經保護作用,像是Betaxolol,、Timolol和Nipradilol(詳見table 4a3,數字越大表示神經保護效果越好)。
(三) 不同劑型的β-blockers研究中對於眼壓的效果
早在1960年代發現靜脈注射propranolol可降低眼壓後,陸續有幾項研究證明了全身性β-blockers的降眼壓作用。然而,這些研究大多是對少數患者進行的試驗且追蹤時間不長。但卻在這少數的數據中,發現使用口服β-blockers的人其眼壓比不使用β-blockers的人低約 1 mmHg。這1 mmHg在一項鹿特丹五年青光眼發病率流行率研究調查發現,足以降低14%青光眼發病風險5。而波蘭醫療保險資料分析中約有12%的病人口服β-blockers,跟另一個歐洲醫療保險資料庫和 2012年中期英國人口統計數據的青光眼事件作比較,發現口服 β-blockers可能導致 55 歲以上人群減少POAG的發生率5。在一項來自英國保健資料庫數據的研究中,青光眼患者在診斷前 5 年內口服β-blockers與對照組比較下其罹病率有顯著降低的趨勢。文獻5所收納的資料庫分析中的確有證據表明口服β-blockers對青光眼的發展有保護作用。
在給予高血壓藥物治療後,眼壓降幅有多少是跟藥物降血壓或心律有關聯,文獻5中指出約有1/3病人使用口服β-blockers在降低血壓和心律後,其眼壓會降低。若是病人同時處方口服和局部β-blockers,其眼壓的影響力並不會加乘,甚至還有可能增加副作用,目前並不建議同時處方兩者。
三、 關於CCB (calcium channel blocker)
CCB 用於青光眼高血壓的治療,所蒐尋的文獻稍微多了些,且有一些詳細的機轉。我們主要是參照C. Mayama發表於20113 和20144 European Journal of Pharmacology4文獻。
機轉一. 增加眼部的血流4
CCB其作用機轉是抑制鈣離子進出細胞膜,尤其是血管平滑肌,當鈣離子通道被阻斷後,血管本身會放鬆,血流自然就順暢。照此理論基礎,眼部的局部血管平滑肌會放鬆,自然進入眼睛的血流量會上升,眼睛會得到充足的營養,視神經細胞不容易因營養不足而死亡,或功能上的受損。
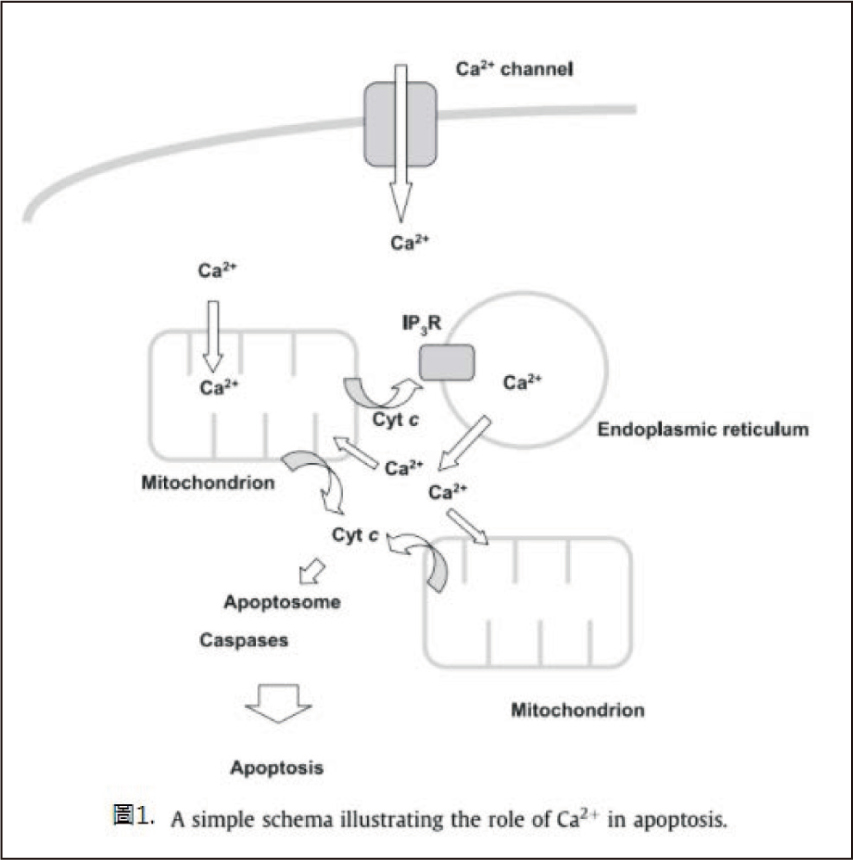
機轉二. Calcium channel blockers在細胞凋亡路徑中所扮演的角色4 (下方圖14)
細胞凋亡必經路徑,在於細胞中的粒腺體,當細胞預備凋亡時,粒腺體會釋放出Cyt C,令內質網中更多的鈣釋放出來,不斷去刺激粒腺體釋放出Cyt C,當細胞內Cyt C 濃度過高時,就會讓細胞的凋亡機制啟動。若此時給予calcium channel blockers,就會阻斷鈣離子通道,使鈣無法大量進入到粒腺體內,Cyt C 濃度不夠,自然細胞會減緩凋亡的速度。
機轉三. 神經保護效果4
詳細的機轉其實尚未明朗,推測與NMDA受體(N-methyl-D-aspartate receptor)有關,普遍存在於神經細胞上,它亦是調節神經細胞離子通道的一種受體。有學者4推論到因為CCBs能影響NMDA受體所調節的鈣離子通道,改善眼睛的局部血流循環,細胞獲得充足的營養,帶來的效果。另有一說法是,抗氧化,以致神經細胞不易死亡。
四、其他CCB藥物的研究:
(一) Nifedipine
在過去有學者(Gasser and Flammer (1987)4, Gasser et al. (1990)4, Flammer et al. (2002)4) 提出外周血管痙攣作用(peripheral vasospasm)是造成青光眼的原因。而nifedipine 以口服的方式用在大鼠身上,確實能縮短血流停止的時間。但在2001年 Rainer等人研究,給予開放性青光眼病人口服一天40mg 的nifedipine三個月,並未有顯著性的改善。另外,1997 Wilson4等人研究,給予開放性青光眼或是正常眼壓的青光眼病患口服3周到6個月的nifedipine,劑量是30-60mg/ day,也是對於眼球的血流動力學未見明顯的影響。但對於某些青光眼患者,本身外周血管收縮有問題,服用nifedipine,反而能增加眼搏振幅,促進血流改善( Schmidt et al., 1996,1997) 4。
(二) Nimodipine
本藥品具有較高脂溶性和能穿透血腦屏障的特性,預期藥物能在眼組織分佈更廣泛。在2004,Michalk4等人的研究中,給予正常眼壓和血管痙攣問題的青光眼患者口服30mg/day能增加視網膜血流量。
(三) Nilvadipine
本藥品為高脂溶性特性的藥物。目前台灣無,1990年已在歐洲和日本處方用來治療高血壓。關於它在青光眼的研究中,1999年Tomita4等人研究中,正常眼壓的青光眼患者給予口服4mg/day nilvadipine為期12週,發現患者的視網膜血流量增加,同時降全身血壓效果很輕微。2008,Koseki4等人更證實此藥能增加視網膜血流量約30-40%,對心跳或血壓幾乎是沒有影響。
(四) Lomerizine4
本藥品主要是用來治療偏頭痛,目前台灣無。但近年來它用於青光眼和視神經損傷的研究略有成效,在視網膜損傷的情況下。靜脈注射0.03 mg / kg的劑量可預防麩胺酸(glutamate)誘導的神經毒性,同時還提供針對N-methyl-D-aspartate (NMDA )和海藻酸鹽(alginate)誘導的神經毒性的保護作用。已顯示Lomerizine 對NMDA receptor或海藻酸酯受體幾乎沒有親和力,因此據信在這些情況下其對神經毒性的保護作用是由於通過電壓依賴性鈣通道阻滯了Ca2+流入。 通過阻斷這些通道並防止Ca2+釋放,Lomerizine可增加視神經頭部的循環。這些效果表明,Lomerizine可能被證明是治療缺血性視網膜疾病(例如青光眼)的有效方法。另外,Lomerizine在細胞凋亡的途徑中能阻斷Ca2+中的作用。細胞內鈣的減少還通過降低通透性來防止壞死,並且通過減少鈣依賴性凋亡因子來減少凋亡死亡。
(五)Iganidipine4
水溶性鈣離子阻斷劑,目前仍只在動物實驗階段,研究中給予兔子0.03%眼藥水,連續滴20天,可透過抑制Endothelin 1(ET-1)的作用,阻斷鈣離子活性,增加視網膜的血流量外,亦可讓房水流出,改善青光眼的症狀。後續發展,令人期待。
肆、結論
關於青光眼患者對於高血壓藥物的選擇,依據所搜尋的文獻結果來看,並無有明確的口服藥物是確實對IOP造成影響,但改善眼睛的血流供應,確實在CCB或是β-blockers的實驗中能發現能降低是神經損害的風險。另外降眼壓治療應該沒有對中樞神經系統視覺中繼發性神經變性的直接益處。罹患青光眼又同時有高血壓問題的病人,可以不用過度擔心高血壓藥物會加強青光眼藥物降眼壓的問題。而針對CCB或是β-blockers,主要是因為CCB有一些理論基礎,部分藥物(Nifedipine, Nimodipine)確實能增加視網膜血流量,進而影響IOP,也比β-blockers具較少的全身性副作用;β-blockers則是有局部製劑用於青光眼治療,但有部分研究5指出口服β-blockers引起的血壓降低可能會減少對視神經的灌注,這反過來可能會增加青光眼的風險。無論是處方β-blockers或是CCBs建議最好還是能定期追蹤青光眼狀況。
其他尚在研究的藥物或許指日可待,可為青光眼且患有高血壓的患者帶來更安全更有效的治療。
Explore the choice of hypertension drugs for glaucoma
Yu-Ti Chang1, Yu-Huey Chang1, Mei Lan Ko2
1Department of Pharmacy, National Taiwan
University Hsin-Chu Hospital
2Department of Ophthalmology, National Taiwan
University Hsin-Chu Hospital
Abstract
About the treatment of hypertension, doctors and pharmacists are aware for some special groups, mostly in the control of hypertension drug selection in accordance with the treatment of high blood pressure medication guide. In the treatment guidelines, for special groups, most of them point out the choice of suitable hypertension drugs. For example, the first choice of treatment drugs for diabetic patients is usually ACEIs (angiotensin converting encyme inhibitor) or ARBs (angiotensin receptor blocker), etc., which are patients who lack glaucoma groups.
Why should we discuss the choice of blood pressure drugs for the glaucoma group? Most of the causes of glaucoma are increased intraocular pressure, but about 40% of patients will develop glaucomatous neuropathy without evidence of increased intraocular pressure. The cause may be related to optic nerve damage and abnormal arterial blood pressure, so intraocular pressure is too high. Low, high or ocular perfusion pressure (OPP) problems are considered possible risk factors. In recent years, some patients with glaucoma also have high blood pressure. Related drug researches include calcium ion blockers and beta blockers. B-blockers in commonly used topical preparations, such as betaxolol, carteolol, and timolol, have anti-sympathetic effects, reduce the formation of aqueous humor and achieve the purpose of lowering intraocular pressure (intraocula pressure, IOP), and are used to treat glaucoma. In the past, the pharmacological mechanism familiar to pharmacists was common. Although calcium ion blockers do not currently have a topical preparation in Taiwan, studies on their use in the treatment of glaucoma have found that they may achieve the purpose of treating glaucoma by regulating blood pressure, promoting blood flow in the eye to supply eye nutrition and other mechanisms. This article analyzes several articles to discuss the choice of hypertension drugs for glaucoma.
參考資料:
1. Deborah S Jacobs, MD. Open-angle glaucoma: Epidemiology, clinical presentation, and diagnosis [ uptodate 2020 ]
2. Janusz Skrzypecki, Marcin Ufnal1, Jacek P. Szaflik, et al. Blood pressure and glaucoma: At the crossroads between cardiology and ophthalmology. Cardiology Journal 2019, Vol. 26, No. 1, 8–12
3. Makoto Araie, Chihiro Mayama. Use of calcium channel blockers for glaucoma. Progress in Retinal and Eye Research January 2011, Vol.30, Issue 1, 54-71
4. Chihiro Mayama. Calcium channels and their blockers in intraocular pressure and glaucoma. European Journal of Pharmacology 739 (2014) 96-105
5. Anthony P. Khawaja, MPhil, FRCOphth, et al. Systemic medication and intraocular pressure in a British population. Ophthalmology Volume 121, Number 8, August 2014
通訊作者:張鈺笛/通訊地址:新竹市經國路一段442巷25號
服務單位:新竹臺大分院新竹醫院藥劑部/聯絡電話:(O) 03-5326151 ext 4111