BiTE免疫治療的進展及衍生
鄭吉元1、陳宜正1、蔡慈貞1,2、張文震3
1林口長庚紀念醫院藥劑部藥師、2新生醫護管理專科學校兼任講師、3林口長庚紀念醫院腫瘤科醫師
摘要
雙特異性T細胞銜接系統 (bispecific T-cell engager,BiTE) 是由兩個不同來源的單鏈變異區片段組成,其一來自T細胞的表面分子CD3,另一來自腫瘤相關抗原,此設計可以使得T細胞和腫瘤細胞之間形成免疫突觸,引導T細胞去殺死帶有此腫瘤抗原的腫瘤細胞。Blinatumomab是第一個核准上市的BiTE藥品,其適應症是B細胞之急性淋巴細胞白血病。BiTE和嵌合抗原接受器T細胞 (CAR-T) 皆是基於T細胞的免疫治療,且其作用皆不受主要組織相容性複合體 (MHC) 影響,因此即使癌細胞無MHC表現或是MHC有缺陷,癌細胞仍然會被擊殺。BiTE的進展及衍生包括:延長半衰期的HLE BiTE、標準長度BiTE、多價BiTE、雙重親和力再定位 (DART)、串聯雙抗體 (TandAb) 以及三特異性T細胞銜接系統 (CiTE)、SMITE、雙特異性殺手銜接系統 (BiKE)和三特異性殺手銜接系統 (TriKE)。BiTE的臨床試驗,大多用於血液科癌症,例如:白血病、多發性骨髓瘤和淋巴瘤;實體腫瘤方面則針對不同癌症的腫瘤相關抗原為目標對象。未來BiTE是朝向能克服因腫瘤相關抗原消失和腫瘤異質性造成免疫逃脫情形。隨著BiTE分子結構的修飾,以及利用遺傳工程聯合其他治療,期盼不久的將來BiTE能在最小的毒性下發揮最大的抗腫瘤作用。
關鍵字: 癌症、免疫治療、BiTE
壹、前言
雙特異性T細胞銜接系統 (bispecific T-cell engager,BiTE) 是一種雙特異性抗體,可以引導人體免疫細胞中的T細胞,主要是毒殺型T細胞去攻擊癌細胞,猶如導向飛彈。Blinatumomab是第一個核准上市的BiTE藥品,用於血液科癌症。本文將探討BiTE的最新進展及其衍生發展。
貳、BiTE的結構及其作用機轉
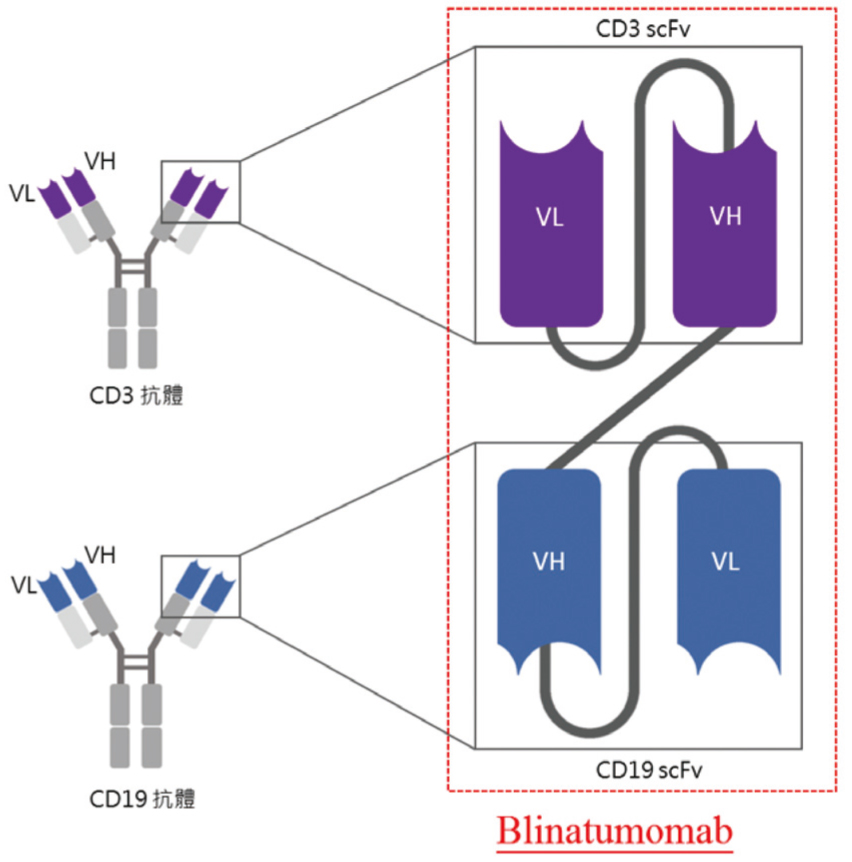
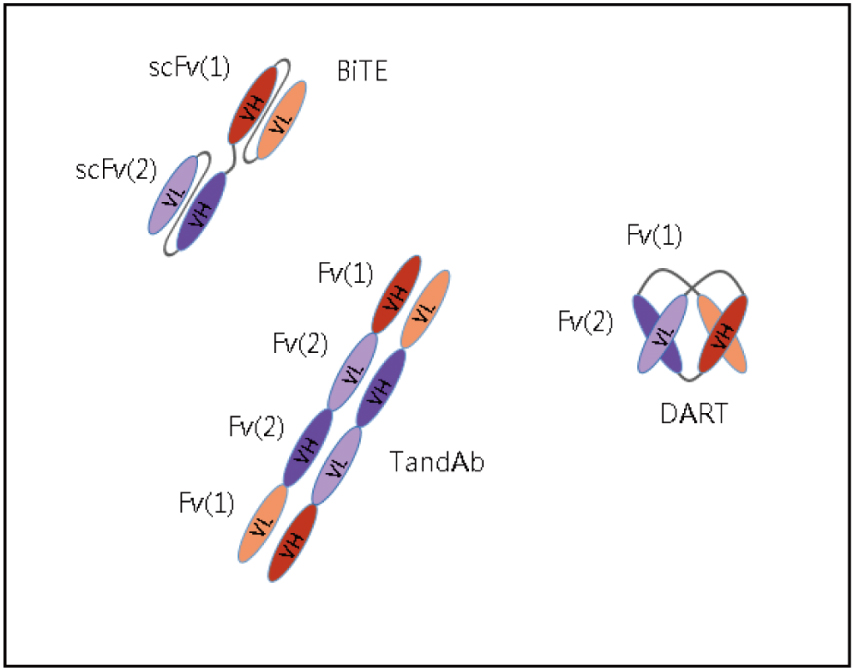
BiTE是由兩個不同來源的單鏈變異區片段 (single-chain variable fragment,scFv) 組成,其一來自T細胞的表面分子CD3,另一來自腫瘤相關抗原 (tumor-associated antigen,TAA)。CD3與T細胞接受器複合體結合後可活化T細胞。以blinatumomab為例,它是CD19 x CD3 BiTE (圖一)1,CD19是B細胞的表面抗原,blinatumomab的適應症是B細胞之急性淋巴細胞白血病1。BiTE可以使得T細胞和腫瘤細胞之間形成「免疫突觸 (immune synapse)」2,引導T細胞去殺死帶有此腫瘤抗原的腫瘤細胞。此外,BiTE也可促進T細胞增生1。
圖一 Blinatumomab (CD19 x CD3 BiTE)
scFv:單鏈變異區片段 (single-chain variable fragment);
VH:重鏈變異區 (variable region of heavy chain);
VL:輕鏈變異區 (variable region of light chain)
參、BiTE與CAR-T之差異
BiTE和嵌合抗原接受器T細胞 (chimeric antigen receptor-T cell,CAR-T) 皆是基於T細胞的免疫治療。T細胞活化第一步需要「主要組織相容性複合體 (major histocompatibility complex,MHC)」將腫瘤抗原呈現給T細胞;然而,BiTE和CAR-T的作用則不受MHC影響,因此即使癌細胞無MHC表現或是MHC有缺陷,癌細胞仍然會被擊殺2。兩者的不同處是BiTE是抗體片斷,而CAR-T是T細胞;又BiTE是活化和增生體內原有的T細胞,而CAR-T則是將T細胞改造後再回輸到病人體內2。
肆、BiTE的進展及衍生
一、延長半衰期 (half-life-extended,HLE) BiTE
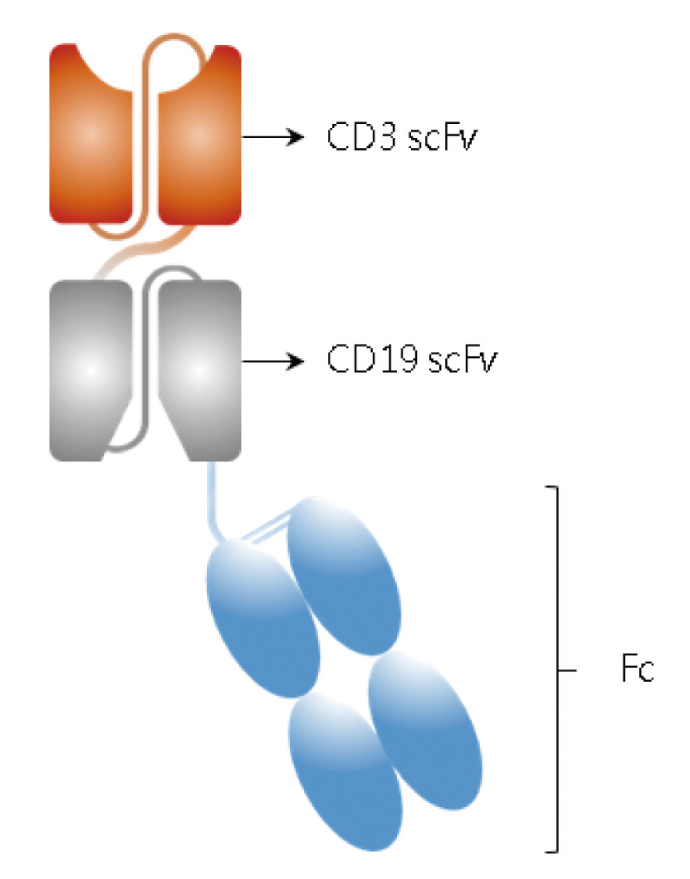
BiTE的分子量小,半衰期短,因此需要連續靜脈輸注2。以blinatumomab為例,其半衰期為2.1小時,需要連續靜脈輸注28天3。HLE BiTE的設計是BiTE加上穩定區片段 (constant fragment,Fc),如此可延長半衰期,而不用連續輸注,例如:AMG562 (圖二)。
圖二 AMG562 (CD19 x CD3 HLE BiTE)
HLE:延長半衰期 (half-life-extended);Fc:穩定區片段
(constant fragment);
scFv:單鏈變異區片段 (single-chain variable fragment)
AMG562是CD19 x CD3 HLE BiTE,現正進行第一期臨床試驗2。值得注意的是blinatumomab已有皮下注射劑型正進行臨床試驗2。
二、標準長度 (full-length) BiTE
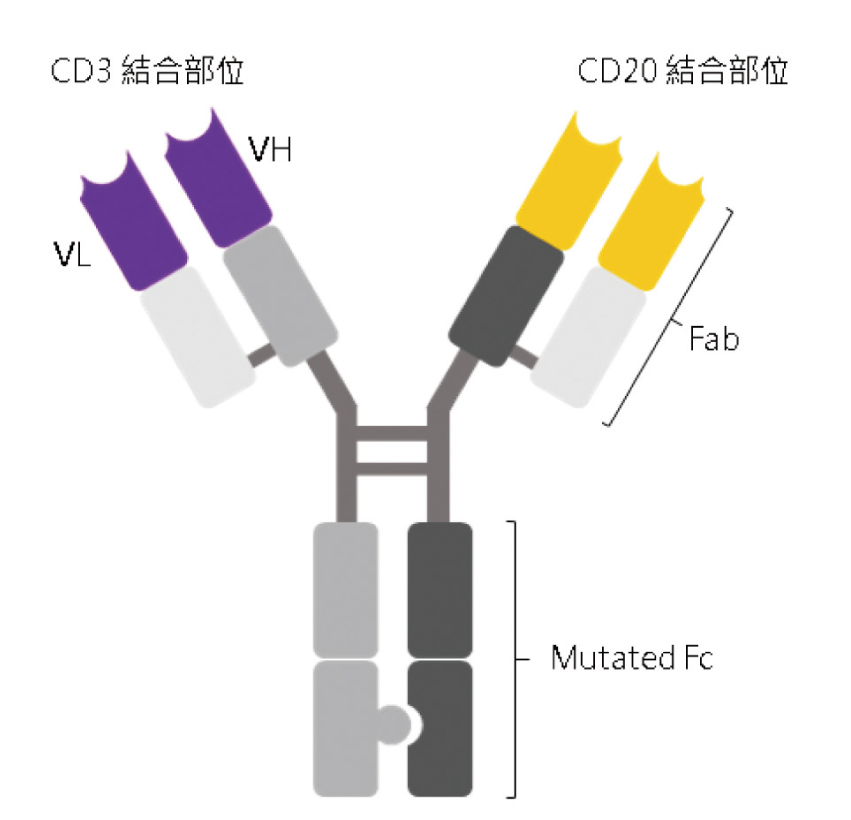
標準長度BiTE保留了抗體的完整結構,其半衰期長。DuoBody雙特異性抗體是CD20 x CD3標準長度BiTE (圖三),其結構是免疫球蛋白G1,其中Fc經突變已無功能1。CD20亦是B細胞的表面抗原。
圖三 DuoBody [CD20 x CD3 標準長度 (full-length) BiTE]
Fab:抗原結合區片段 (antigen-binding fragment);Mutated
Fc:突變的穩定區片段 (mutated constant fragment);VH:重鏈變異區
(variable region of heavy chain);VL:輕鏈變異區
(variable region of light chain)
三、多價BiTE
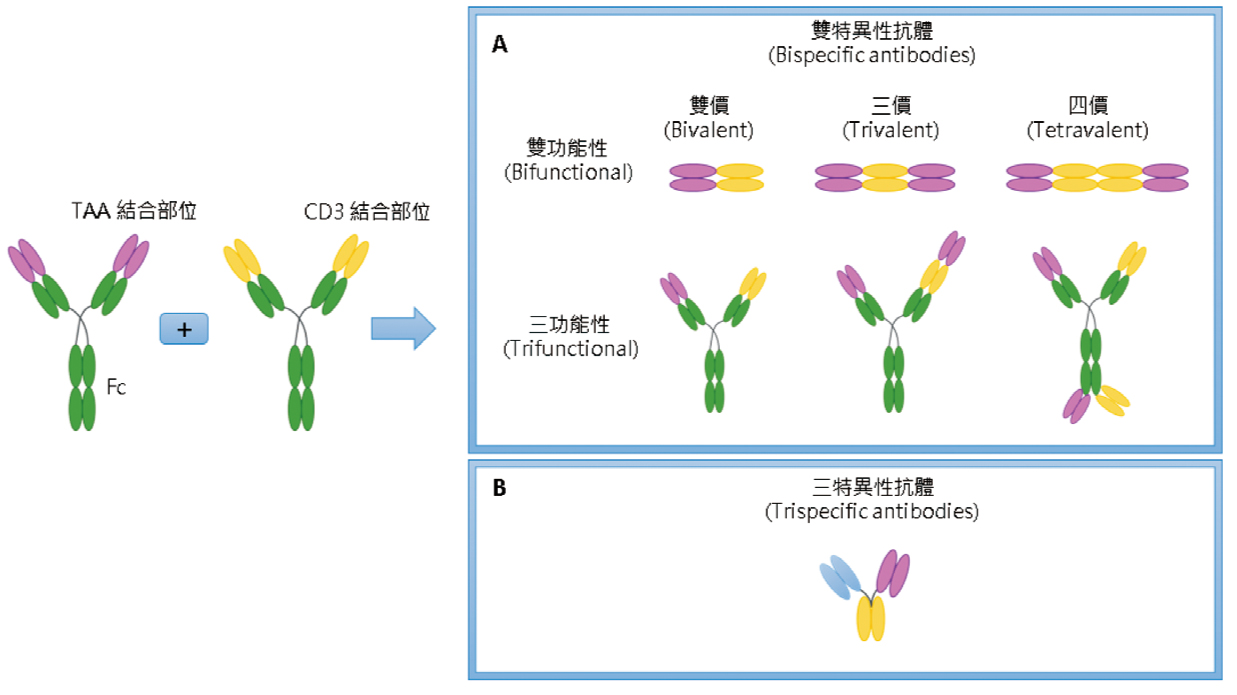
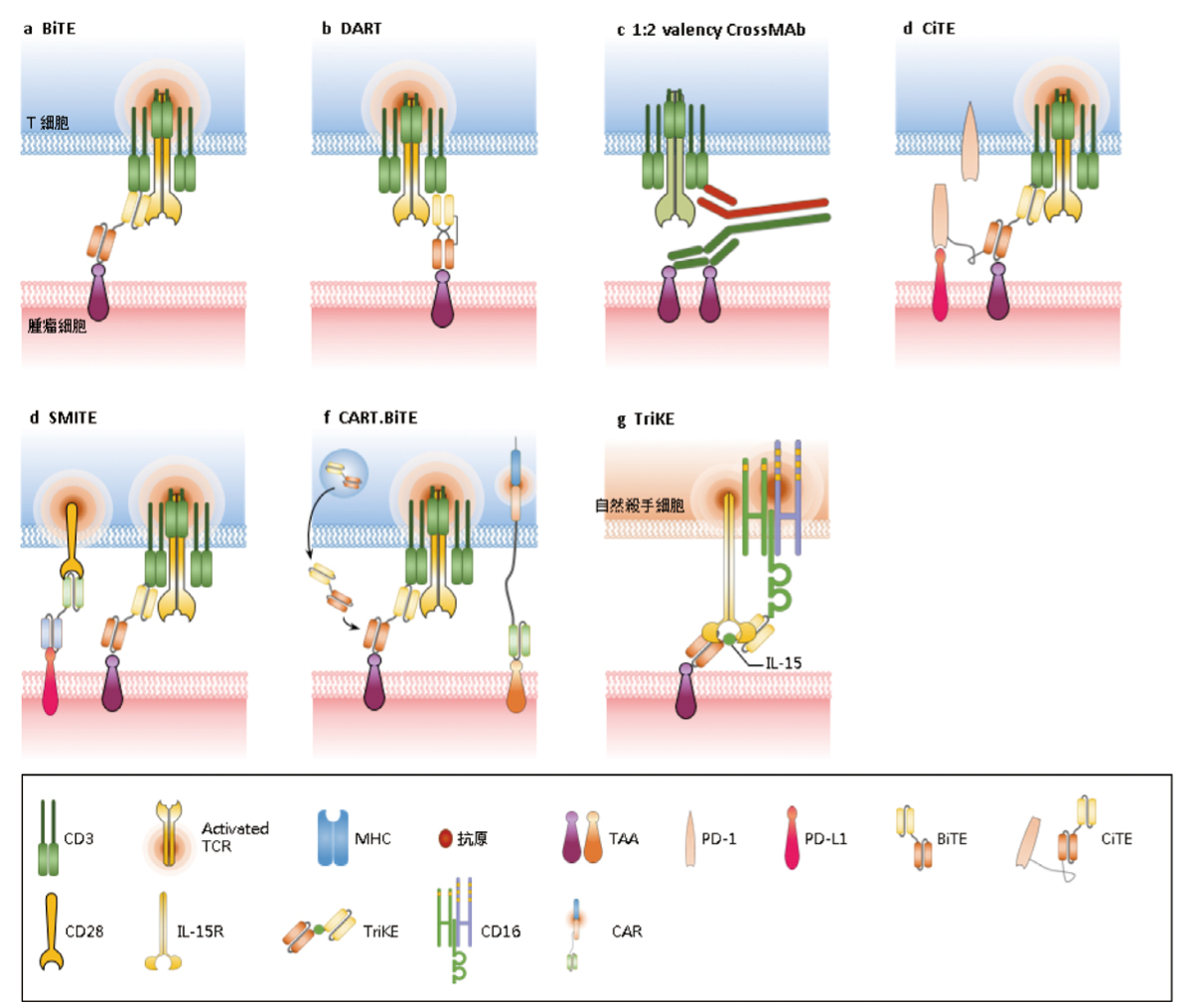
傳統的BiTE其結構是兩價 (bivalent) 雙功能性 (bifunctional),即TAA:CD3為1:1且結構只是抗體片斷 (圖四A)2,4。經由CrossMAb技術平台可以製作TAA:CD3為2:1且具有完整抗體結構的BiTE,即三價三功能性BiTE (圖四A、圖五c)2,4。TAA:CD3為2:1的設計可以加強BiTE對腫瘤細胞的辨識,以避免在無TAA時,CD3自行引起T細胞活化,造成不必要的過度免疫反應2。
圖四 多價、多功能性、多特異性抗體的結構4
TAA:腫瘤相關抗原 (tumor-associated antigen)
四、雙重親和力再定位 (dual affinity re-targeting,DART)
不同於BiTE,DART的變異區片段呈現緊密交錯 (圖五b、圖六)2,5。DART的結構穩定性比BiTE好,也比BiTE更能有效的導引T細胞朝向癌細胞2。DART可加上Fc,以延長半衰期。
圖五 BiTE的進展及衍生2 (詳細內容見內文)
五、串聯雙抗體 (tandem diabody,TandAb)
又稱為四價雙特異性抗體構造,即一種抗原有兩個結合部位 (圖四A、圖六)4-6。TandAb的半衰期比BiTE和DART長6。TandAb不含Fc。
圖六 雙特異性抗體結構的變化5
六、 抑制性檢查點T細胞銜接系統 (checkpoint-inhibitory T cell engager,CiTE)
第一類程序性細胞死亡蛋白質 (programmed cell death-1,PD-1) 是屬於抑制性免疫檢查點,其配體 (ligand) 稱為PD-L1。當T細胞上的PD-1和腫瘤細胞上的PD-L1結合後會造成T細胞凋亡。CiTE的設計是將BiTE結合可抑制PD-1/PD-L1作用於同一分子 (圖五d)2。CiTE的優點是抑制PD-1/PD-L1局限在TAA附近的「免疫突觸」中發生,因此不會發生全身性免疫相關副作用2。CiTE也可克服BiTE的藥物阻抗2。
七、 同時多重交互作用BiTE (simultaneous multiple interaction BiTE,SMITE)
SMITE是由兩個分開的BiTE組成,其一為 TAA x CD3 BiTE,另一為PD-L1 x CD28 BiTE (圖五e)2。SMITE中PD-L1 x CD28 BiTE的介入,使得PD-L1抑制訊號轉變為刺激訊號,如此加強了TAA x CD3 BiTE作用,也可克服TAA x CD3 BiTE的藥物阻抗2。
八、 雙特異性殺手細胞銜接系統 (bispecific killer cell engager,BiKE)
BiKE是將BiTE中的T細胞改為自然殺手細胞,又CD16是自然殺手細胞的表面抗原。因此,BiKE是TAA x CD16。
九、 三特異性殺手銜接系統 (trispecific killer engager,TriKE)
TriKE是三特異性抗體 (圖四B),是BiKE再連接介白素15 (interleukin 15,IL-15),IL-15是屬於刺激免疫反應的細胞激素 (cytokine) (圖五g)2。
伍、BiTE的臨床試驗
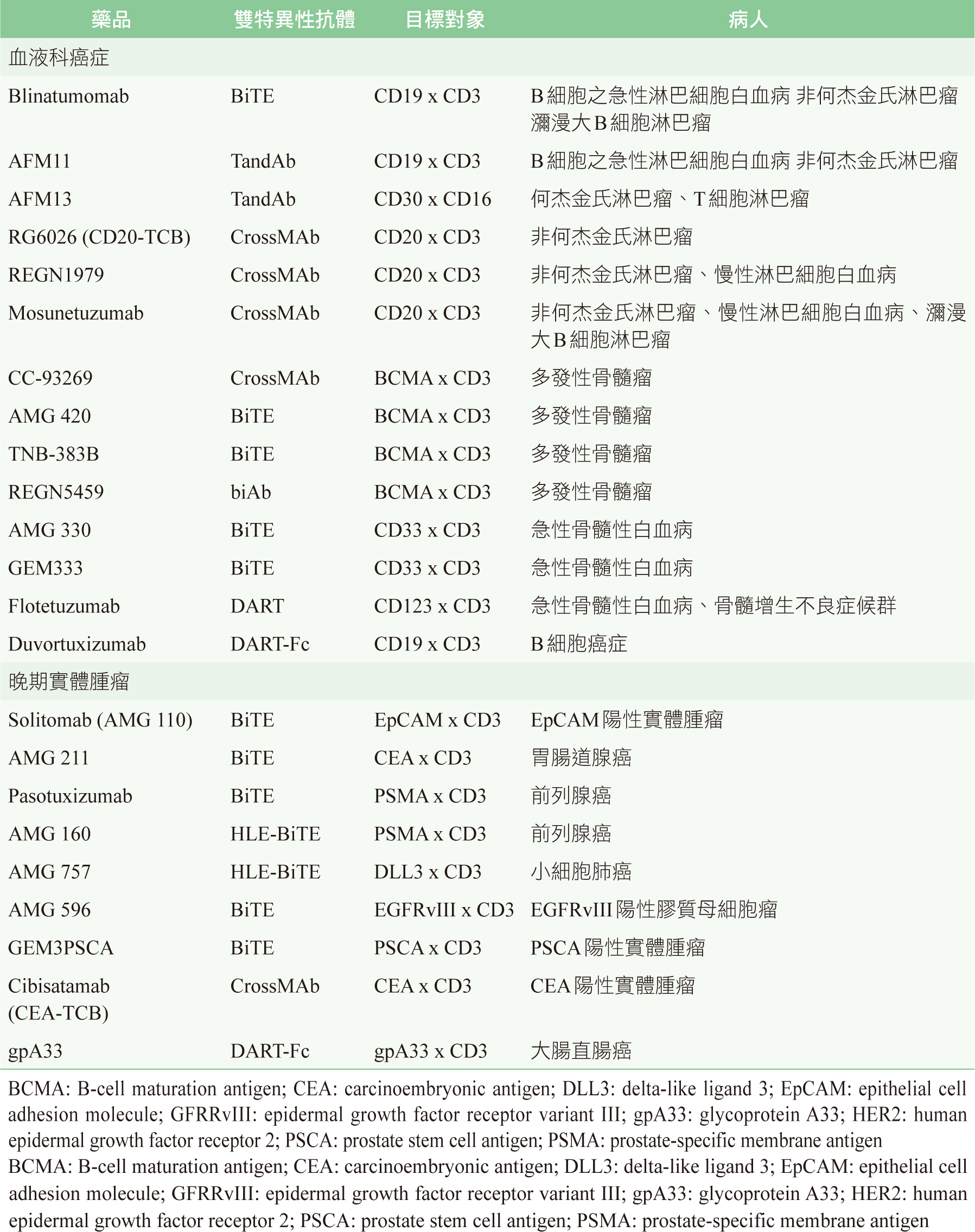
BiTE的臨床試驗,大多用於血液科癌症。表一是BiTE單獨使用的臨床試驗,表二則是BiTE併用其他藥品的臨床試驗;其臨床治療類別,大致可分為血液科癌症和實體腫瘤,敘述如下:
表一 BiTE單獨使用的臨床試驗2
表二 BiTE併用其他藥品的臨床試驗2
一、血液科癌症
除了B細胞之急性淋巴細胞白血病外,BiTE有進行多發性骨髓瘤、急性骨髓性白血病、非何杰金氏淋巴瘤之多項臨床試驗。其中值得一提的是治療多發性骨髓瘤的BiTE—AMG 420。由於B細胞成熟抗原 (B-cell maturation antigen,BCMA) 是多發性骨髓瘤細胞上相當重要的表面抗原,因此AMG 420即是針對BCMA設計的BiTE。第一期臨床試驗結果顯示,對於曾經已使用過平均四線以上仍然無效的多發性骨髓瘤病人,使用AMG420仍有31%患者有效 (17%達到完全緩解);接受最大容忍劑量400 µg/day者有高達70%患者有效 (50%達到完全緩解)2,7。目前,AMG420正在進行第二期臨床試驗,劑量為400 µg/day7。此外,B細胞的表面抗原CD19、CD20、CD22、CD79b;急性骨髓性白血病的腫瘤抗原CD33、CD123;何杰金氏淋巴瘤或T細胞淋巴瘤的腫瘤抗原CD30,皆是BiTE研究的目標對象1。
BiTE用於血液科癌症的組合療法中,大部分是併用PD-1/PD-L1免疫檢查點抑制劑,或是併用可與B細胞上CD20抗原結合的單株抗體。
二、實體腫瘤
相較於血液科癌症,BiTE在實體腫瘤的臨床試驗較少。其中值得一提的是AMG 596。AMG 596是EGFRvIII x CD3 BiTE。表皮生長因子受體III變異型(epidermal growth factor receptor variant III,EGFRvIII) 只存在於腦部膠質母細胞瘤,因此是一不錯的標記。此外,針對前列腺癌的TAA—前列腺特異性膜抗原 (prostate-specific membrane antigen,PSMA)、HER2陽性乳癌的TAA—人類表皮生長因子受體2 (human epidermal growth factor receptor 2,HER2)、實體腫瘤共同的TAA—上皮細胞粘附分子 (epithelial cell adhesion molecule,EpCAM),也都是BiTE研究的目標對象1。
陸、BiTE的未來展望
未來BiTE是朝向能克服因TAA消失和腫瘤異質性造成免疫逃脫情形。目前,有兩個作法:
一、CART.BiTE
研究發現EGFRvIII CAR-T對於有EGFRvIII表現的腦部膠質母細胞瘤有效,但是只能短暫疾病控制,而且此CAR-T對未突變的野生型 (wild type) EGFR無效2。免疫逃脫機轉之一認為是EGFR過度表現2。今利用遺傳工程將EGFRvIII CAR-T和EGFR x CD3 BiTE編碼基因融合 (CART.BiTE) (圖五f),如此當CAR-T發揮作用時也同時釋放BiTE來引導T細胞攻擊過度表現的EGFR2。有趣的是此BiTE只局限在腫瘤處,而不會在血液中測到2,如此可降低其全身毒性。CART.BiTE目前仍在動物實驗階段。
二、溶瘤病毒攜帶BiTE編碼基因
溶瘤病毒 (oncolytic virus,OV) 也是癌症免疫治療之一。OV可破壞分解腫瘤,即具有溶瘤的特性。OV可以進行基因修飾以增進抗腫瘤效果,也可以促使T細胞進入腫瘤內部,將原本的「冷」腫瘤 (cold tumor) 轉變為「熱」腫瘤 (hot tumor) 8。老鼠實驗顯示,將腺病毒 (adenovirus) 加入EGFR x CD30 BiTE編碼基因 (OAdBiTE) 合併投予葉酸接受器CAR-T,可明顯活化和促進CAR-T增生,也可使得不帶有CAR的T細胞導向有EGFR表現的腫瘤細胞2。除此之外,腺病毒可直接殺死腫瘤細胞,以及腫瘤細胞死亡會釋放出TAA而啟動後續的抗腫瘤免疫反應2。在癌症治療上,經BiTE武裝後的溶瘤病毒是具潛力的設計。
柒、結論
BiTE導引T細胞攻擊腫瘤細胞在血液科癌症已獲有效證實;然而,其療效無法持久。主因為BiTE活化T細胞時,PD-1/PD-L1訊號會被啟動而造成T細胞耗竭;若BiTE併用PD-1/PD-L1免疫檢查點抑制劑或是使用CiTE或許可以突破此免疫逃脫,仍有待後續臨床試驗證明。BiTE用於實體腫瘤治療仍是一大挑戰,BiTE要能順利進入腫瘤內部,且需克服不利於T細胞作用的腫瘤環境。隨著BiTE分子結構修飾,以及利用遺傳工程聯合其他治療,期盼未來BiTE能在最小毒性下發揮最大抗腫瘤作用。
Advances in BiTE Immunotherapy and Beyond
Chi-Yuan Cheng1, Yi-Cheng Chen1, Tzu-Cheng
Tsai1,2, Wen-Cheng Chang3
1Department of Pharmacy, Chang Gung Memorial
Hospital, Linkou
2Department of Long Term Care, Hsin Sheng Junior
College of Medical Care and Management
3Department of Oncology, Chang Gung Memorial
Hospital, Linkou
Abstract
Bispecific T-cell engager (BiTE) is composed of two single-chain variable fragments from two sources, one is from CD3, the surface molecule of T cells, and the other is from the tumor-associated antigen (TAA). BiTE design enables formation of the immune synapse between T cells and tumor cells, guiding T cells to kill tumor cells with this TAA. Blinatumomab is the first approved BiTE for treating B-cell acute lymphoblastic leukemia. BiTE and chimeric antigen receptor-T cells (CAR-T) are both T cell-based immunotherapy, and their effects are not affected by the major histocompatibility complex (MHC), so cancer cells are still killed despite without MHC presentation or defective MHC of cancer cells. The development of BiTE and beyond include HLE BiTE with extended half-life, full-length BiTE, polyvalent BiTE, dual affinity re-targeting (DART), tandem diabody (TandAb), CiTE, SMITE, BiKE, and TriKE. Clinical trials of BiTE are majority of hematological cancers, such as leukemia, multiple myeloma and lymphoma, and for solid tumor are focused on a variety of TAAs of different cancers. In the future, BiTE aims to overcome the immune escape caused by the disappearance of TAAs and tumor heterogeneity. With the modulation of the molecular structure of BiTE, as well as utilization of genetic engineering in combination with other therapies might greatly enhance BiTE antitumor activity with minimal toxicity in the near future.
參考資料:
1. Trabolsi A, Arumov A, Schatz JH: T Cell-activating bispecific antibodies in cancer therapy. J Immunol 2019;203:585-92.
2. Goebeler ME, Bargou RC: T cell-engaging therapies—BiTEs and beyond. Nat Rev Clin Oncol 2020 Apr 2. doi: 10.1038/s41571-020-0347-5. Online ahead of print.
3. Product Information: Blinatumomab
4. Paci A, Desnoyer A, Delahousse J, et al: Pharmacokinetic/pharmacodynamics relationship of therapeutic monoclonal antibodies used in oncology: Part 1, monoclonal antibodies, antibody-drug conjugates and bispecific T-cell engagers. Eur J Cancer 2020;128:107-18.
5. Golay J, Regazzi M: Key features defining the disposition of bispecific antibodies and their efficacy in vivo. Ther Drug Monit 2020;42:57-63.
6. Duell J, Lammers PE, Djuretic I, et al: Bispecific antibodies in the treatment of hematologic malignancies. Clin Pharmacol Ther 2019;106:781-91.
7. [No authors listed] BiTE therapy active in multiple myeloma. Cancer Discov 2019;9:157-8.
8. Butterfield LH, Kaufman HL, Marincola FM: Cancer immunotherapy principles and practice, 1st ed. Demos Medical, New York, 2017:375-403.
通訊作者:鄭吉元/通訊地址:桃園市龜山區復興街五號林口長庚醫院病理大樓6樓化療藥局
服務單位:林口長庚紀念醫院藥劑部/聯絡電話:(O) 0975367860