晚期肝細胞癌藥物治療進展
楊慧心1、鄭吉元2、陳敦凉2
1桃園長庚紀念醫院藥劑組、2林口長庚紀念醫院藥劑部
摘要
根據台灣衛生福利部統計,肝癌40年來都為全國十大癌症死因的第二位。肝細胞癌 (hepatocellular carcinoma,HCC) 佔原發性肝癌的90%,致病原因主要是B型或C型肝炎病毒感染或者酒精濫用導致。長久以來,sorafenib是晚期HCC的標準第一線治療藥物。最近根據一項第三期IMbrave150試驗結果顯示,免疫檢查點抑制劑atezolizumab合併bevacizumab其整體存活期優於sorafenib,此組合已普遍在臨床使用於第一線治療晚期HCC。此外,第一線治療藥物還有lenvatinib。晚期HCC的後線治療,核准藥物包括小分子標靶藥物regorafenib、cabozantinib和大分子單株抗體ramucirumab,以及免疫檢查點抑制劑nivolumab、pembrolizumab、ipilimumab併用nivolumab。晚期HCC的未來治療方向為(1)標靶藥物合併免疫檢查點抑制劑,(2)合併兩種不同機轉的免疫檢查點抑制劑。
關鍵字: Hepatocellular carcinoma、晚期肝細胞癌、HCC
壹、前言
根據台灣衛生福利部統計,每年約有1萬人以上被診斷為肝癌,又肝癌為全國十大癌症死因的第二位,2020年死亡7773位,僅次於肺癌1。肝細胞癌 (hepatocellular carcinoma,HCC) 佔原發性肝癌的90%,致病原因主要是B型或C型肝炎病毒感染或者酒精濫用導致。早期診斷HCC可手術切除或採用局部栓塞治療,一旦進展至晚期則需給予全身性藥物治療。近年來,晚期HCC有不少藥物核准上市,本文將詳述這些藥物及其未來展望。
貳、第一線藥物
由於HCC是富含血管的癌症,因此抑制血管新生的藥物可用於治療HCC。晚期HCC的第一線治療藥物如下:
一、Sorafeneb
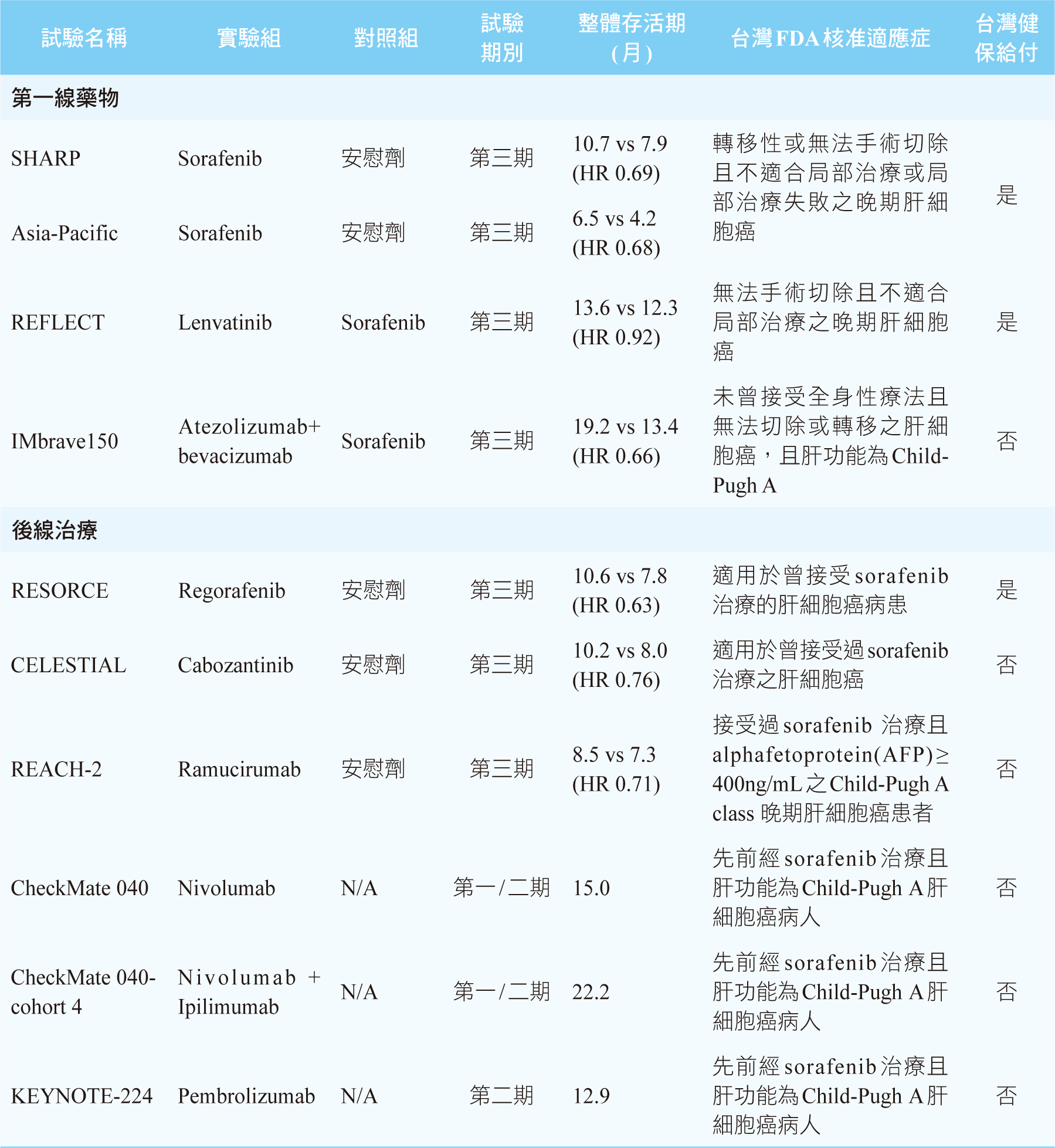
Sorafenib是第一個被核准用於治療晚期HCC的藥物,它是一個口服的小分子標靶藥物,其機轉為多重酪胺酸激酶抑制劑 (multi-tyrosine kinase inhibitor),主要是阻斷血管內皮生長因子受體 (vascular endothelial growth factor receptor,VEGFR) 的路徑。根據一項第三期隨機雙盲SHARP臨床試驗結果顯示,相較於安慰組,sorafenib可明顯延長患者的整體存活期 (overall survival,OS),安慰組為7.9個月,sorafenib延長至10.7個月(HR 0.69, p<0.001)2。此外亞太地區患者使用sorafenib的療效也由第三期隨機雙盲Asia-Pacific臨床試驗中得到驗證3。常見的副作用有高血壓、手足皮膚反應 (hand-foot skin reaction)、腹瀉及疲倦。長久以來,sorafenib是晚期HCC的標準第一線治療藥物,每日建議劑量為800 mg,分兩次空腹服用。健保有給付。
二、Lenvatinib
Lenvatinib的作用機轉同sorafenib。根據一項多中心、隨機、非劣效性 (nonferiority) 之第三期REFLECT臨床試驗結果顯示,lenvatinib與sorafenib兩者OS無明顯差別 (lenvatinib 13.6個月 vs. sorafenib 12.3個月, HR 0.92, p>0.05),而lenvatinib的無惡化存活期 (progression-free survival,PFS)為7.4個月,顯著高於sorafenib的3.7個月 (HR 0.66, p<0.001)4。Lenvatinib常見的副作用同sorafenib,但lenvatinib引起高血壓的比例為42%,高於sorafenib的30%,而lenvatinib發生手足皮膚反應的比例為27%,明顯低於sorafenib的52%4。此藥的建議劑量為體重≥ 60kg的病人每日口服12 mg,體重< 60 kg的病人每日口服8 mg。健保有給付。
三、Atezolizumab併用bevacizumab
近年來,癌症免疫治療快速進展,其中已有多個免疫檢查點抑制劑 (immune checkpoint inhibitors,ICIs) 上市,例如:ipilimumab、nivolumab、pembrolizumab、atezolizumab。其中ipilimumab是第四類細胞毒殺T細胞抗原 (cytotoxic T lymphocyte antigen 4,CTLA-4) 抑制劑,而pembrolizumab和nivolumab是第一類程序性細胞死亡蛋白質 (programmed cell death protein 1,PD-1) 抑制劑,atezolizumab則是第一類程序性細胞死亡配體 (programmed cell death ligand 1,PD-L1) 抑制劑。ICIs可喚醒和加強自身的免疫系統去對抗癌症。
一項多中心、開放性之第三期IMbrave150臨床試驗結果顯示,相較於sorafenib,使用atezolizumab併用可抑制VEGF的單株抗體bevacizumab可明顯延長OS和PFS (OS 19.2個月vs. 13.4個月, HR 0.66, p=0.0009;PFS 6.8個月vs. 4.3個月, HR 0.59, p<0.0001)5-6。在副作用方面,atezolizumab合併bevacizumab組引起高血壓、肝指數上升、血小板數目降低及蛋白尿的發生率皆比sorafenib組高5。Atezolizumab劑量為1200 mg,併用bevacizumab 15 mg/kg,每3週一次。此突破性創新療法,獲得美國FDA於2020年5月核准用於治療先前未接受過全身性治療且無法切除或轉移的HCC患者,台灣FDA也於2020年8月核准此適應症。健保尚未給付。目前,atezolizumab併用bevacizumab已成為晚期HCC的標準第一線治療藥物。表一是目前核准用於治療晚期HCC藥物之臨床試驗的總整理。
表一 核准用於治療晚期肝細胞癌藥物之臨床試驗
參、後線藥物
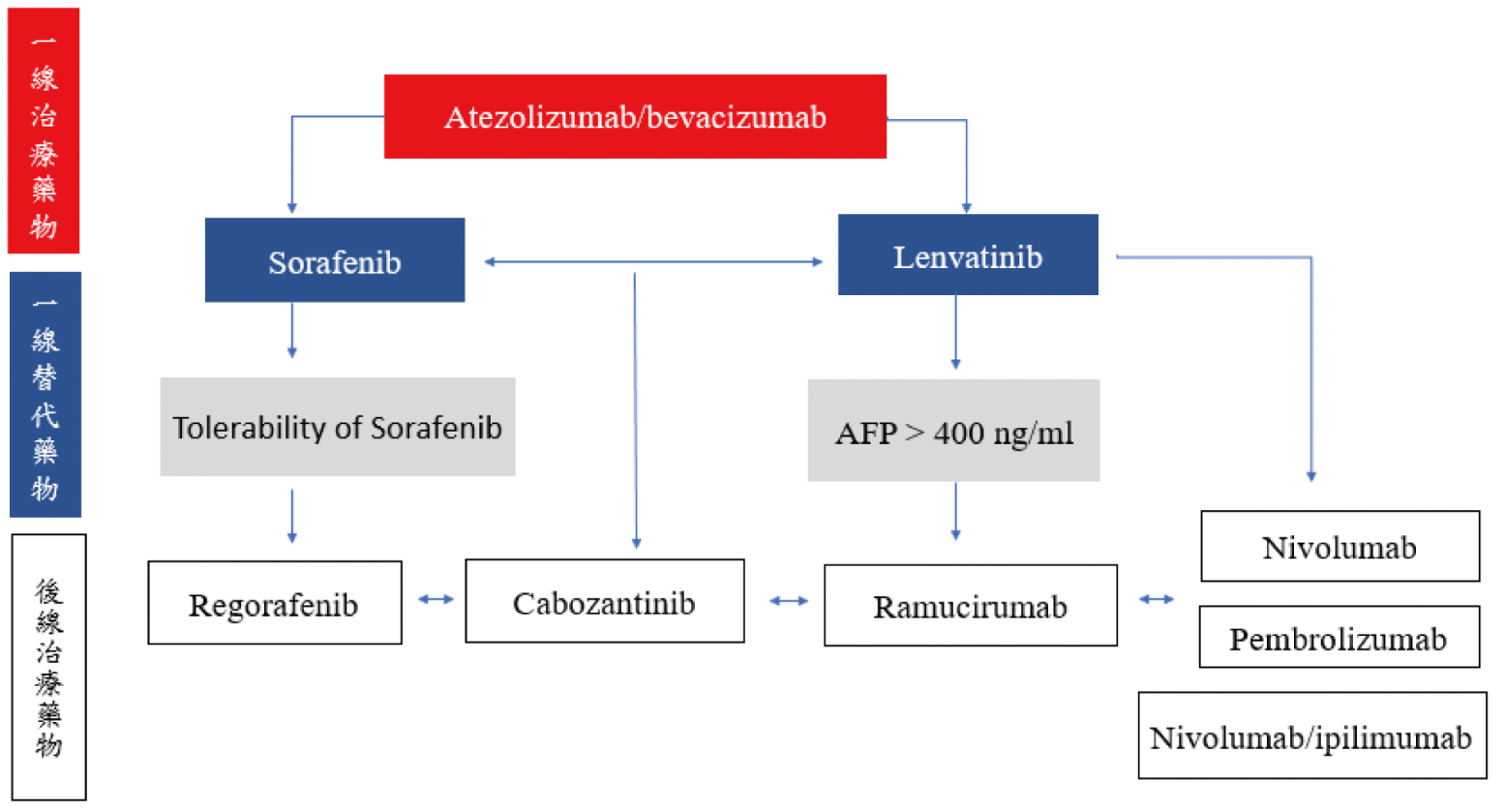
晚期HCC患者在sorafenib治療失敗後之後線治療藥物有抑制血管新生的小分子標靶藥物regorafenib、cabozantinib和大分子單株抗體ramucirumab,以及ICIs藥物nivolumab、pembrolizumab、ipilimumab併用nivolumab。晚期HCC藥物治療流程見圖一。
圖一 晚期肝細胞癌藥物治療流程
一、Regorafenib
Regorafenib是sorafenib的衍生物。根據一項多中心、隨機分配、雙盲之第三期RESORCE臨床試驗結果顯示,在sorafenib治療失敗後,相較於安慰組,regorafenib可明顯延長OS,從7.8個月延長至10.6個月 (HR 0.63, p < 0.0001)7。常見副作用同sorafenib。Regorafenib劑量為每天口服一次160 mg,每28天為一週期,每週期只有前21天服藥。健保給付。
二、Cabozantinib
Cabozantinib也是多重酪胺酸激酶抑制劑。根據一項多中心、隨機分配、雙盲之第三期CELESTIAL臨床試驗結果顯示,後線治療使用cabozantinib的OS是10.2個月,而安慰組為8個月 (HR 0.76, p = 0.0049)8。常見副作用有手足皮膚反應、高血壓、肝指數上升、疲勞和腹瀉。建議劑量為60 mg。健保尚未給付。
三、Ramucirumab
不同於bevacizumab是拮抗VEGF,ramucirumab則是VEGFR 2拮抗劑,其核准適應症為曾接受過sorafenib且血中甲型胎兒蛋白(α-fetoprotein,AFP) ≥400 ng/mL之病人。根據一項隨機、雙盲之第三期REACH-2臨床試驗結果顯示,ramucirumab的OS為8.5個月,而安慰組為7.3個月 (HR 0.71, p=0.019)9。常見副作用為高血壓、低鈉血症和肝指數上升。建議劑量為8 mg/kg,每兩週靜脈輸注一次。健保尚未給付。
四、Nivolumab
Nivolumab是PD-1抑制劑。根據一項第一期/二期CheckMate040臨床試驗結果顯示,對於先前經sorafenib治療失敗的HCC病人給予nivolumab,其客觀反應率 (objective response rate,ORR) 為14%,且有效反應持續時間超過17個月,OS為15個月10。建議劑量為3 mg/kg,每2週一次。健保尚未給付。
五、Pembrolizumab
Pembrolizumab也是PD-1抑制劑。根據一項第二期KEYNOTE-224臨床試驗結果顯示,對於先前經sorafenib治療失敗的HCC病人給予pembrolizumab,其ORR為17%,且有效反應持續時間超過12個月,OS為12.9個月11。劑量為200mg,每3週一次。健保尚未給付。
六、Ipilimumab併用nivolumab
根據CheckMate 040之延伸試驗結果顯示,對於先前曾接受過sorafenib治療的患者給予CTLA-4抑制劑 ipilimumab併用PD-1抑制劑nivolumab,其ORR為31%,且有效反應持續時間超過17個月,OS為22.2個月12。合併使用兩種不同機轉的ICIs會增加副作用發生,此試驗有70% 的病人需要接受全身性類固醇來治療免疫相關不良事件,常見的副作用有皮疹(35%)、甲狀腺功能低下或甲狀腺炎(22%)、腎上線功能不全(18%)、潰瘍性結腸炎(10%)及肺炎(10%)等。用法為nivolumab 1 mg/kg併用ipilimumab 3 mg/kg,每3週一次,共4次;之後每2週一次使用nivolumab 240mg作為維持治療,一直使用到疾病惡化或出現不可耐受的毒性為止。健保尚未給付。
肆、未來展望
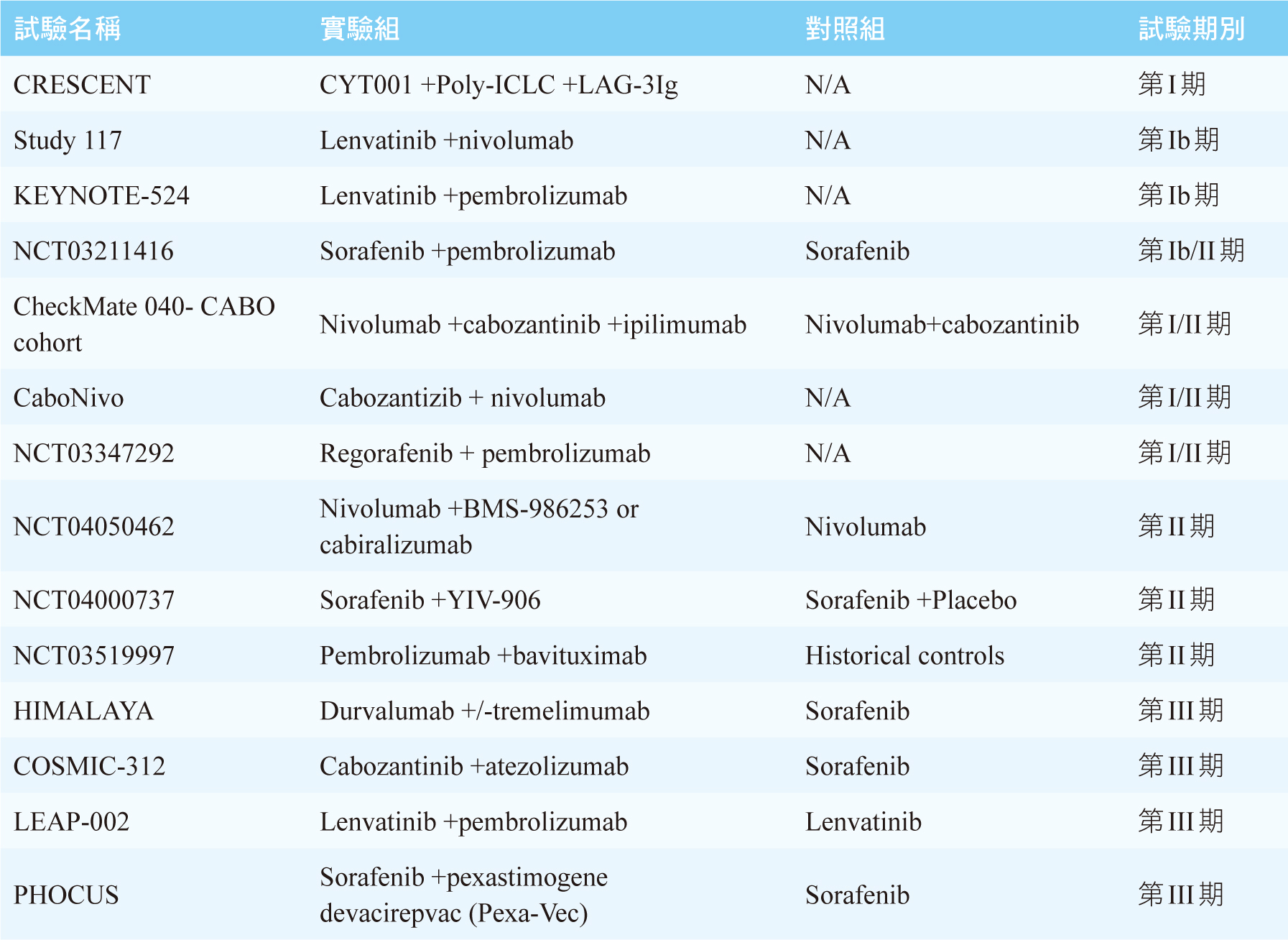
針對晚期HCC有許多臨床試驗正在進行中,見表二13。主要方向為標靶藥物合併ICIs,或是合併兩種不同機轉的ICIs,是否能帶來更好的療效及可接受的安全性,我們需要待其結果才能知曉。
表二 進行中的晚期肝細胞癌藥物治療臨床試驗
伍、結論
十年以來,sorafenib一直是晚期HCC的第一線標準用藥;然而,近年來,由於ICIs的介入,目前atezolizumab併用bevacizumab已成為晚期HCC新的標準第一線用藥。合併不同機轉的ICIs或是標靶藥物併用ICIs是治療晚期HCC的未來趨勢。
Drug Therapy for Advanced Hepatocellular Carcinoma
Hui-Hsin Yang1,
Chi-Yuan Cheng2, Tun-Liang Chen2
1Department of Pharmacy, Chang Gung
Memorial Hospital, Taoyuan
2Department of Pharmacy, Chang Gung
Memorial Hospital, Linkou
Abstract
According to statistics from the Ministry of Health and Welfare, liver cancer is the second leading cause of cancer death during nearly forty years in Taiwan. Hepatocellular carcinoma (HCC) is the most common form of liver cancer and accounts for 90% of cases. The majority of HCC occur in patients with underlying liver disease, mostly as a result of hepatitis B or C virus infection or alcohol abuse. Many patients are at an advanced stage when they are diagnosed. Sorafenib has been the standard drug for the treatment of advanced HCC for decades. A recent third phase IMbrave150 trial, showed that the combination of immune checkpoint inhibitor, atezolizumab, and bevacizumab increases overall survival compared with sorafenib therapy, and this combination has been commonly used clinically in the first-line treatment of advanced HCC. While lenvatinib is the first-line treatment as well. Six systemic therapies have been approved for second-line treatment of advanced HCC, including a small molecular multi-targeted kinase inhibitors regorafenib, cabozantinib and monoclonal antibody ramucirumab, and immune checkpoint inhibitors nivolumab, pembrolizumab, ipilimumab combined with nivolumab. The future treatment direction is (1) the combination of targeted drugs with ICIs, or (2) the combination of two ICIs targeting difference mechanisms.
參考資料:
1. 行政院衛生福利部: 109年度死因統計。臺北:衛生福利部2020。
2. Llovet JM, Ricci S, Mazzaferro V, et al: Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359:378-90.
3. Cheng AL, Kang YK, Chen Z, et al: Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol. 2009;10:25-34.
4. Kudo, M. et al: Lenvatinib versus sorafenib in first- line treatment of patients with unresectable hepatocellular carcinoma:a randomised phase 3 non- inferiority trial. Lancet.2018;391:1163–73.
5. Finn R. S. et al: IMbrave150:Updated overall survival (OS) data from a global, randomized, open-label phase III study of atezolizumab (atezo) + bevacizumab(bev) versus sorafenib(sor) in patients (pts) with unresectable hepatocellular carcinoma (HCC). J. Clin.Oncol.2021;39:267.
6. Finn, R. S. et al: Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. N. Engl.J. Med.2020;382:1894–1905.
7. Bruix, J. et al: Regorafenib for patients with hepatocellular carcinoma who progressed on Sorafenib treatment (RESORCE): a randomised, double- blind,placebo- controlled, phase 3 trial. Lancet.2017 Jan 7;389:56–66.
8. Abou- Alfa, G. K. et al: Cabozantinib in patients with advanced and progressing hepatocellular carcinoma. N. Engl. J. Med.2018;379:54–63.
9. Zhu, A. X. et al: Ramucirumab after sorafenib in patients with advanced hepatocellular carcinoma and increased α- fetoprotein concentrations (REACH-2):a randomised, double- blind, placebo- controlled,phase 3 trial. Lancet On col.2019;20:282–96.
10. El- Khoueiry, A. B. et al: Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040):an open- label, non- comparative, phase 1/2 dose escalation and expansion trial. Lancet.2017;389:2492–2502.
11. Zhu, A. X. et al: Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib (KEYNOTE-224): a non- randomised,open- label phase 2 trial. Lancet Oncol.2018;19:940–52.
12. Yau,T.et al: Efficacy and safety of nivolumab plus ipilimumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib: the CheckMate 040 randomized clinical trial. JAMA Oncol.2020;6(11):e204564.
13. Aitcheson, G.et al: Recent Advances in Systemic Therapies for Advanced Hepatocellular Carcinoma. Curr Hepatology Rep. 2021; 20: 23–33.
通訊作者:楊慧心/通訊地址:桃園市龜山區頂湖路123號桃園長庚醫院西藥局
服務單位:桃園長庚紀念醫院藥劑部/聯絡電話:(O) 03-3196200 ext 2022