Methylphenidate藥動學特徵
與耐受性介紹
鄭淑文
衛生福利部桃園療養院藥劑科
摘要
注意力不足過動症(attention deficit hyperactive disorder, ADHD)是學齡期兒童期常見的神經行為發展障礙,主要的核心症狀為缺乏注意力、過動和行為衝動。ADHD 的病因可能是和大腦前額葉皮質的神經傳導物質多巴胺及正腎上腺素含量異常有關,目前臨床上所使用的第一線治療藥物為中樞神經興奮劑 methylphenidate(MPH),能增加突觸間的多巴胺及正腎上腺素濃度,使訊息傳遞可以正常進行而改善 ADHD 症狀。由於 MPH 的半衰期短,因此劑型上主要可分為作用時間短的速效型(immediate release, IR)與作用時間長的持續釋放劑型(extended release, ER)。目前市面上的各種長效劑型是結合不同比例的 MPH-IR 和 MPH-ER 而設計成不同的緩釋技術,以達到延長藥物作用時間的效果。不同的劑型也會呈現出不同藥物動力學特徵,這反應在 MPH 血中濃度與時間關係曲線上的差異。過去已有多項研究表明,一天服用一次長效劑型的 MPH-ER 與一天服用二次短效劑型的 MPH-IR,雖然二者達到相近的最大血中藥物濃度,但 MPH-ER 的釋放速率緩慢,導致服藥後的前數個小時療效不及藥物釋放迅速的 MPH-IR。評估藥物動力學特性與臨床治療成效的研究也顯示,藥物血中濃度的波動會影響 MPH 之耐受性。
關鍵字: methylphenidate、注意力不足過動症、劑型設計、藥物動力學、耐受性
壹、 前言
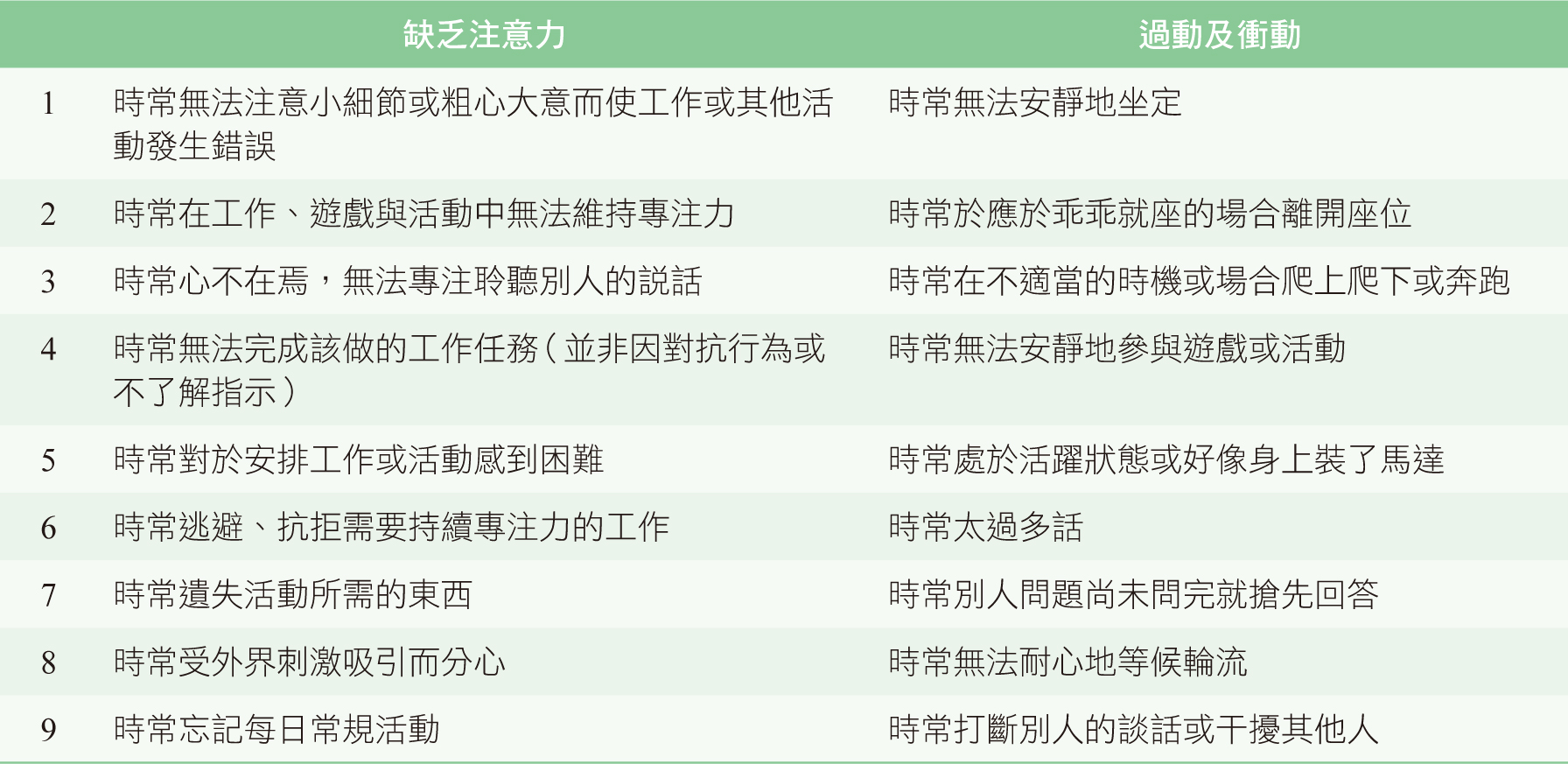
注意力不足過動症(attention deficit hyperactive disorder, ADHD)是學齡期兒童常見的神經行為發展障礙,主要核心症狀為缺乏注意力、過動以及衝動,其病因涉及大腦前額葉皮質的多巴胺及正腎上腺素傳導異常。根據美國精神醫學會出版的精神疾病診斷與統計手冊第五版(The Diagnostic and Statistical Manual of Mental Disorders, DSM-5),ADHD 的診斷準則如下:兒童在 12 歲以前已存在至少 6 項症狀、持續時間超過 6 個月並且症狀在 2 種以上的場合出現;17 歲以上的成人則符合至少 5 項症狀即可達診斷標準(表一)1。
表一 DSM-5 注意力不足過動症診斷標準1
ADHD 在世界各國的盛行率均相當高,2018 年加拿大的研究報告指出,全球兒童與青少年的 ADHD 盛行率大約是 5- 9%,成人則介於 3- 5%,超過半數病人的症狀會從兒童時期持續至成人時期2。此外,未被妥善治療的 ADHD 病患容易導致嚴重的不良後果,包括社交和學習上的困難、意外傷害或濫用藥物、以及犯罪等行為問題,使得病人在經濟、社會和情感各方面都可能遭遇困境,其家人和社區也會受到影響。
藥物治療是處置與照護 ADHD 病人不可或缺的一環,穩定服藥更是有效治療的關鍵。臨床上第一線治療藥物為中樞神經興奮劑 methylphenidate(MPH),主要可分為短效的快速釋放(immediate release, IR)與長效的持續釋放(extended release, ER)劑型。短效型 MPH-IR 可迅速釋放藥物,但作用時間較短,每日須服用 2-3 次方可維持治療效果;長效型 MPH-ER 則每日只須服用 1 次,服藥頻率的減少雖可提高用藥方便性及順從性,但需較長時間才能達到治療效果所需的藥物血中濃度。另一方面,持續釋放劑型雖能維持恆定的 MPH 濃度,然而並無法提供與短效型藥物重複服用相同的療效,且可能產生藥物耐受性,特別是在服藥後的最初幾個小時,推測是與不同劑型的藥物動力學(pharmacokinetic, PK)特性有關。英國國家健康與照顧卓越研究院(The National Institute for Health and Care Excellence, NICE)的 ADHD 診斷及照護指引亦指出,醫療人員應注意不同劑型的藥物動力學特徵3。
貳、 作用機轉與藥物動力學
MPH,又稱dl-MPH(dl-threo-methylphenidate),在化學結構上含有 d-threo-methylphenidate(d-MPH)及 l-threo-methylphenidate(l-MPH)二種鏡像異構物(enantiomer),然而只有d-MPH 在治療上具藥理活性4。儘管 MPH 用於治療 ADHD 的作用機轉目前仍未完全了解,但研究結果發現,MPH 可佔據大腦紋狀體(striatum)中的突觸前多巴胺轉運蛋白(dopamine transporter, DAT),從而阻斷多巴胺(dopamine)及正腎上腺素(norepinephrine)的再吸收,增加神經細胞外多巴胺及正腎上腺素的濃度,以改善ADHD的症狀5-7。
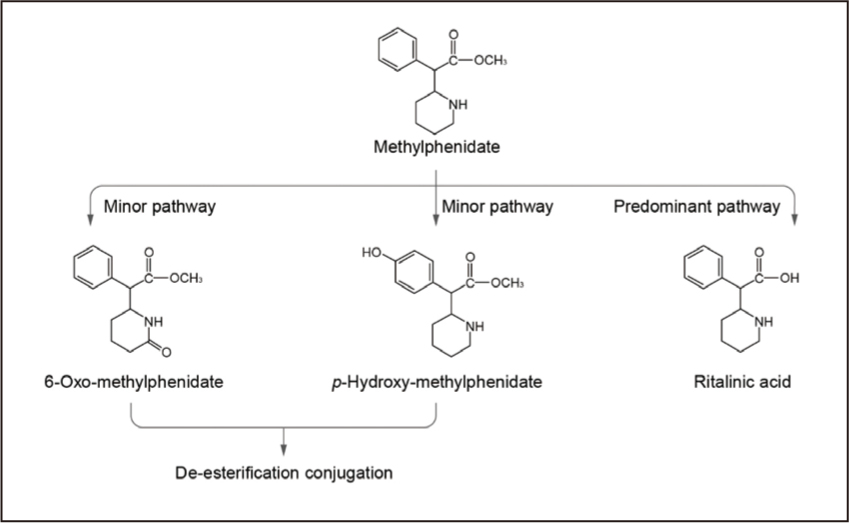
MPH經腸胃道吸收良好,食物對其吸收並無顯著影響。兒童口服MPH後達到最大血漿濃度 (Tmax)的時間約在1-3小時之間,藥物半衰期(t1/2)為2-3小時,作用時間可維持約 4 小時。 MPH與血漿蛋白的結合率很低(15.2±5.2%),並具有高親脂性,因此很容易傳遞到大腦內。去酯化反應(de-esterification)是 MPH 的代謝途徑(圖一),主要代謝產物為 ritalinic acid,只有少量的 MPH(<2%)產生氫氧化代謝物,但所有 MPH 代謝物皆不具藥理活性。根據尿液排出及糞便清除模式,口服含有14C放射性的 MPH 後,在8和48小時內分別累計有50%和90%的放射劑量由尿液排出,而在24和48小時分別累計有1.5%和3.3%的放射劑量由糞便排出6。
圖一 MPH 的代謝途徑6
參、 劑型設計及藥動學臨床研究
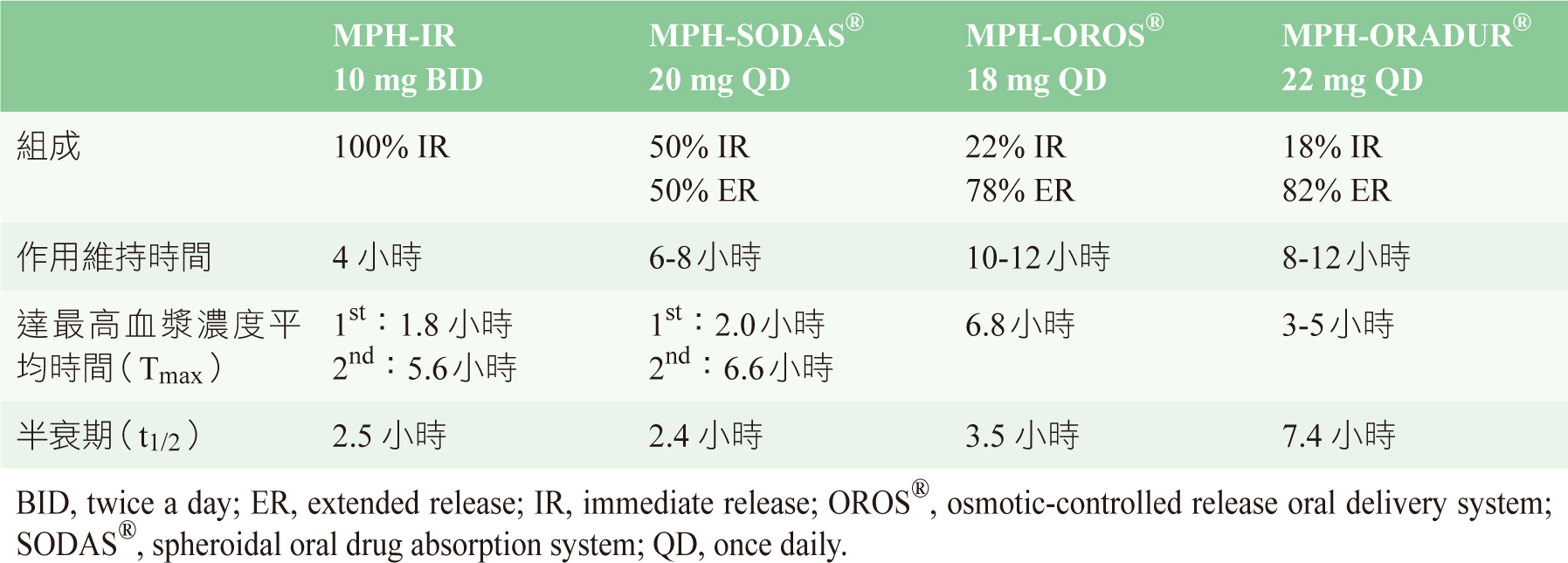
MPH 半衰期短是造成使用不便與臨床治療難處的原因之一。目前已有合併短效和長效 MPH 之劑型,設計成兼具快速產生藥效及作用時間延長的特點,其中的 IR 組成可快速溶解而迅速發揮作用,ER 組成使得藥物濃度在中午時段降低,給藥後 6-8 小時出現第二次藥物濃度波峰,此後逐漸下降。台灣衛生福利部目前核准的短效型有 MPH-IR;控釋劑型產品有 MPH-OROS®、MPH-SODAS® 及 MPH-ORADUR®,三者的藥物釋放系統、藥物釋放模式及作用時間之比較如表二所示8-12,其中 ORADUR® 透過創新的配方工程設計出特殊的藥物釋放動力學特性,具有作用快速且能持續長時間的雙重優點。
表二 短效與持續釋放劑型之 MPH 產品之比較8-12
根據研究,MPH 需阻斷 50% 的 DAT 方可表現出臨床療效,相當於血中濃度須達 6 ng/ml7。服用 MPH-OROS® 欲於 2 小時後達到 6 ng/mL 的血中濃度,所需劑量至少 54 mg13,然而病患並非整天都需要如此高的劑量,顯示在一般治療劑量下常有前段藥效不足的問題。MPH-SODAS® 雖成功克服前段藥物濃度不足的問題,但是效果只能維持 6-8 小時,因此造成後續的藥物濃度不足,而使病患難以持續保持專心14。MPH-ORADUR® 是最新核准的控釋劑型,研究指出,服用 44 mg MPH-ORADUR® 可在 2 小時內血中濃度達 6 ng/ml,在約 3-6 小時血中濃度達 8-10 ng/ml,也就是可最大程度的阻斷 80% DAT 4,12,且效果能持續作用 8-12 小時,此種藥動學特性在臨床上應較能符合病患的需求。另有研究探討靜脈注射劑型 MPH 的藥動學,發現可快速進入大腦內(Tmax < 10 分鐘),清除速度相對來說則較為緩慢(T1/2 = 90 分鐘)4。
肆、 MPH 血中濃度波動對藥物耐受性的影響
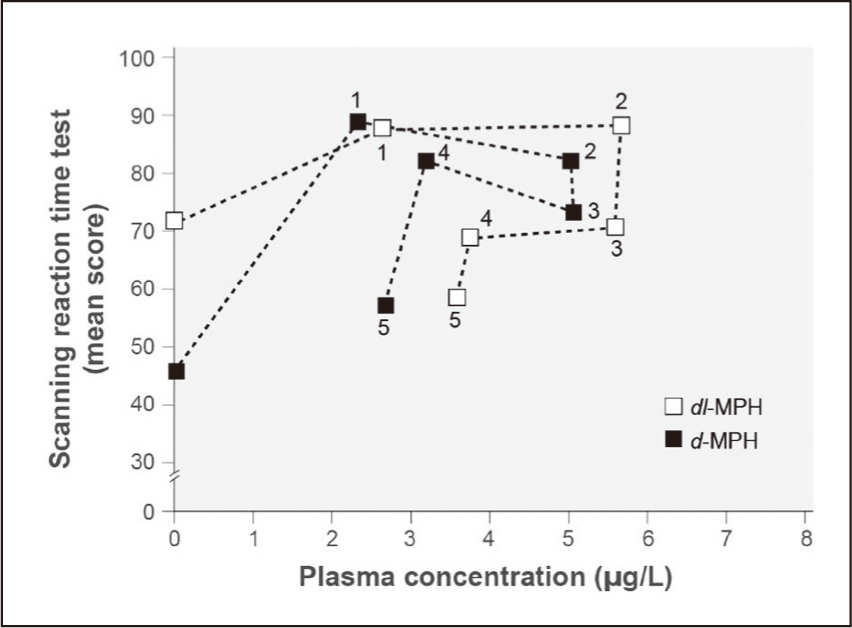
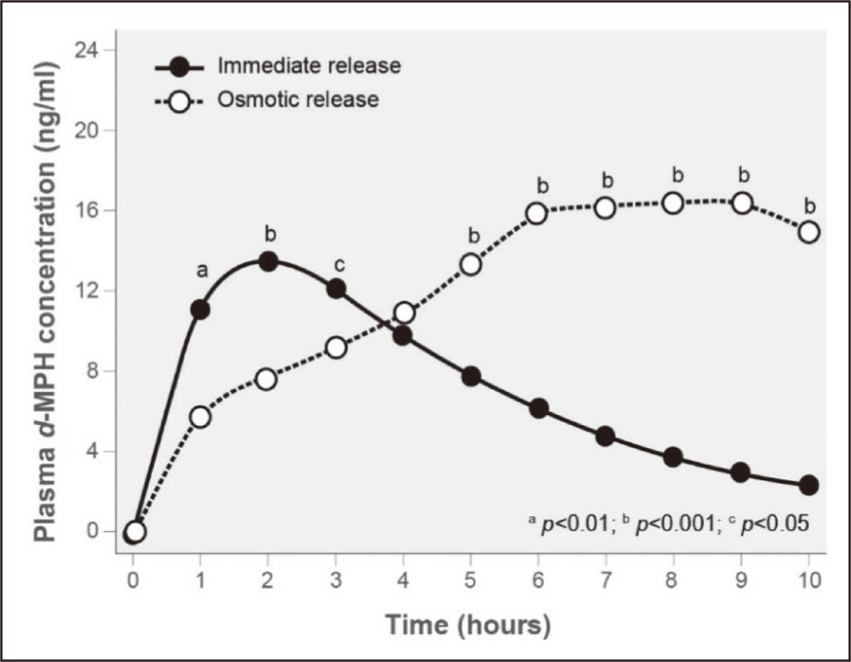
不同劑型除了造成藥動學特性的差異外,亦會影響藥物耐受性。急性耐受性(acute tolerance)的定義為在藥物血漿濃度(drug-plasma levels)仍高的情況下,藥效在數分鐘到數小時內降低。一項針對 ADHD 患童學習任務的研究,在單劑量給藥 1-2 小時內出現最佳表現,這與口服 MPH 後達最大血中濃度的時間點類似,顯示 MPH 的藥效能在短時間發揮作用6。另一項研究則是採用掃描反應時間測試(scanning reaction time test),每小時分析兒童平均分數與 d-MPH 及 dl-MPH 血中濃度之間的關係(圖二),平均分數在給藥後 1-2 小時內最高,而在給藥第 5小時,平均分數已下降至與使用安慰劑或 l-MPH 相同的水平,然而d-MPH 血中濃度與給藥 1 小時的濃度並無顯著差異,顯示 ADHD 病童對 MPH 已產生急性耐受性6。一項交叉試驗中比較快速釋放與持續釋放(sustained release, SR)劑型的療效,研究人員根據曲線下面積(area under the curve, AUC)的測定,確認每日二次 MPH-IR 10 mg 與每日一次 MPH-SR 20 mg 之吸收程度無顯著差異,然而從觀察 ADHD 患者的多種破壞性行為評量中,發現 MPH-IR 的評分結果優於 MPH-SR6,意味著 ADHD 病童對快速釋放的劑型較不易產生耐受性。
圖二 掃描反應時間測試(平均分數)與MPH血中濃度關係6
有研究進一步探討 MPH 藥物遞送特性所產生的影響,研究人員模擬每日二次(7:00 am 和 12:00 pm)標準臨床劑量的藥動學性質,將受測者分為二組,一組在早晨先給予 80% 的臨床劑量,接著每 30 分鐘服用少量但均等的劑量,產生與 MPH-SR 類似的概況(平穩組),另一組每 30 分鐘給予少量但逐次增加的劑量,達到最大血中濃度(上升組)。二組與標準的每日二次的給藥方式相比較,發現上升組可發揮完整的臨床藥效,而平穩組只達到 60%,顯示 MPH 出現耐受性(tolerance)4。 2012 年一份研究報告亦指出,MPH 脈動式投藥(pulsatile delivery)對大部分 ADHD 患童的三項核心症狀,也就是缺乏注意力、過動和衝動,可達最佳的緩解效果,並且早晨給予適當的大劑量能夠在1小時內顯著減少缺乏注意力和過動的情況,至於衝動部分,MPH-IR 的效果優於 MPH-ER15。
分析 MPH 的藥動學特性與腦部活動之間的關係,進一步解釋了 MPH 的耐受性。MPH 會阻斷大腦紋狀體突觸前的 DAT,產生欣快作用(euphoriant effect),而研究結果指出藥物釋放的速率會影響欣快作用的發生。一項試驗納入 12 名成人隨機分為二組,分別給予快速釋放和滲透泵型控釋劑型 ( OROS ) 的 MPH,二種劑型達到最大血中濃度(Cmax)相似,但是快速釋放劑型達到 Tmax 比滲透泵型控釋劑型快 3.5 倍(圖三),最大的 DAT 阻斷程度相似,但快速釋放劑型較早達到峰值(圖四)。該研究結果顯示,快速釋放劑型產生的欣快感強於控釋劑型,這是因為 MPH 迅速阻斷 DAT 所致,而無關Cmax 或DAT阻斷程度5。根據上述之各項研究證據可知,MPH 血中濃度的波動足以影響藥物耐受性。因此,比較 MPH-ORADUR (44 mg) 與 MPH-OROS ( 36 mg) 的血中濃度變化曲線 ( 圖五 )8,12,可推測 MPH-ORADUR 較不易出現耐受性的情況。
圖三 快速釋放(IR)和滲透泵型控釋劑型(OROS)的最大血中濃度曲線5
圖四 多巴胺轉運蛋白(DAT)阻斷百分比曲線5
圖五 MPH-ORADUR® 44 mg 相較 MPH-OROS® 36 mg 之藥物動力學曲線8,12
伍、 安全性
目前國內外在臨床上使用的 MPH 包含數種不同的劑型,值得注意的是,台灣為 MPH-ORADUR®在全球第一個上市的國家。MPH-ORADUR®的第一期臨床試驗(PK NDA-T375-1206 和 PK NDA-T375-1502)結果顯示,單次劑量服用 22-44 mg MPH-ORADUR® 均未觀察到顯著的安全性問題,接著在第三期臨床試驗(OP-2PN012-301)觀察到 MPH-ORADUR® 最常見的副作用為:食慾減低(48.2%)、睡眠問題(20.0%)、噁心(13.6%)、頭痛(8.2%)及頭暈(6.4%)7。整體而言,根據 MPH-ORADUR® 與 MPH-OROS®、MPH-IR 各自的臨床試驗結果,可觀察到 MPH-ORADUR® 的安全性與其他兩種劑型大致相似,但在胃痛、失眠、頭痛、焦慮情緒、抽搐(tics)的發生率較低7。
陸、 結論
臨床上用於 ADHD 患童的治療藥物以 MPH 為主,目前已發展出多種劑型以滿足病患的需求。這些劑型結合不同比例的 MPH-IR 與 MPH-ER,採用不同的藥物釋放技術,進而呈現出不同的藥動學特性。然而,根據過去的研究結果顯示,在服用相同劑量的條件下,釋放速率快速的 MPH-IR 達到 Tmax 的時間較控釋劑型 MPH-ER 來的短,二者雖然達到相同的 Cmax,但 MPH-ER 發揮的治療效果卻不如 MPH-IR,尤其是在服藥後的最初數個小時,顯示出藥物血中濃度的波動會影響 MPH 之耐受性。值得注意的是,新劑型 MPH-ORADUR® 不僅可達到較長的作用時間,亦可避免藥物耐受性的發生。因此,基於血中 MPH 濃度的變化與耐受性的關係,臨床醫藥人員應重視不同劑型的藥動學特性。
Pharmacokinetics of and Tolerance to Methylphenidate
Shu-Wen Cheng
Department of Pharmacy, Taoyuan Psychiatric
Center, Ministry of Health and Welfare
Abstract
Attention deficit hyperactivity disorder (ADHD) is a common neurodevelopmental disorder in school-aged children and is characterized by inattention, hyperactivity, and impulsivity. Causes of ADHD are possibly related to abnormal levels of neurotransmitters, dopamine and norepinephrine, in the prefrontal cortex of the brain. The first-line treatment for ADHD in clinical practice is methylphenidate (MPH), which can increase the concentration of dopamine and norepinephrine in the synaptic cleft so as to ensure normal signaling and in turn improve the symptoms of ADHD. Because of its short half-life, MPH has two formulations: short-acting immediate-release (IR) (MPH-IR) and long-acting extended-release (ER) (MPH-ER) formulation. The various types of commercially available ER formulations adopt different release mechanisms that are designed by combining different ratios of MPH-IR and MPH-ER to achieve prolonged mechanism of action. Different dosage forms also exhibit distinct pharmacokinetics, which is reflected by the difference in the relationship between plasma MPH concentration and time. Multiple studies indicated that although once-daily MPH-ER and twice-daily MPH-IR achieved similar maximum plasma concentrations, the MPH-ER was released slowly, resulting in an inferior efficacy in the first few hours of administration compared with that of MPH-IR. Pharmacokinetics and clinical effectiveness studies also showed that changes in plasma concentration affected tolerance to MPH.
參考資料:
1. Diagnostic and Statistical Manual of Mental Disorders (DSM-5®), Fifth Edition: American Psychiatric Association; 2013.
2. Canadian ADHD Resource Alliance (CADDRA): Canadian ADHD Practice Guidelines, Fourth Edition: Toronto ON, CADDRA. 2018.
3. NICE guideline. Attention deficit hyperactivity disorder: diagnosis and management. London; 2018.
4. Swanson JM, Volkow ND. Pharmacokinetic and pharmacodynamic properties of stimulants: implications for the design of new treatments for ADHD. Behav Brain Res 2002; 130: 73-8.
5. Spencer TJ, Biederman J, Ciccone PE, et al. PET study examining pharmacokinetics, detection and likeability, and dopamine transporter receptor occupancy of short- and long-acting oral methylphenidate. Am J Psychiatry 2006; 163: 387-95.
6. Kimko HC, Cross JT, Abernethy DR. Pharmacokinetics and clinical effectiveness of methylphenidate. Clin Pharmacokinet 1999; 37: 457-70.
7. Huang YS, Yeh CB, Chen CH, Shang CY, Gau SS. A Randomized, Double-Blind, Placebo-Controlled, Two-Way Crossover Clinical Trial of ORADUR-Methylphenidate for Treating Children and Adolescents with Attention-Deficit/Hyperactivity Disorder. J Child Adolesc Psychopharmacol 2021; 31: 164-78.
8. Methydur® 思有得仿單 (仿單版本 400412 001).
9. Concerta® 專思達仿單 (仿單版本 USPI Jan2017_ v1702).
10. Ritalin LA® 利長能仿單 (仿單版本 TWI-240620).
11. Maldonado R. Comparison of the pharmacokinetics and clinical efficacy of new extended-release formulations of methylphenidate. Expert Opin Drug Metab Toxicol 2013; 9: 1001-14.
12. Orient Pharma. Clinical Study Report (Protocol No. PK NDA-T375-1206).
13. Pentikis H, González MA. Effect of formulation on methylphenidate release patterns. Am J Drug Deliv 2005; 3: 8.
14. Markowitz JS, Straughn AB, Patrick KS, et al. Pharmacokinetics of methylphenidate after oral administration of two modified-release formulations in healthy adults. Clin Pharmacokinet 2003; 42: 393-401.
15. Gunther T, Kahraman-Lanzerath B, Knospe EL, Herpertz-Dahlmann B, Konrad K. Modulation of attention-deficit/hyperactivity disorder symptoms by short- and long-acting methylphenidate over the course of a day. J Child Adolesc Psychopharmacol 2012; 22: 131-8.
通訊作者:鄭淑文/通訊地址:桃園市桃園區龍壽街71號
服務單位:衛生福利部桃園療養院藥劑科/聯絡電話:(O) 03-3698553 ext 2500