去勢抗性轉移性前列腺癌藥物治療
吳育耘、鄭雅庭、黃微瑄、張秀美、吳秋玫
高雄市立大同醫院(委託財團法人私立高雄醫學大學經營)藥學科
摘要
台灣前列腺癌發生率近年迅速攀升,已成為男性最常見的癌症之一,因早期不易發現,症狀出現時多有局部侵犯或轉移現象,轉移性前列腺癌初始常以去勢療法治療,一段時間後一旦腫瘤對去勢療法失去反應,則只能施予傳統化學治療。近年來去勢抗性轉移性前列腺癌陸續有新藥核准上市,新版治療指引收錄多項治療策略,包含新一代雄性素合成抑制劑、雄性素受體抑制劑與新型紫杉醇類化學治療,並納入癌症疫苗- sipuleucel-T,此為第一個FDA核准之治療型疫苗,以及PD-1免疫檢查點抑制劑(如:pembrolizumab)、新機轉口服標靶藥物PARP抑制劑(如:olaparib)等,臨床研究結果皆顯示新藥能有效延長存活期,在精準醫療如火如荼發展之下,為去勢抗性轉移性前列腺癌治療點燃新曙光。
關鍵字: 去勢抗性轉移性前列腺癌、sipuleucel-T、PD-1免疫檢查點抑制劑、PARP抑制劑
壹、前言
根據全球癌症資料庫GLOBOCAN 2020的數據,前列腺癌是全球男性第二大常見的癌症1。在台灣,前列腺癌近幾年發生率快速上升,至2020年已躍升至癌症死亡率的第五名2。前列腺癌好發於50歲以上男性,腫瘤生長速度緩慢,早期通常沒有明顯特異性症狀,容易被視為良性攝護腺肥大而忽略,當腫瘤逐漸變大,出現症狀如尿液滯留、血尿和下肢水腫等,透過肛門指檢、影像學檢查與血液檢查值如前列腺特異抗原(prostate specific antigen, PSA)異常上升等檢測確診後,病人通常已進入局部侵犯或轉移階段。
轉移性前列腺癌(metastatic prostate cancer)是指前列腺癌細胞轉移到淋巴結、骨頭和其他器官(最常見為肝和肺),其治療方向主要是藉由藥物來阻斷雄性素的合成,達到遏止癌細胞的生長和分化,此治療方法為荷爾蒙療法,也稱為雄性素剝奪療法或去勢療法(androgen deprivation therapy, ADT),常用的ADT治療藥物包括促黃體素釋放荷爾蒙致效劑(luteinising-hormone releasing hormone agonist, LHRH agonist)如goserelin、Leuprorelin 和促性腺激素釋放荷爾蒙拮抗劑(gonadotropin-releasing hormone antagonist, GnRH antagonist)如degarelix以及雄性激素受體拮抗劑(androgen receptor antagonist)如cyproterone、bicalutamide、flutamide等。雖然大多數的轉移性前列腺癌病人初期對ADT有很好反應,血清中PSA指數都能降至<2ng/ml,但不幸的是,在治療約14-30個月後,隨著腫瘤細胞型態的轉變使得細胞對殘存腎上腺雄性激素受體敏感度增加或特化出不需雄性激素受體激活的路徑或變異出自體細胞雄性激素製造能力,對ADT不再有反應,此時病人血中睪固酮濃度雖然偏低(<50ng/dL或<1.7nmol/L),但PSA數值會持續升高(>2ng/ml)或是影像學上出現新病兆,就會演化成去勢抗性轉移性前列腺癌(metastatic castration-resistant prostate cancer, mCRPC)。在過去,這類病人只能給予化學治療,不僅可治療藥物品項有限,療效也不顯著。近幾年陸續有新藥核准上市,可提供mCRPC病人更多的藥物治療選擇,本文將探討去勢抗性轉移性前列腺癌之藥物治療新趨勢。
貳、藥物個論
一、雄性激素受體軸標靶(androgen receptor axis-targeted, ARAT)治療藥物
對於ADT治療產生抗藥性的機轉有很多種類,包括雄性激素受體(androgen receptor, AR)過度表現、AR突變以及經由其它非AR途徑或其它信號激活AR等。近年來研究發現,儘管已接受ADT治療的mCRPC病人仍對雄性素受體信號軸(AR signaling axis)有反應。以下介紹可以有效抑制雄性素合成以及與受體結合路徑的第二代ARAT藥物:
(一) Abiraterone (Zytiga)
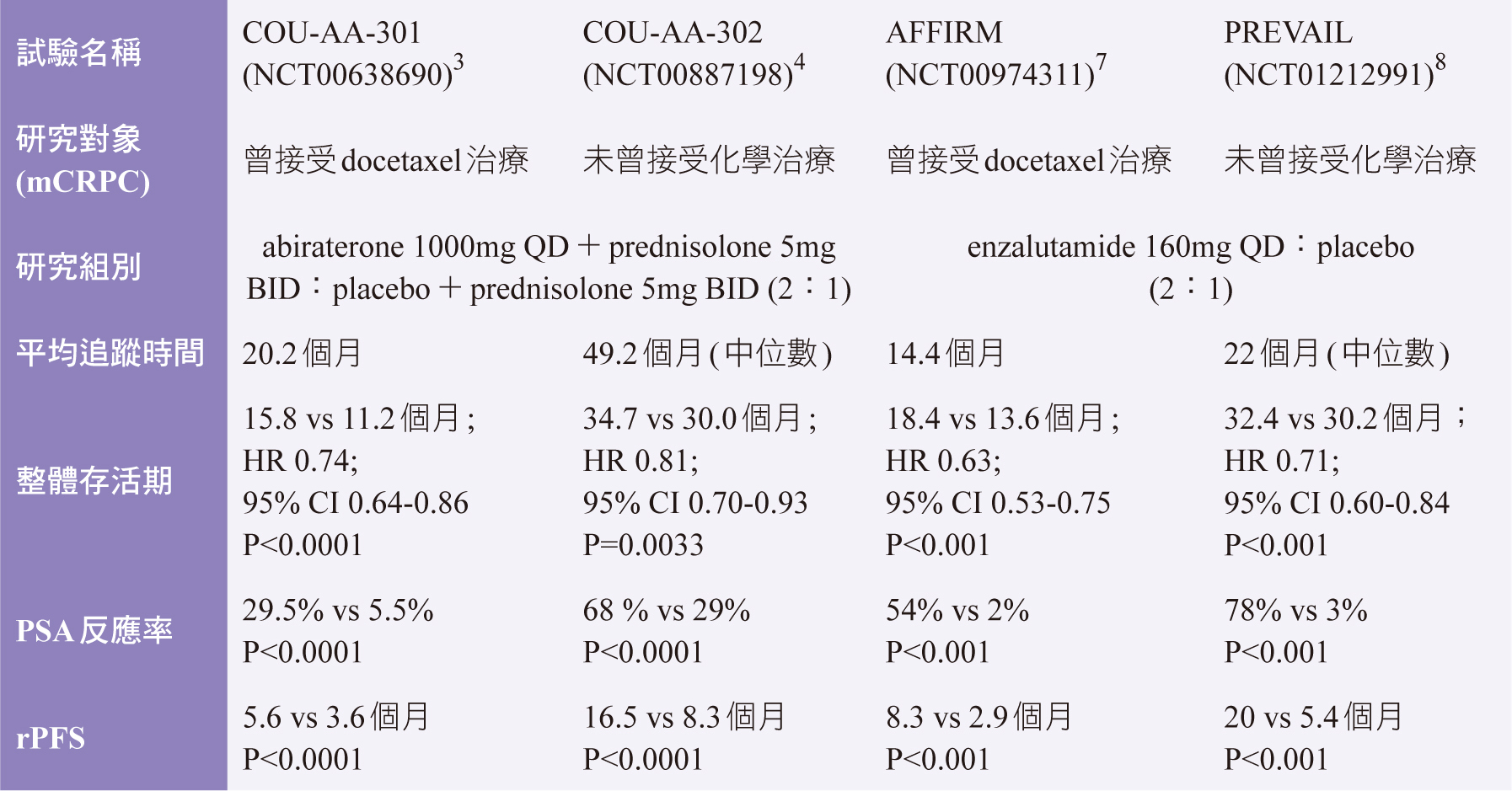
Abiraterone為雄性素生合成抑制劑,可選擇性且不可逆地抑制CYP17基因產物(包括17,20-lyase和17-α-hydroxylase),進而阻斷睪丸、腎上腺和腫瘤細胞生成雄性素。建議每日一次空腹口服1000 mg,且早、晚隨餐合併服用prednisone 5 mg。Abiraterone療效評估有兩個第三期臨床試驗,分別以先前曾接受docetaxel治療(COU-AA-301)3和未曾接受化學治療(COU-AA-302)4的mCRPC病人做為研究對象,COU-AA-301結果顯示abiraterone組相較於對照組可顯著延長整體存活期(overall survival, OS) 4.6個月(15.8 vs 11.2個月;P< 0.0001),次要評估指標包括:PSA 反應率、PSA惡化時間及影像學無惡化存活期(radiologic progression-free survival, rPFS),abiraterone組皆有顯著的療效(P< 0.0001)。此外,不論是否有發生內臟轉移,使用abiraterone同樣可以延長OS (有轉移4.6個月;P=0.102;無轉移4.8個月;P< 0.0001)以及減少死亡風險(21% vs 31%)5。在COU-AA-302試驗,abiraterone組顯著延長OS 4.4個月 (34.7 vs 30.3個月;P=0.0033)及rPFS (16.5 vs 8.3個月;P< 0.0001) 4,6。
由於abiraterone阻斷CYP17作用會引起礦物性皮質激素代償性升高 (mineralocorticoid excess),因此常見副作用包括:體液滯留、低血鉀及高血壓,這些副作用可藉由併服prednisolone來改善3,4,對於有心臟病、腎臟病及代謝症候群的病人則需要密切監測。
(二) Enzalutamide (Xtandi)
Enzalutamide是口服雄性激素受體信號傳遞抑制劑,經由競爭性抑制雄性素與雄性素受體的結合,干擾DNA基因轉錄調控作用,達到遏止癌細胞的生長並誘導腫瘤細胞凋亡。建議每日一次口服160mg。以先前曾接受docetaxel治療(AFFIRM試驗)7和未曾接受化學治療(PREVAIL試驗)8的mCRPC病人為研究對象,進行enzalutamide和安慰劑的療效比較,AFFIRM試驗結果顯示相較於安慰劑組,enzalutamide組可顯著延長OS 4.8個月和減少37%相對死亡風險(18.4 vs 13.6個月;P<0.001),且超過一半的病人可以產生PSA 下降超過50%的反應(54% vs 2%;P<0.001),此外,也明顯延後骨骼相關事件(skeletal-related event, SRE)的發生(16.7 vs13.3個月;P<0.001)。PREVAIL試驗顯示enzalutamide組相較於安慰劑組,可延長OS 2.2個月(P<0.001),首次發生SRE時間明顯延長(31個月;HR 0.72;95% CI 0.61-0.84)。
在安全性方面,enzalutamide常見副作用包括:疲倦、腹瀉、熱潮紅、骨骼肌肉疼痛和頭痛等,其中值得關注的是,使用該藥曾有極少數癲癇發作的案例報告,可能發生的機轉與enzalutamide抑制腦部GABAA受體調控的氯離子通道有關,因此有癲癇病史、腦外傷、腦腫瘤或腦中風等病人應小心使用。
以上abiraterone和enzalutamide是目前治療mCRPC最常使用的ARAT藥物(臨床試驗結果彙整如表一),療效也相當顯著,但仍有部分病人對於上述兩種藥物產生抗藥性,其發生抗藥性的機轉與雄性激素受體產生變異有關,研究發現其中AR剪接變異型- androgen receptor splice variant 7 (AR-V7)在mCRPC病人癌細胞表現量會升高,對於ARAT的治療效果就會不佳9,但在這樣情況下,病人即使AR-V7陽性,改用另一種ARAT藥物治療也可能有反應。根據2020年一篇統合性研究結果顯示,從abiraterone轉換到enzalutamide治療比從enzalutamide轉換至abiraterone治療有較好的PSA無惡化存活期 (prostate-specific antigen (PSA) progression-free survival, PSA-PFS) (HR 0.48;P < 0.001),但對於整體存活率則無顯著差異(HR 0.77;P = 0.055),且對於藥物治療反應都很短暫10。
表一、Abiraterone和enzalutamide第三期臨床試驗比較3,4,7,8
二、新型紫杉醇類藥物Cabazitaxel (Jevtana)
Cabazitaxel是新一代紫杉醇(taxane)類抗腫瘤藥物,可抑制微小管解離,能阻止癌細胞有絲分裂造成細胞凋亡。建議劑量為25 mg/m2,每3週靜脈輸注一次,每次輸注1小時,治療期間必須每天口服prednisone或prednisolone 10 mg來緩解疼痛並降低PSA濃度,常見副作用為嗜中性白血球低下、腹瀉、噁心及疲倦。2019年NCT02485691臨床試驗,針對先前接受docetaxel治療失敗改以ARAT治療12個月內發生疾病惡化之mCRPC病人,以1:1隨機分派為cabazitaxel組和ARAT藥物組,結果顯示cabazitaxel組可顯著改善中位存活期(13.6 vs 11個月;P=0.008)、PSA反應率 (35.7% vs 13.5%;P<0.001)及腫瘤緩解率(36.5% vs 11.5%;P=0.004)11。Cabazitaxel目前為mCRPC第三線治療藥物,台灣尚無健保給付。
三、癌症疫苗Sipuleucel-T (Provenge)
樹突細胞免疫療法sipuleucel-T是一種自體樹突細胞治療性疫苗,利用病人本身的抗原呈現細胞(antigen-presenting cells, APC)經由與前列腺癌細胞上的抗原和顆粒球巨噬細胞刺激因子的複合物加以培養,將培養後形成具活性的sipuleucel-T重新注入病人體內,藉此誘發病人自身的免疫系統,促使T細胞與前列腺癌細胞抗爭12。治療療程共需注射3劑,每劑間隔2週。IMPACT第三期臨床試驗收納512位Gleason score ≤ 7分mCRPC病人,顯示sipuleucel-T可顯著降低22%死亡率和延長存活中位期4.1個月(25.8 vs 21.7個月;HR 0.78;P=0.03) 13。副作用方面,使用sipuleucel-T會有寒顫、發燒、疲勞、噁心及頭痛,但症狀在1-2天後都能獲得緩解。2010年美國FDA核准sipuleucel-T用於無症狀或症狀輕微mCRPC病人,台灣目前尚未核准此藥。
四、PD-1免疫檢查點抑制劑Pembrolizumab (Keytruda)
錯配修復基因(mismatch repair, MMR)具有修復DNA鹼基錯配的功能,當發生缺陷(dMMR)會增加基因突變頻率,且特別會出現在微衛星不穩定性(microsatellite instability, MSI)部位。具有dMMR /MSI-H特徵的腫瘤細胞PD-1抗體有異常表現,約有2-5% mCRPC病人具有dMMR表現。Pembrolizumab為免疫檢查點anti-PD-1(programmed cell death-1)的單株抗體,主要作用機轉是藉由結合T細胞上的PD-1接受器,阻止腫瘤細胞上配體PDL-1、PDL-2和PD-1接合,使腫瘤細胞被暴露出來,誘發自身T細胞活化與增生來攻擊腫瘤細胞。建議劑量為每三週給予靜脈注射200 mg。KEYNOTE-199試驗納入mCRPC病人分為三組,分別為C1組PDL-1陽性、C2組PDL-1陰性及C3組骨轉移病人,給予pembrolizumab≦35個週期,結果顯示客觀緩解率C1組5%、C2組3%;C1、C2、C3三組的疾病控制率分別為10%、9%、22%;存活中位期則分別為9.5、7.9、14.1個月,明顯地在PDL-1陽性和骨轉移病人獲得很好的治療效果14。安全性方面,常見副作用有疲倦、腹瀉、搔癢。2017年美國FDA核准用於無法切除或轉移具有dMMR /MSI-H分子表現型的mCRPC病人。
五、口服標靶藥PARP抑制劑Olaparib (Lynparza)
Olaparib為poly ADP-ribose polymerase(PARP)抑制劑,PARP是一種DNA修復酶,在單股DNA缺損修復方面佔極重要的角色。研究顯示,抑制PARP可以讓具乳癌基因(breast cancer susceptibility gene, BRCA)突變的癌細胞沒有其它路徑來修復DNA,達到毒殺細胞效果,這對於帶有HRR生物標記物BRCA 1/BRCA 2和ATM基因突變的mCRPC病人迎來新的治療方向。此藥建議每日早晚口服300 mg,在PROfound第三期臨床試驗中,針對帶有突變的15種同源重組修復基因(homologous recombination repair, HRR)中任一種的mCRPC病人,隨機分配接受olaparib或另一種ARAT藥物,結果顯示olaparib可顯著降低帶有基因突變的mCRPC病人疾病惡化風險約66%和延長OS 4.4個月(19.1 vs 14.7個月;HR 0.69;P=0.02)15。常見副作用包括:貧血、噁心、疲勞、食慾下降及腹瀉。2020年美國FDA核准olaparib用於治療先前已接受過ARAT治療無效且具BRCA1/2或14個與DNA修復相關基因突變之mCRPC病人。
參、結語
在醫學科技大躍進的推波下,對於前列腺癌致病機轉除了有更多的了解外,也相繼研發出各類型的標靶藥物,雖然抗藥性問題一直以來都是癌症治療的一大難題,但目前也有相關的研究正在進行探討與克服,不論是併用不同藥理機轉的藥物或是相互轉換治療,其目的皆是希望能延長病人的生命和改善生活品質。隨著分子生物技術發展日趨成熟,期望未來能透過全方位的基因檢測找出更適當的治療藥物,以提供mCRPC病人個人化的精準醫療與藥物選擇。
Pharmacotherapeutic strategies for castration-resistant prostate cancer
Yuh-Yun Wu, Ya-Ting Cheng, Wei-Hsuan Huang,
Hsiu-Mei Chang, Chiou-Mei Wu
Kaohsiung Municipal Ta-Tung Hospital
Abstract
In Taiwan, incidence rate of prostate cancer (PCa) significantly increased in the past few years. It has become one of the most common cancers in men. As early stage of PCa is usually asymptomatic, the presence of tumor may be detected until it is already advanced or metastatic. Hormone therapy, so called androgen deprivation therapy or medical castration, is part of the standard care for metastatic prostate cancer. Though the majority of PCas initially respond well to hormone therapy, most will eventually develop castrate resistance. In the past, chemotherapy remains the only option for castration-resistant prostate cancer (CRPC). However, new treatment strategies have been discovered in recent years. Latest guideline suggests treatment such as new generation hormone therapy and chemotherapy, cancer vaccine, PD-1 inhibitors and PARP inhibitors. These novel effective options are proven to improve overall survival. In the future, the growing development of precision medicine may be a breakthrough for people facing CRPC.
參考資料:
1. Hyuna S, Jacques F, Rebecca LS et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 2021; 71(3): 209-249.
2. 衛生福利部109年國人死因統計。https://www.mohw.gov.tw/cp-5017-61533-1.html
3. Fizazi K, Scher HI, Molina A, Logothetis CJ, et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the COU-AA-301 randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 2012; 13(10): 983–92.
4. Ryan CJ, Smith MR, Fizazi K, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 2015; 16(2): 152-60.
5. Goodman OB, Flaig TW, Molina A, Mulders PF, et al. Exploratory analysis of the visceral disease subgroup in a phase III study of abiraterone acetate in metastatic castration-resistant prostate cancer. Prostate Cancer Prostatic Dis 2014; 17(1): 34-9.
6. Rathkopf DE, Smith MR, de Bono JS, et al. Updated interim efficacy analysis and long-term safety of abiraterone acetate in metastatic castration-resistant prostate cancer patients without prior chemotherapy (COU-AA-302). Eur Urol 2014; 66(5): 815-25.
7. Scher HI, Fizazi K, Saad F, et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 2012; 367(13):1187-97.
8. Beer TM, Armstrong AJ, Rathkopf DE, et al. Enzalutamide in metastatic 768 prostate cancer before chemotherapy. N Engl J Med 2014; 371(5): 424–33.
9. Armstrong AJ, Halabi S, Luo J, et al. Prospective multicenter validation of androgen receptor splice variant 7 and hormone therapy resistance in high-risk castration-Rrsistant prostate cancer: The PROPHECY Study. J Clin Oncol 2019; 37(13):1120-29.
10. Keiichiro M, Noriyoshi M, Hadi M, et al. Sequential therapy of abiraterone and enzalutamide in castration-resistant prostate cancer: a systematic review and meta-analysis. Prostate Cancer Prostatic Dis 2020; 23(4):539-48.
11. R de Wit, J de Bono , Sternberg CN, et al. Cabazitaxel versus Abiraterone or Enzalutamide in Metastatic Prostate Cancer. N Engl J Med 2019; 381(26): 2506-18.
12. Goldman B, DeFrancesco L. The cancer vaccine roller coaster. Nat Biotechnol 2009; 27(2): 129-39.
13. Kantoff PW, Higano CS, Shore ND, et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med 2010; 363(5): 411-22.
14. Antonarakis ES, Piulats JM, Gross-Goupil M, et al. Pembrolizumab for Treatment-Refractory Metastatic Castration-Resistant Prostate Cancer: Multicohort, Open-Label Phase II KEYNOTE-199 Study. J Clin Oncol 2020; 38(5): 395-405.
15. Hussain M, Mateo J, Fizazi K, Saad F, et al. Survival with Olaparib in Metastatic Castration-Resistant Prostate Cancer. N Engl J Med. 2020; 383(24): 2345-57.
通訊作者:吳秋玫/通訊地址:高雄市前金區中華三路68號
服務單位:高雄市立大同醫院(委託財團法人私立高雄醫學大學經營)藥學科/聯絡電話:(O) 07-2911101 ext 8372