非洲人類錐蟲病治療與口服新藥Fexinidazole介紹
陳素容1、張基元2
1嘉南藥理大學藥學系、2鄭仁偉耳鼻喉科
摘要
非洲人類錐蟲病 (Human Africa Trypanosomiasis, HAT)藥物治療一直是藥物發展重要課題,有鑑於感染性疾病高死亡率,錐蟲好發在非洲,可透過testes fly蚊媒傳播,錐蟲能在人體內生長,侵入中樞神經系統導致昏睡、認知異常、死亡。隨著現代運輸交通、人口流動等,感染疾病也可擴及周邊歐亞洲。目前治療藥物策略多以肌肉注射、靜脈注射給藥,美國食藥署2021年7月核准新藥Fexinidazole,用於口服治療第一階段與第二階段感染T. b. gambiense,適用病患族群需6歲以上、體重至少20公斤,隨著新型口服用藥的問世與國際醫療組織在非洲傳染病的管控,非洲昏睡病的治療將會更進一大步。
關鍵字: Fexinidazole、非洲人類錐蟲病、testes fly、African sleeping sickness
壹、 前言
非洲人類錐蟲病 (Human Africa Trypanosomiasis, HAT)是一種致死性的寄生蟲感染疾病,有稱為昏睡病(sleeping sickness),疾病主要盛行於非洲。最早,源於1734年,首先由英國軍醫John Atkin提出非洲昏睡症(African sleeping sickness)醫學上疾病的描述,John Atkin當時服務於英國海軍軍船解送黑奴從西非至西印度群島,當時對疾病的臨床表徵為昏迷致死的特性精準描述,推斷病因卻是帶有歧視的論定Negro lethargy(黑人嗜睡症),原因為大腦未使用導致自然性腦退化1。隨著近代的醫學發展,發現昏睡症的致病原為錐蟲(Trypanosoma),主要透過采采蠅(testes fly)載體以蟲媒傳染的形式感染人體,其中致病錐蟲亦可分成兩種: (1)Trypanosoma brucei rhodesiense 與(2)Trypanosoma brucei gambiense,兩者有不同流行病學分布、臨床症狀和治療方式2,3,7。
一、疾病流行病學
近代史中,非洲人類錐蟲病 (Human Africa Trypanosomiasis, HAT)經過了三次大流行:1896至1906年間造成80萬死亡數,接著1920至1940年晚期爆發第二次大流行,於1960年後趨緩,但1990年晚期在撒哈拉沙漠以南第三次流行4。根據WHO數據預估,1998年間有30萬感染人數,2006年下降至5萬至7萬,到2009年首次低於1萬人,經過WHO與相關醫療組織的努力,加強感染源控制、疾病診斷與治療的準確性,非洲人類錐蟲病傳染疫情得以在非洲控制下來,當中非洲偏遠地區因疾病控管不易、數據難掌握等因素,仍有感染黑數的可能性5。
現今非洲人類錐蟲病(HAT)分布以撒哈拉沙漠以南為主,確診案例以Trypanosoma brucei gambiense (T. b. gambiense)型佔98%,其感染主要分布在西非與西南非,如:幾內亞、科特迪瓦、烏干達、奈及利亞南部、喀麥隆、赤道幾內亞、聖多美、安哥拉、剛果民主共和國,其中剛果民主共和國被報導出有最高的T. b. gambiense感染發生數(86%);另外,Trypanosoma brucei rhodesiense (T. b. rhodesiense)感染主要分布在東非,影響國家包括:辛巴威、烏干達南部、盧安達、布蒲隆地、坦桑尼亞、馬拉威和尚比亞,以馬拉威與烏干達佔43%與39% 的T. b. rhodesiense確診數3(表一)。短期旅訪非洲感染HAT患者以T. b. rhodesiense型為主,長期旅訪(超過30天)將大幅增加感染T. b. gambiense的風險,特別是有旅遊至高風險國家1, 3。
二、 非洲錐蟲生長史與傳染途徑
錐蟲生物堤內繁殖期可分為兩階段循環:(1)哺乳類宿主時期、(2)采采蠅時期。人類是T. b. gambiense最主要的哺乳類宿主,T. b. rhodesiense則被發現除了人類,也包括:能傳染家畜、牛隻等;采采蠅屬於Glossinidae(舌蠅屬)分布在南撒哈拉沙漠(北緯15度至南緯26度),以吸食哺乳類血液維生,兩種致病錐蟲由不同采采蠅蟲媒傳染(表一),錐蟲生長期於采采蠅時期約為期三周2, 5。
表一 非洲錐蟲比較表
(一) 哺乳類宿主時期 (mammalian host stages)
1. 藉由采采蠅叮咬,錐蟲被注入宿主中,進入宿主血流。
2. 錐蟲輸送至淋巴、腦脊髓中液,並用分裂繁殖於宿主體內擴增群體數。
3. 錐蟲經過完整細胞外生長期,錐蟲在采采蠅叮咬時能透過血液感染采采蠅。
(二) 采采蠅時期 (testes fly stages) :
1. 進入了蠅內中腸,錐蟲轉變成procyclic trypomastigotes (順循環錐蟲體),亦透過分裂繁殖擴增子代
2. 錐蟲離開中腸後,轉變成鞭毛型態epimastigotes (錐鞭毛體)。
3. epimastigotes (錐鞭毛體)能進入采采蠅唾液腺。
4. 藉由叮咬,將錐蟲傳染至哺乳類宿主中。
貳、 非洲人類錐蟲病症狀與診斷
非洲人類錐蟲病感染人體後,臨床表徵可分成兩階段:第一階段-血淋巴期(haemolymphatic stage)與第二階段-腦膜炎期(meningoencephalitic stage),進入第二階段與否以錐蟲是否已入侵感染腦脊髓液為確診依據。T. b. gambiense屬於慢性潛伏期,感染後數周至數月後才出現症狀;T. b. rhodesiense屬於急性感染,約數天至周內就會出現臨床症狀2, 3。
一、 第一階段-血淋巴期(haemolymphatic stage)
常見在被叮咬處出現trypanosomal chancre(錐蟲下疳),在T. b. rhodesiense感染患者較為常見,若未仔細診斷可能會誤診,延誤治療時間,一般在一至三周內下疳就會自癒,其他症狀如:發燒、皮膚搔癢、淋巴結腫大皆常發生。T. b. gambiense感染患者典型症狀-淋巴結腫大,主要好發在頸後側與鎖骨上淋巴結,又稱為Winterbottom sign,淋巴結先是柔軟、能移動,之後變硬但無痛,四肢與臉出現無痛水腫現象,部分患者有輕度到中度肝、脾腫大,少比例出現心肌炎或心包炎症狀。T. b. rhodesiense感染患者除了在這兩階段中普遍都出現發燒,頭痛症狀常伴隨肌肉痠痛與關節痛,皮疹與臉、四肢水腫也常發生,淋巴結腫大好發在頷下、腋下與腹股溝區。
二、 第二階段-腦膜炎期(meningoencephalitic stage)
錐蟲經血流進入中樞神經系統,造成神經精神性症狀,睡眠障礙的典型症狀出現:白天嗜睡、晚上失眠,形成生理時鐘周期混亂、失常,疾病末期階段,患者會出現意識低弱、失智,導致昏迷、吸入性肺炎或細菌感染致死。感染至腦區,可能使得行為與情緒上改變,行為上像是攻擊行為、行動遲緩、肌肉僵直、平衡失調、步態異常、巴金森氏症狀等,情緒上易怒、冷漠、抑鬱、幻覺或譫妄。第二階段臨床症狀T. b. gambiense感染病程發展緩慢且溫和,相對T. b. rhodesiense發展快速且及急性,期數周至數月內即可能造成死亡,兩種錐蟲感染源皆需積極治療,在未治療下皆會導致死亡。
參、 非洲人類錐蟲病臨床治療
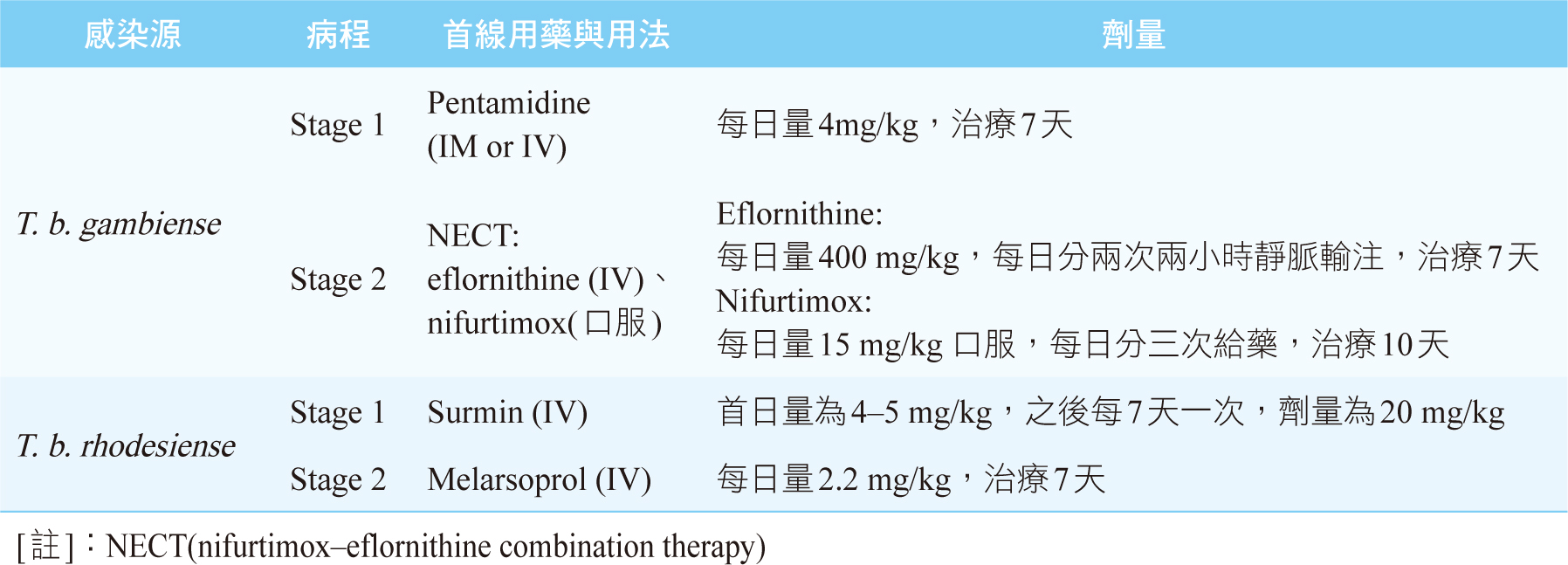
根據2013 WHO 指引,治療藥物主要以IM或IV給藥,T. b. gambiense治療藥物有(eflornithine、melarsoprol、nifurtimox、pentamidine),T. b. rhodesiense治療藥物有(melarsoprol、pentamidine、suramin),如表二。若T. b. gambiense病程至第二階段,首線藥物NECT組合使用受限,如病患罹患癲癇性精神病,替代療法為(1) eflornithine每日量400 mg/kg,每日分4次次兩小時靜脈輸注,治療14天,單方eflornithine治癒率能提升至97%,(2) Melarsoprol每日量2.2 mg/kg,治療7天;T. b. rhodesiense第一階段治療亦可用Pentamidine (IM or IV)每日量4mg/kg,治療7天。孕婦治療時,eflornithine、melarsoprol、nifurtimox理論上的禁忌用藥,T. b. gambiense感染首線用藥為Pentamidine (IM)每日量4mg/kg,治療7天,且需為進入第二孕期時才能施打,NECT藥物須為產後方能給藥,但孕婦性命危急時,必要時可以給予;此外T. b. gambiense病程為急性,通常不能延誤Surmin (IV)、Melarsoprol (IV)治療,產後胎兒也需抽血檢測是否母子垂直感染錐蟲病2,3,6,8。
表二 非洲人類錐蟲病藥物治療
肆、 口服新藥Fexinidazole
美國食藥署(FDA)於2021年7月通過口服藥物Fexinidazole,核准適用於第一階段或第二階段由Trypanosoma brucei gambiense引發之非洲人類錐蟲病(HAT)。Fexinidazole為第一個全口服治療HAT之藥物,適用病患族群需6歲以上、體重至少20公斤,Fexinidazole相關副作用與藥物警示,如表三9。
表三 副作用與警示
一、 藥物機轉
研究發現錐蟲內酵素nitroreductase (NTR)能活化fexinidazole與其代謝物(M1、M2),誘發產生反應性胺,破壞錐蟲內DNA、蛋白質之恆定,但fexinidazole詳細藥物機制仍未知。
二、 藥物動力學
Fexinidazole 肝酵素(CYP1A2, 2B6, 2C19, 2D6, 3A4, 3A5 )代謝成M1、M2,第10天平均半衰期為15 ± 6小時(Fexinidazole)、16 ± 6 小時(M1)、 23 ± 4小時(M2),Fexinidazole第4天平均清除率為161 (±37) L/hour。
三、 臨床試驗
Fexinidazole一共做了三個臨床試驗,Trial 1 (NCT01685827):比較與NECT療效與安全性,收案病患為T. brucei gambiense第二階段病程,病患血液、淋巴液、腦脊髓液可採集到錐蟲,若腦及髓液無採集到錐蟲,腦及髓液中的白血球數需大於>20 cells/μL,以2:1隨機分組:Fexinidazole(n=264)、NECT(n=130),年齡平均35歲,Fexinidazole組別第一天至第四天給予1800 mg,之後五天給予1200 mg;NECT組別,nifurtimox口服日量15 mg/kg,為期10天、eflornithine輸注日量400 mg/kg,為期7天。第18個月治癒率Fexinidazole (91.2%)、NECT(97.6%),其中Fexinidazole組有9名受試者死亡,用於第二階段T. brucei gambiense治療與NECT相比有較高死亡率、較低療效。Trial 2 (NCT02169557) 與 Trial 3 (NCT02184689)皆為單臂試驗,含括T. brucei gambiense第一、第二階段患者,Trial 2受試者年齡平均為34歲,82%第一階段病程、Trial 3收案青少年與幼童,年齡層介於6至15歲,體重20公斤以上,55%為第一階段病程。Fexinidazole第一天至第四天給予1200 mg,之後五天給予600 mg(體重小於35公斤者),若體重大於35公斤給予成人劑量。第12個月治療成功率,Trial 2為98.7%、Trial 3為97.6%。
伍、結語
Fexinidazole為首款非洲人類錐蟲病全口服用藥(all-oral treatment),既2018年歐盟藥品管理局(EMA)給予Fexinidazole正面審查回饋後,在2021年此藥經過美國食藥署核准通過,為非洲人類錐蟲病的治療便利性與普及性點亮明燈,也是賽諾菲藥廠(Sanofi)二十年來與世界衛生組織致力於對抗被忽略的熱帶疾病(Neglected Tropical Diseases, NTD)的成果,雖然Fexinidazole僅限適用於T. b. gambiense感染之患者,目前對於T. b. rhodesiense之感染仍只有針劑劑型藥物,此外其他不同亞型的錐蟲病感染藥物仍在努力研發中,日後的蓬勃的藥物發展,杜絕人類錐蟲病指日可待。
Current Treatment for Human Africa Trypanosomiasis and newly approved oral drug Fexinidazole
Sujong Chen1, Chi-yuan Chang2
1Department of Pharmacy, Chia Nan University of
Pharmacy & Science
2Cheng Ear Nose Throat Clinic
Abstract
Human Africa Trypanosomiasis (HAT) is a lethal infectious disease, highly occurred in Africa. By means of testes fly transmission, trypanosoma can reproduce in human body and caused a variety of symptoms, especially in the second stage, trypanosoma evade in CNS, resulting to abnormal cognition, coma and death . Currently, drug treatments are through intramuscularly or intravenously. July 2021, U.S. FDA approved all-oral drug, Fexinidazole, can be used for patients in first stage and second stage of T. b. gambiense infection. With novel oral drug Fexinidazole and the effort of disease control by WHO, HAT is a curable disease.
參考資料:
1. Krinsky, W.L., Tsetse Flies (Glossinidae), in Medical and Veterinary Entomology (3rd Edition), Gary Mullen and L. Durden, Editors. 2018, Charlotte Cockle: Cambridge, MA. p. 369-381.
2. Rosenthal, P.J., African Trypanosomiasis (Sleeping Sickness), in Current Medical Diagnosis &Treatment 2021, M.A. Papadakis, S.J. McPhee, and M.W. Rabow, Editors. 2021, McGraw Hill Education: New York, NY.
3. Chappuis, F. and Y. Jackson, Chagas Disease and African Trypanosomiasis, in Harrison's Principles of Internal Medicine, 20e, J.L. Jameson, et al., Editors. 2018, McGraw-Hill Education: New York, NY.
4. Brun, R., et al., Human African trypanosomiasis. The Lancet, 2010. 375(9709): p. 148-159.
5. Kennedy, P.G.E., Clinical features, diagnosis, and treatment of human African trypanosomiasis (sleeping sickness). The Lancet Neurology, 2013. 12(2): p. 186-194.
6. WHO interim guidelines for the treatment of gambiense human African trypanosomiasis. Available from:https://apps.who.int/iris/bitstream/handle/10665/326178/9789241550567-eng.pdf
7.T rypanosomiasis, African. Centers for Disease Control and Prevention. Available from: https://www.cdc.gov/dpdx/trypanosomiasisafrican/index.html
8. Control and surveillance of human African trypanosomiasis. Available from: https://apps.who.int/iris/bitstream/handle/10665/95732/9789241209847_eng.pdf
9. Fexinidazole prescribing information from FDA. Available from: https://www.accessdata.fda.gov/drugsatfda_docs/label/2021/214429s000lbl.pdf
通訊作者:陳素容/通訊地址:台南市仁德路一段60號
服務單位:嘉南藥理大學藥學系/聯絡電話:(O) 06-2664911 ext 2232