Sotorasib:KRASG12C突變非小細胞
肺癌治療的里程碑
許育瑋、蔡佩芬
嘉義基督教醫院藥劑科藥師
摘要
KRAS突變是非小細胞肺癌中常見的突變類型,有近25%的患者會出現此突變,而非小細胞肺癌在KRAS G12C位置的突變,又明顯高於其他癌別。KRAS突變除了對預後可能有負面的影響外,在過去也沒有直接作用的藥物,一直以來是非小細胞肺癌臨床治療上的困境。Sotorasib是一種專一且不可逆的小分子KRASG12C抑制劑,會共價性的結合至只會出現在非活化態GDP的switch II位置上,誘使KRASG12C維持在不活化態並抑制KRAS的訊息傳遞。美國FDA在2021年5月28日以加速核准的方式,同意了sotorasib(LumakrasTM)的上市申請,核准其用於至少經過一次全身性治療的KRASG12C突變局部晚期或轉移的非小細胞肺癌。Sotorasib是第一個核准用於KRASG12C突變的藥物,在KRAS突變的非小細胞肺癌治療上,可說是一個突破性的重大里程碑。
關鍵字: 非小細胞肺癌、NSCLC、KRAS、G12C、Sotorasib、CodeBreaK 100
壹、前言
過去幾年來,特別是在非小細胞肺癌(non-small cell lung cancer, NSCLC)的腺癌(adenocarcinoma)等實體腫瘤上,有許多致癌驅動基因被發現,同時也陸續發展了許多對應的酪氨酸激酶抑制劑(tyrosine kinase inhibitor, TKIs),使得NSCLC在治療上已有相當大的進步。另外也因為這些TKIs在特定基因突變的局部晚期、無法開刀,或轉移性肺腺癌患者的效果都較標準化療來的好,因此基因分子型態是目前這類患者常規用來決定治療方式的參考依據1。
Kirsten rat sarcoma viral oncogene homologue (KRAS)是人類癌症中最常出現突變的致癌基因,當KRAS突變時會使KRAS呈現活化態,出現不正常高濃度的guanosine triphosphate(GTP)結合態KRAS,導致下游致癌訊息路徑的過度活化與癌細胞不受控的生長,在NSCLC的KRAS突變中,約有半數是發生在KRASG12C的位置2,3。然而遺憾的是,由於KRAS藥物發展並不順利,因此KRAS突變在過去數十年來一直被認為沒有藥物可治療。
Sotorasib是第一個作用在KRASG12C突變的藥物,美國FDA在2021年5月28日以加速核准的方式,同意了sotorasib(Lumakras®)的上市申請4。KRASG12C突變的NSCLC患者,在sotorasib核准前除了二線化療外並沒有其他的治療選擇,sotorasib的核准可說是NSCLC KRAS突變治療上一個突破性的里程碑。
貳、KRAS對癌症的影響
一、KRAS在腫瘤生長之角色
RAS(Rat sarcoma virus)是人類腫瘤中最常出現突變的基因,RAS家族(KRAS, HRAS, NRAS)的突變約占所有腫瘤突變的25-27%5,6,而在某些腫瘤(如:胰腺癌)中的突變率甚至高達90%。RAS中又以KRAS為最常見的突變種類,整體而言約佔所有RAS突變的85%左右7。KRAS突變與肺癌、大腸直腸癌等數種上皮癌組織型的病發機轉有關,另外胰管線癌的發生、轉移及治療的抗藥性也與KRAS有密切關連性5,6。
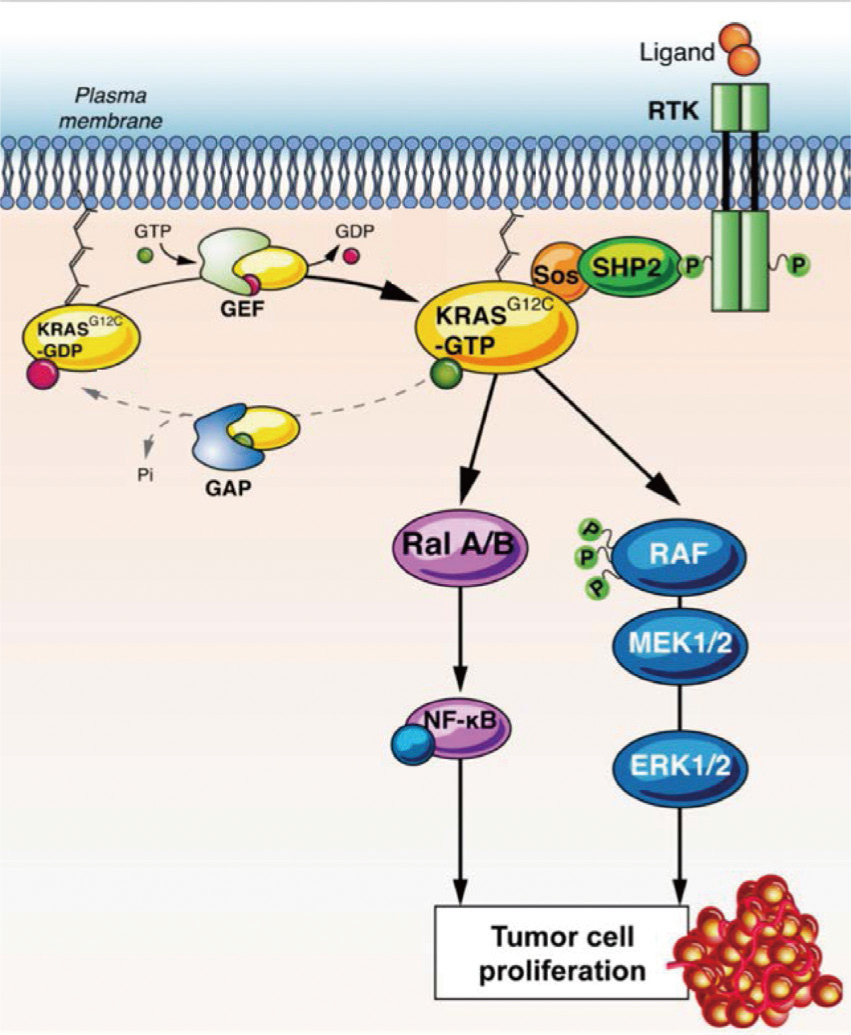
KRAS是一種具guanosine triphosphate (GTPase)活性的膜結合蛋白,功能為將細胞膜上的生長因子接受體,連結至細胞內的訊息路徑及轉錄因子上,作為活化態GTP和非活化態guanosine diphosphate (GDP)間的分子轉換開關,在細胞的生長調節程序上扮演了關鍵的角色。在靜止的細胞,KRAS會以GDP結合的非活化態存在,當接收到細胞外的刺激時,即會轉化為GTP結合的活化態。而非活化態轉化為活化態,是由可結合GTP的鳥嘌呤核苷酸交換因子(guanine nucleotide exchange Factors, GEFs)來調節;相反的,活化態轉化為非活化態,則是由GTPase-activating proteins(GAPs)的GTP水解作用所調控2,5,6,7 (圖一)。當KRAS轉化為活化態時,會活化細胞內mitogen activated protein kinase(MAPK)及phosphoinositide 3-kinase(PI3K)…等不同的下游訊息路徑,同時也會活化像是Ets-likes(ELK)、JUN及MYC等數種轉錄因子,促進參與細胞分化、增殖、轉化和存活的關鍵過程6。臨床前的研究發現,KRAS突變在癌化過程的早期即會出現,並且促進腫瘤細胞的存活、侵犯及移動7。
圖一 KRAS的活化機轉8
二、KRAS突變時的影響
KRAS突變時會影響GTPase的內在活性,影響GTPase-activating proteins (GAPs)將GTP轉化為GDP之能力,進而出現不正常高濃度的GTP結合態KRAS,使得下游訊息路徑持續活化,導致腫瘤細胞持續的分化及生長。除了這種持續複製的特性外,腫瘤細胞表現KRAS突變也會誘發cytokines、chemokines及growth factors的生成,影響周圍基質細胞的重塑。此外,KRAS也會與其他突變的致癌基因及腫瘤抑癌基因產生作用,誘發促發炎免疫抑制基質(pro-inflammatory immunosuppressive stroma),導致免疫逃避及腫瘤惡化3,6。
參、KRAS突變與非小細胞肺癌之關聯
一、KRAS突變在實體腫瘤的發生率
胰臟癌(88%)、大腸直腸癌(45-50%)及肺癌(31-35%)是最常出現KRAS突變的癌別7。而KRAS的突變又多出現在G12C、G12D、G12V及G12R的位置上5。就突變的位置而言,KRAS的突變約有一半會發生在G12C的位置,而該KRASG12C的突變,目前已知最常出現在NSCLC、大腸直腸癌、闌尾癌及小腸癌上,其中又以NSCLC的發生率(13.8%)明顯高於其他的癌別(3.1-3.3%);除此之外,KRASG12C突變在其他實體腫瘤的發生率並不高6,9。至於KRASG12D、KRASG12V及KRASG12R位置的突變,則較常出現在胰臟癌中的胰管線癌上5。
二、KRAS突變在NSCLC的現況
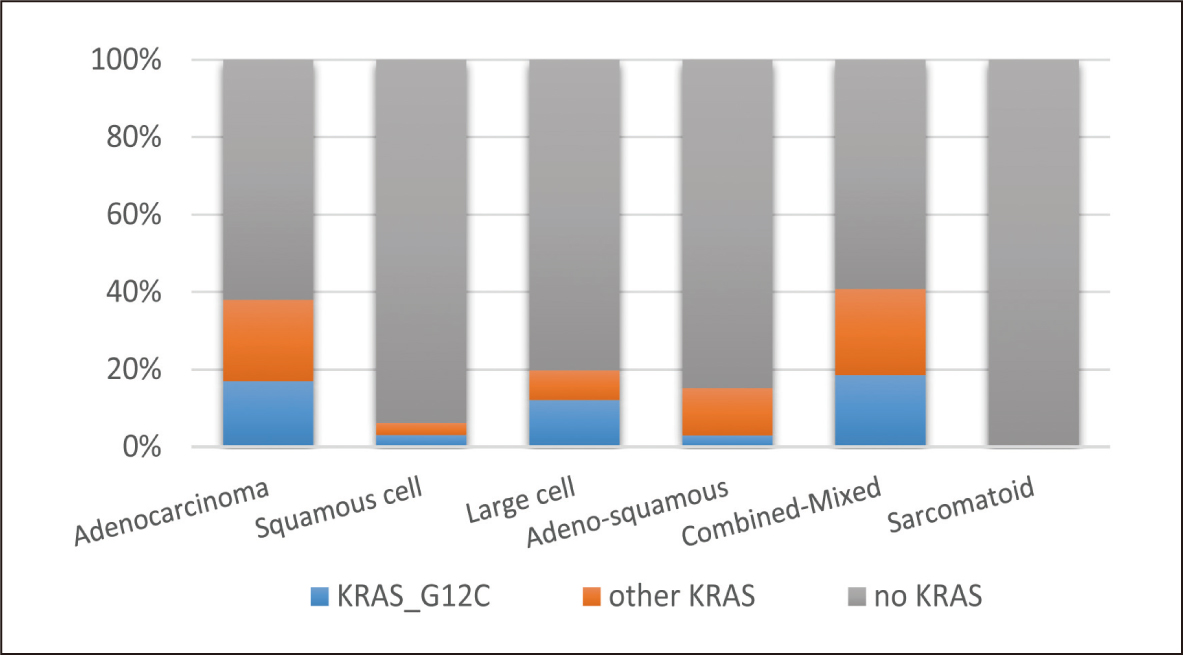
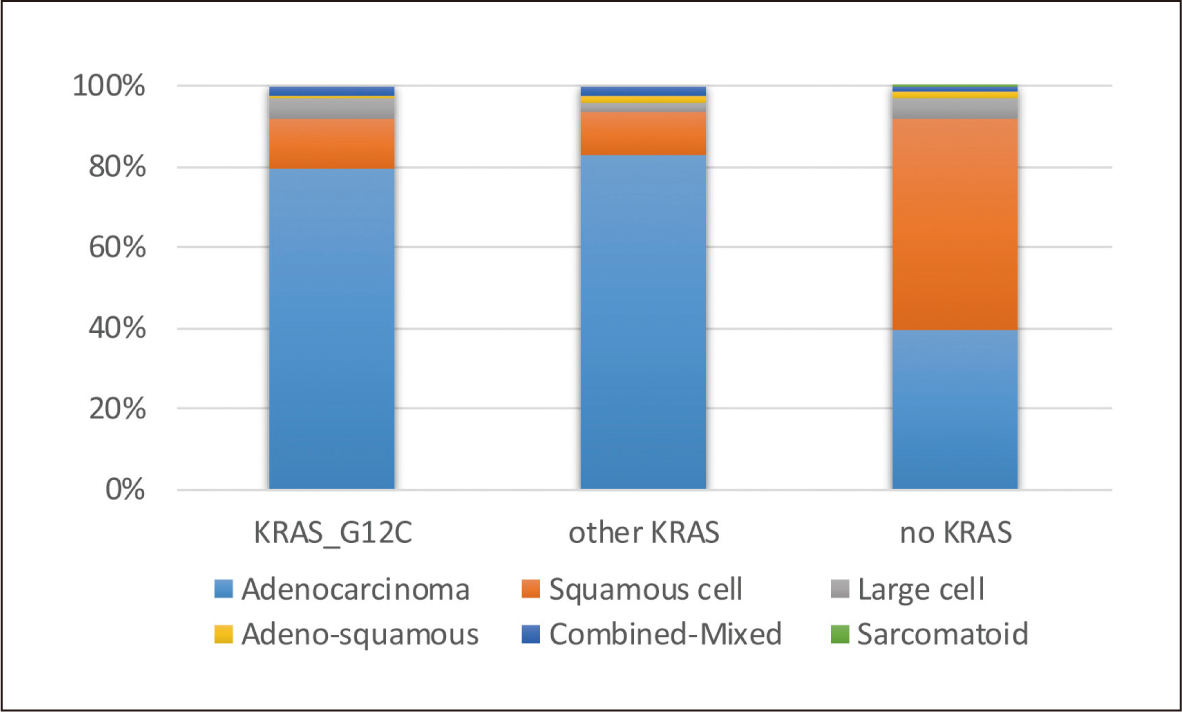
KRAS突變是NSCLC中常見的突變類型,整體而言,NSCLC患者發生KRAS突變的比例約23%左右,而在這些KRAS突變的患者中,又以G12C位置的突變佔了所有KRAS突變的多數(45.7%)。此外,若以肺腺癌、鱗狀癌及大細胞癌這三種NSCLC最常見的組織學型態來看,肺腺癌除了在KRAS突變的發生率是三者之首,同時不論是在G12C位置或非G12C位置的KRAS突變發生率(17.0%, 21.0%),也都明顯高於鱗狀癌(3.1%, 3.1%)及大細胞癌(12.1%, 7.7%)(P<0.01)(圖二)。再者,若以KRAS突變的位置來看,肺腺癌不論是在G12C位置或非G12C位置突變的佔比(79.6%, 82.9%),也都明顯高於鱗狀癌(12.5%, 10.5%)及大細胞癌(5.1%, 2.7%)(P<0.01)1 (圖三)。
圖二 KRAS突變在不同組織學之佔比1
圖三 各組織學在不同KRAS突變之佔比1
此外,若以人種來看,在NSCLC患者中,白人及黑人發生KRASG12C突變的比例較亞洲人高(13% & 10.9% vs. 3.6%, P<0.001);而特別的是,NSCLC患者在不同種族間的KRASG12C突變發生率,在性別上出現了不同的結果,NSCLC的白人女性KRASG12C突變比例較白人男性高(OR=1.4, 95% CI 1.3-1.6, Q<0.001),但在亞洲男性的發生率則較亞洲女性高(OR=5.2, 95% CI 1.9-17.9, Q=0.01)9。至於KRAS突變在NSCLC預後上的角色,目前仍未有明確之定論,一般多認為KRAS突變患者的預後較差1,6,10,但也有研究認為KRAS突變與否對預後沒有影響2,7。
三、KRAS突變時的治療困境
由於KRAS與GTP有極佳之親和力,同時在其位置上也缺乏適當結合位置,使得直接作用在KRAS的藥物發展上並不順利,因此一直以來,KRAS突變的NSCLC除了化療外,在臨床上並沒有合適的治療可以選擇3,7。即便過去有許多間接作用在KRAS的機轉被嘗試用來治療KRAS突變的NSCLC,包括有轉譯後修飾(post-translational modifications)、細胞膜定位(membrane localization)、蛋白質交互作用(protein-protein interactions),以及抑制包括RAF/MEK/ERK及PI3K/AKT/mTOR等KRAS下游訊息路徑等療法,但都沒有出現臨床之效益7。其中較令人惋惜的是,雖然MEK抑制劑selumetinib在第二期試驗的無惡化存活期上有具統計學意義的效果,但在第三期試驗中,selumetinib與docetaxel的合併治療,與化療相較卻無法增加KRAS突變NSCLC的無惡化存活期11;而另一個MEK1/MEK2抑制劑trametinib與docetaxel相較,也沒有辦法增加KRAS突變NSCLC患者的無惡化存活期及反應率12;推估可能是因為這些訊息路徑存在有各種替代回饋機制所致6。換言之,在sotorasib上市前,KRAS突變的NSCLC患者除了二線化療及免疫療法外並沒有其他的治療選擇。
肆、Sotorasib的機轉與效益
一、Sotorasib的作用機轉與適應症
Sotorasib是一種專一且不可逆的小分子KRASG12C抑制劑,會共價性的結合至只會出現在非活化態GDP的switch II位置上,誘使KRASG12C維持在不活化態並抑制KRAS致癌性的訊息傳遞3,7。美國FDA在2021年5月28日以加速核准的方式,同意了sotorasib(LumakrasTM)的上市申請,目前核准其用於至少經過一次全身性治療的KRASG12C突變局部晚期或轉移的非小細胞肺癌4。使用方式為每天口服一次960mg,直至疾病惡化或出現無法耐受之毒性13。
二、Sotorasib的臨床效益
Sotorasib在第一期的臨床試驗中,因證實對KRASG12C突變的晚期固態腫瘤有抗癌活性,且其抗癌活性在NSCLC的患者上又特別明顯,因此在後續以名為CodeBreaK 100(NCT03600883)的第二期臨床試驗,針對曾以標準療法治療過的KRASG12C突變晚期NSCLC患者,投予每天960mg的sotorasib來觀察療效。主要的試驗終點為客觀反應率(complete response(CR)或partial response(PR)),次要終點包括反應持續時間、疾病控制(定義為CR、PR或stable disease(SD))、無惡化存活期(progression free survival, PFS)、整體存活期(overall survival, OS)及安全性3。
(試驗終點說明:CR、PR或SD都是”固體腫瘤療效評價標準”(The Response Evaluation Criteria in Solid Tumors, RECIST)”中,利用腫瘤大小變化來評估治療效果的指標,RECIST是針對固體腫瘤所發展出來,且為目前廣為使用的療效評估標準。PFS指從治療開始直至發生疾病惡化或死亡的時間。OS指患者從治療開始直至發生死亡的時間)
在最後分析的126位患者中,絕大多數(81.0%)曾接受過以鉑類藥物為基礎的化療及PD-1或PD-L1抑制劑的治療組合,最後共124位患者可進行疾病量測及反應的評估。Sotorasib在研究中的整體的客觀反應率(objective response rate)為37.1%(95% CI: 28.6-46.2)(n=46),疾病控制率(disease control rate)為80.6%(95% CI: 72.6-87.2)(n=100),出現CR的患者有4位(3.2%),出現PR的患者有42位(33.9%),SD的則有54位(43.5%)。中位反應持續時間為11.1個月,中位PFS為6.8 個月(95% CI: 5.1-8.2),中位OS為12.5個月3。美國FDA也基於此試驗而以快速核准方式同意了sotorasib的上市申請。
伍、Sotorasib的副作用與抗藥性
一、Sotorasib的副作用
在CodeBreaK 100研究中,副作用的整體發生率為69.8%,發生率較高的副作用依序為腹瀉(31.7%)、噁心(19.0%)、AST升高(15.1%)、ALT升高(15.1%)及疲倦(11.1%)。至於較嚴重的第3級及第4級副作用發生率為19.8%及0.8%,主要也是以AST/ALT升高及腹瀉為首要。此外,有28位(22.2%)患者因為副作用而需要調整劑量,另有9位(7.1%)需要停止治療10;最常出現與治療相關的第3級副作用為ALT上升(6.3%)、AST上升(5.6%)及腹瀉(4.0%),並沒有與治療相關的死亡6。
整體而言,Sotorasib的副作用多為輕微且可逆,但仿單中有提到需要特別注意肝毒性及肺炎/間質性肺部疾病的可能,這些副作用發生的機會雖然低,但有致命之風險。Sotorasib治療過程中若有任何肺部徵狀的新發或惡化,都應該立即停止sotorasib的治療並進行緊急的評估與處置13。
二、Sotorasib可能的抗藥性
根據RAS路徑其他抑制劑的經驗,這類藥物在體內最終多會出現抗藥性,在最近的臨床前研究中,似乎也暗示了sotorasib抗藥性之可能性。在研究中發現,當多數突變的KRASG12C細胞進入休止期(G0)時,其他的細胞則會迅速重新獲得RAS活性並恢復分化,此現象似乎是因為MAPK路徑訊息降低,而產生新的KRASG12C細胞所致;而此新產生的KRASG12C則會因為epidermal growth factor receptor (EGFR)及phosphatase SHP2訊息的作用,而使其維持在GTP結合及對藥物不敏感的活化態。而在其他的研究也發現,KRASG12C抑制後的RAS路徑再活化,也可能是由野生型的RAS所調節,數種tyrosine kinases接受體會快速產生回饋再活化反應(feedback reactivation),引起HRAS及NRAS的活化,以及後續與KRASG12C無關的訊息傳遞8,14。至於sotorasib實際的抗藥性發生情況為何,仍有待上市後的使用經驗才可得知。
陸、結論
KRAS突變是NSCLC中常見的突變類型,而其中又以KRASG12C位置的突變,佔了所有KRAS突變的近半數。KRAS突變除了對預後可能有負面的影響外,在過去也沒有直接作用的藥物,一直以來是NSCLC臨床治療上的困境。Sotorasib是第一個作用在KRASG12C突變的小分子藥物,在曾治療過的局部晚期或轉移的KRASG12C突變NSCLC患者上,可以增加患者的無惡化存活期及整體存活率,可說是KRASG12C突變之NSCLC治療上一個重大的突破性里程碑。
A breakthrough in the treatment of KRASG12C mutant non-small cell lung cancer
Yu-Wei Hsu, Pei-Fen Tsai
Department of Pharmacy, Ditmanson Medical
Foundation Chia-Yi Christian Hospital
Abstract
KRAS mutations is a frequent genetic alterations found in patients with non-small cell lung cancer (NSCLC), accounting for about 25% of all mutations in NSCLC. The mutation of non-small cell lung cancer at the position of KRAS G12C is significantly higher than that of other cancers. KRAS mutation seems to be an independent negative prognostic factor for NSCLC patients, it has been considered as “undruggable”.
Sotorasib is a small molecule covalent KRASG12C inhibitor that specifically and irreversibly binds to the switch II region that is present only in the inactive GDP-bound conformation, trapping KRASG12C in the inactive state and inhibiting KRAS oncogenic signaling. On May 28 2021, the Food and Drug Administration granted accelerated approval to sotorasib(Lumakras®), for adult patients with KRAS G12C-mutated locally advanced or metastatic NSCLC, who have received at least one prior systemic therapy. Sotorasib is the first agent approved for tumors with KRASG12C mutation, Sotorasib’s approval represents a breakthrough milestone towards the treatment on NSCLC.
參考資料:
1. Finn SP, Addeo A, Dafni U, et al: Prognostic Impact of KRAS G12C Mutation in Patients With NSCLC: Results From the European Thoracic Oncology Platform Lungscape Project. J Thorac Oncol 2021; 16:990-1002
2. Veluswamy R, Mack PC, Houldsworth J, et al: KRAS G12C-Mutant Non-Small Cell Lung Cancer: Biology, Developmental Therapeutics, and Molecular Testing. J Mol Diagn 2021; 23:507-520
3. Skoulidis F, Li BT, Dy GK, et al: Sotorasib for Lung Cancers with KRAS p.G12C Mutation. N Engl J Med 2021; 384:2371-2381
4. FDA grants accelerated approval to sotorasib for KRAS G12C mutated NSCLC. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-sotorasib-kras-g12c-mutated-nsclc. Accessed on 12 Aug 2021
5. Merz V, Gaule M, Zecchetto C, et al: Targeting KRAS: The Elephant in the Room of Epithelial Cancers. Front Oncol 2021; 11:638360
6. Indini A, Rijavec E, Ghidini M, et al: Targeting KRAS in Solid Tumors: Current Challenges and Future Opportunities of Novel KRAS Inhibitors. Pharmaceutics 2021; 13:653
7. Reck M, Carbone DP, Garassino M, et al: Targeting KRAS in non-small-cell lung cancer: recent progress and new approaches. Ann Oncol 2021; 32:1101-1110
8. Addeo A, Banna GL,Friedlaender A: KRAS G12C Mutations in NSCLC: From Target to Resistance. Cancers (Basel) 2021; 13:2541
9. Nassar AH, Adib E,Kwiatkowski DJ: Distribution of KRAS (G12C) Somatic Mutations across Race, Sex, and Cancer Type. N Engl J Med 2021; 384:185-187
10. Sidaway P: Sotorasib effective in KRAS-mutant NSCLC. Nat Rev Clin Oncol 2021; 18:470
11. Janne PA, van den Heuvel MM, Barlesi F, et al: Selumetinib Plus Docetaxel Compared With Docetaxel Alone and Progression-Free Survival in Patients With KRAS-Mutant Advanced Non-Small Cell Lung Cancer: The SELECT-1 Randomized Clinical Trial. JAMA 2017; 317:1844-1853
12. Blumenschein GR, Jr., Smit EF, Planchard D, et al: A randomized phase II study of the MEK1/MEK2 inhibitor trametinib (GSK1120212) compared with docetaxel in KRAS-mutant advanced non-small-cell lung cancer (NSCLC)dagger. Ann Oncol 2015; 26:894-901
13. FDA Label of Sotorasib. https://www.accessdata.fda.gov/drugsatfda_docs/label/2021/214665s000lbl.pdf Accessed on 20 Aug 2021
14. Dunnett-Kane V, Nicola P, Blackhall F, et al: Mechanisms of Resistance to KRAS(G12C) Inhibitors. Cancers (Basel) 2021; 13:151
通訊作者:許育瑋/通訊地址:嘉義市忠孝路539號-藥劑科
服務單位:戴德森醫療財團法人嘉義基督教醫院藥劑科/聯絡電話:(O) 05-2765041 ext 2221