阿茲海默症治療新進展
-淺談Aducanumab
陳冠學1、施承典2
1大仁科技大學藥學系
2大仁科技大學藥學系(含碩士班)教授
摘要
根據台灣失智症協會統計,65歲以上長者的失智症盛行率為7.71%,其中阿茲海默症(Alzheimer's disease,AD)約佔失智症病例的半數,病患常表現出語言障礙、情緒不穩與記憶力減退等症狀。對於這個疾病背後的病理機制,目前科學家們雖未找出其全貌,但經過近幾年來的研究已漸漸有了新發現,例如清除β型類澱粉胜肽(β-amyloid peptide)的單株抗體能有效治療AD。由於全球AD患者眾多和市場利益龐大,Alzheon、Biogen、Roche與Pfizer等各製藥公司紛紛投入大量資金研究AD藥物,希望通過免疫療法找到合適的治療方法。近期核准上市的aducanumab(商品名:Aduhelm),以清除患者腦中β型類澱粉胜肽為目標,因良好治療成效而博得大眾關注的免疫療法,是AD治療的一大進步,亦將於本文討論之。
關鍵字: 阿茲海默症、Alzheimer's disease、β型類澱粉胜肽、β-amyloid peptide、Aducanumab
壹、前言
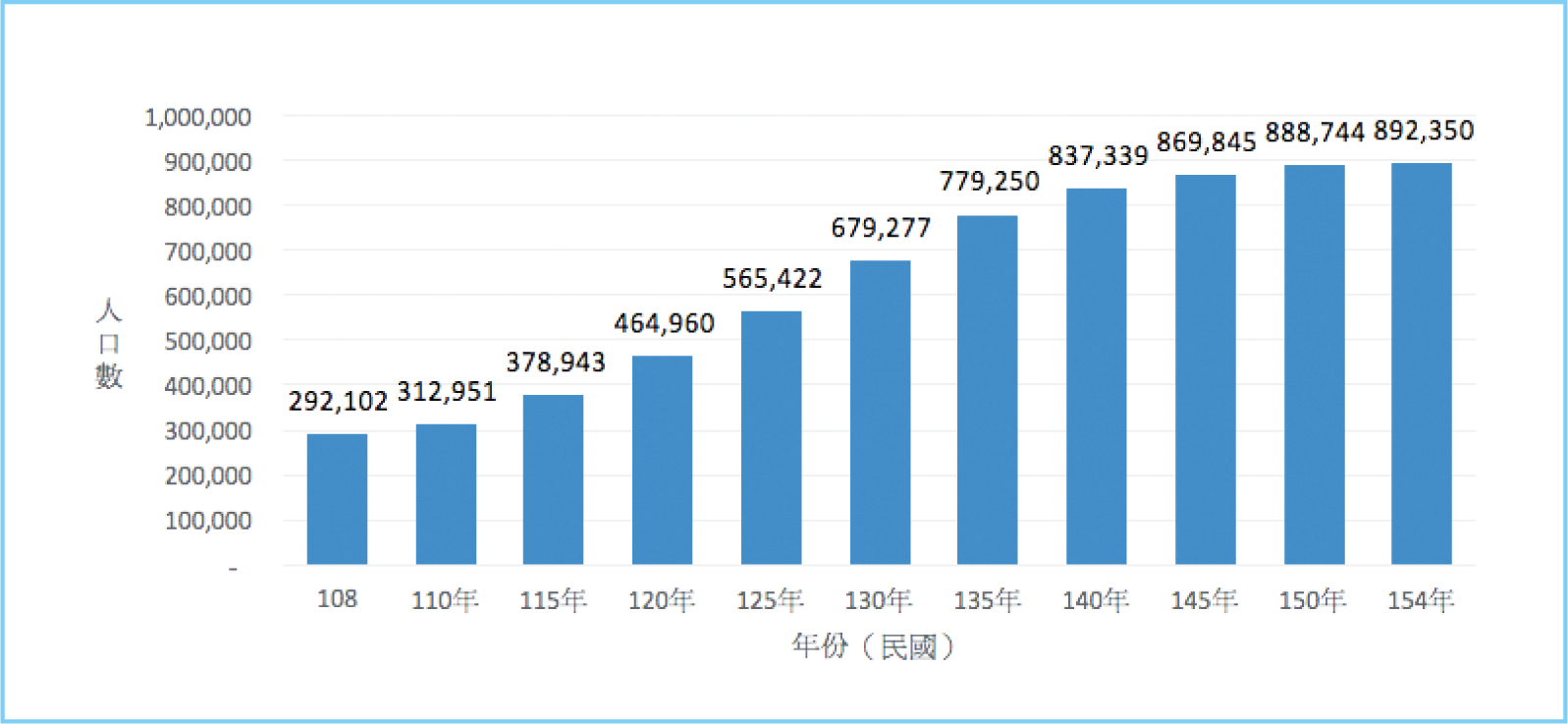
根據台灣失智症協會統計,台灣平均每80人就有1人為失智症患者,至2019年底,台灣失智症人口已超過29萬,且推估2065年時,失智人口將達到約90萬,如圖一所示。失智症粗分為阿茲海默症(Alzheimer's disease,AD)、血管型失智症(vascular dementia)、路易氏體失智症(dementia with Lewy bodies)、額顳葉型失智症(frontotemporal dementia)、巴金森氏症(Parkinson's disease)和混合型失智症(mixed dementia),其中以阿茲海默症為最大宗,佔六~七成1。Aducanumab,是一種治療AD的單株抗體(monoclonal antibody)或稱藥物,藉由免疫療法角度治療AD,美國食品藥物管理局(FDA)已經給予aducanumab優先審查,並於2021年6月核准其上市2,本文將簡述aducanumab及目前免疫療法之使用情形。
圖一 台灣失智症總人口數推估圖 (圖片來源:台灣失智症協會)
貳、病理機制
阿茲海默症(Alzheimer disease,AD)是一種不可逆的腦神經退化性疾病,易發病於60歲後,早期症狀會有喪失短期記憶、無法流暢表達語言與情緒起伏大等認知障礙,中期則會慢慢開始無法自理生活、空間感模糊、說話不連貫與暴躁易怒等精神行為症狀,在晚期時則須完全倚賴他人照顧生活起居,此時病人已失去長期記憶,無法理解他人談話,開始自言自語,病程中也同時伴隨憂鬱、幻想與失眠等症狀3。事實上,AD的病理機轉不完全清楚,但在神經病理學特徵上常呈現β型類澱粉胜肽(β-amyloid peptide,Aβ)斑塊之細胞外聚集,又稱老年斑(senile plaques)和tau蛋白異常磷酸化造成神經纖維纏結(neurofibrillary tangles,NFT)之細胞內聚集。Aβ的產生取決於β-位類澱粉前驅蛋白切割酶 1(β-site APP-cleaving enzyme 1,BACE-1),目前發現人體基因中的GGA3(Golgi-localized gamma ear-containing ARF-binding protein 3)蛋白具有調節BACE-1在神經元軸突運輸的功能4。失去活性的GGA3蛋白會造成BACE-1切割酶在腦中軸突累積產生毒性,使得神經元軸突腫脹壞死4。近期國內研究亦發現腦中TDP-43蛋白囤積與AD病情惡化呈高度相關性5,TDP-43蛋白球狀體具神經毒性,可與Aβ結合交互反應形成Aβ寡聚體(oligomers),其具有類似類澱粉蛋白特性,會加劇腦組織發炎、神經突觸功能喪失與記憶和空間認知能力退化5。
這些病理性標誌物如Aβ和NFT等,與神經細胞退化、神經發炎、微小膠細胞(microglia)活化、血腦障壁(blood-brain barrier)功能異常及認知能力降低呈現正相關性1,3。NFT會影響細胞骨架在神經內構成的訊號傳遞,導致神經元受傷死亡。此外,乙醯膽鹼(acetylcholine)為掌管記憶與認知等功能的神經傳導物質,由於Aβ斑塊過度堆積會減少腦內乙醯膽鹼濃度與其突觸之功能,使乙醯膽鹼無法在腦內運輸,最終使患者的記憶與認知能力下降1,6。
參、抗類澱粉蛋白抗體的發展歷程與現況
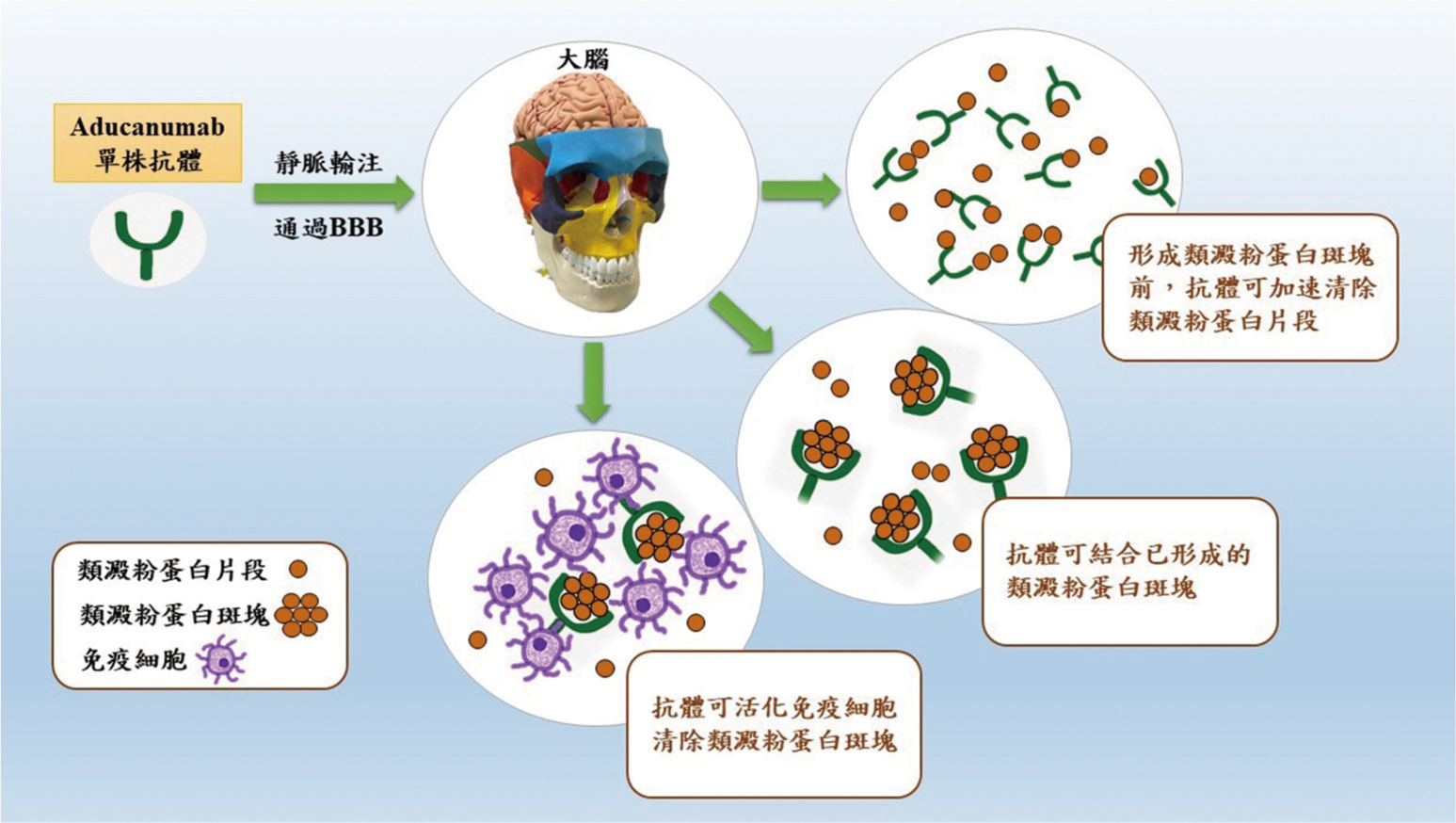
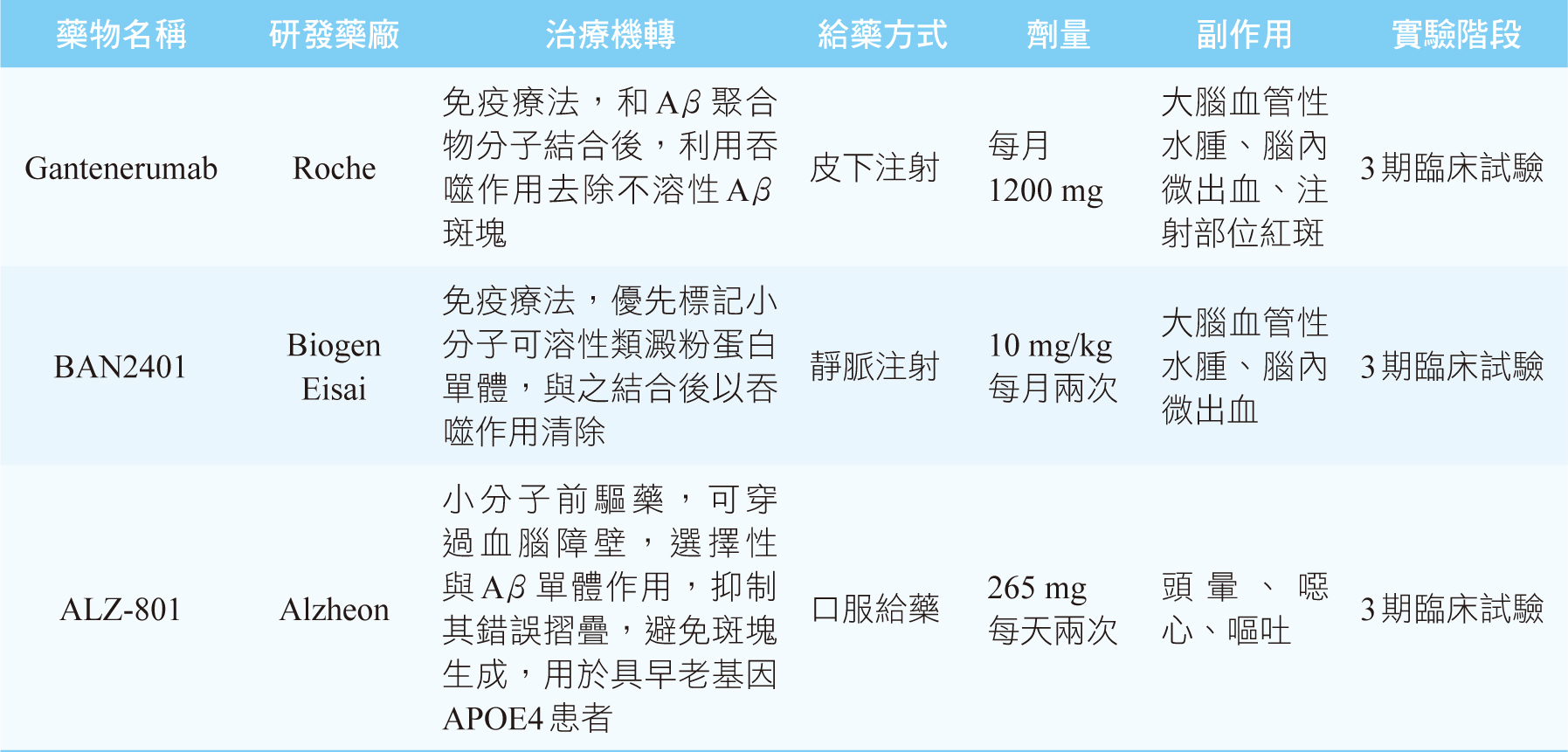
過去常使用乙醯膽鹼脂酶(acetylcholinesterase)抑制劑如 donepezil、rivastigmine和 galantamine,來延緩輕或中度AD6。再者,免疫療法亦可應用於治療AD,目前各藥廠則以Aβ為主要標靶來進行AD藥物研究,其中aducanumab(商品名:Aduhelm)即是第一個核准上市且利用此標靶治療AD的單株抗體,利用抗體來中和Aβ,以達治療AD2,7,如圖二所示。除了aducanumab之外,其他研發中的藥物包括gantenerumab、BAN2401、ALZ-801皆以減少Aβ沉積為治療目標(表一)。Aducanumab、gantenerumab和BAN2401 是屬於對Aβ具有高度親合的單株抗體,兩者結合後以細胞吞噬作用清除斑塊,其中BAN2401對斑塊沉積的選擇性相較其他兩者高出10倍,而小分子口服前驅藥ALZ-801則不與斑塊結合,而是直接抑制類澱粉蛋白生成8。
圖二 Aducanumab作用示意圖
表一 標靶類澱粉蛋白之研發中AD治療藥物7,8
「Aβ是AD的致病因子」假說一直是AD治療研究的主要策略。雖然過去10年,有很多抗類澱粉蛋白抗體(anti-amyloid antibodies)的相關研發,但多數都是不疾而終,常在後期臨床試驗中無法證實可以減緩或停止AD的進程,如美國輝瑞(Pfizer)/嬌生(Johnson & Johnson)藥廠的單株抗體藥物bapineuzumab及美國禮來(Lilly)藥廠的單株抗體藥物solanezumab9。Aducanumab過去俗稱BIIB03710,最初是由瑞士Neurimmune生技公司利用逆向轉譯醫學(reverse translational medicine)技術平台從健康老年受試者和緩慢進展失智症患者的B細胞抗體開發而成,發現這些抗類澱粉蛋白抗體具有強化大腦微小膠細胞功能、保護神經細胞、避免神經發炎惡化與延緩記憶力喪失等功能9,10,隨後並授權給美國百健(Biogen)和日本衛采(Eisai)兩家藥廠取得專利繼續研究9。2019年第III期臨床試驗中發現,aducanumab治療AD效果不彰,一度停止該藥的研發工作,雖遇到瓶頸兩家藥廠仍不放棄地整理該臨床數據,最後發現高劑量 aducanumab 能降低AD患者的方向、語言與記憶力等認知能力退化,達到其主要試驗終點11。最終能於2021年六月獲得美國FDA核准18年來首款的AD新藥,商品名為Aduhelm,可用於輕度與初期AD患者2。目前FDA雖核准該藥上市,但美國百健藥廠仍需進行第四期試驗佐證2。
肆、臨床試驗及安全性
Aducanumab的兩個為期18個月、隨機、雙盲與安慰劑對照的三期試驗,分別命名為EMERGE和ENGAGE,20個國家中總共3285位參與試驗的輕微AD患者(簡易心智量表分數MMSE介於24-30,臨床失智評分CDR-G 0.5,神經心理狀態評估分數RBANS ≤ 85),分為低劑量(3 mg/kg)、高劑量(6或10 mg/kg)、安慰劑對照,以1:1:1隨機分組,主要終點是18個月後受試者的臨床失智CDR-SB評分總和10,12。
在EMERGE試驗(n=1638)第78週的觀察,主要終點臨床失智CDR-SB評分總和,與安慰劑(n=548)相比,低劑量(n=543)的效益百分比為15%(p=0.0901),高劑量(n=547)的效益百分比為22%(p=0.012)7,12,顯示低劑量與高劑量的臨床失智CDR-SB評分效益無顯著差異。然而,在次要終點的輕度認知障礙ADL量表中結果顯示,與安慰劑比較,高劑量的效益百分比40%(p=0.0006)遠大於低劑量的16%(p=0.1515)7,12,且最終分析腦中Aβ斑塊沉積量、腦脊髓液中磷酸化tau蛋白(p-tau)和tau蛋白的正子斷層掃描成像,結果顯示顯著降低腦中Aβ斑塊沉積量和tau蛋白含量,達到治療AD的效果7,12。
在EMERGE和ENGAGE試驗中,試驗人數總共3285位,aducanumab治療皆有約20%受試者出現頭痛症狀,並在類澱粉蛋白相關成像異常(amyloid-related imaging abnormalities,ARIA)部分,35%受試者出現類澱粉蛋白相關成像異常伴隨腦水腫(ARIA-edema,ARIA-E),18%出現ARIA伴隨腦內微出血(ARIA-hemorrhage)及血鐵素沉積(ARIA-hemosiderin,ARIA-H)。帶有APOE4基因型的受試者發生ARIA-E的機率較高佔42%,其伴隨腦水腫和頭痛是最常出現的副作用7,12。一般來說,其他ARIA相關症狀包含頭暈、噁心、嘔吐與視力障礙,且ARIA-E症狀在4~16週內緩解,大多數患者的ARIA症狀並不影響試驗進行12。目前不清楚懷孕或哺乳階段的用藥安全性,因此接受aducanumab治療前應將所有醫療狀況告知其醫師。
伍、藥物動力學
以Aβ為標靶的藥物除了對Aβ寡聚體具有選擇性,亦能穿過血腦障壁,並在持續給藥的狀態下,在腦中維持濃度達到療效 7。從2961名AD病患接受每4週單劑量或多劑量aducanumab(10 mg/kg)靜脈輸注,每次輸注時間約1小時,連續16週的重複給藥後發現,病患能達到其穩定濃度,且其全身蓄積可達1.7 倍13。隨劑量(1-10 mg/kg)越高,aducanumab的最高血中藥物濃度(peak concentration,Cmax)與曲線下面積(area under curve,AUC)則越高,表示藥物吸收速率越快,進入人體的藥量越多,且人體對於藥物的清除率較低。穩態分佈容積為 9.63 L,其代謝與內源性IgG相似,可分解代謝成小胜肽和胺基酸,aducanumab的清除率為 0.0159 L/hr,且血漿半衰期為24.8天13。此外,受試者的年齡、腦中的Aβ量或是否具有APOE4基因型等因素,皆可能延遲aducanumab的臨床藥效時間7,12,13。Aducanumab對於腎或肝功能受損患者中的藥物動力學並未進行研究評估,推測不會經由肝臟酵素代謝或腎臟排出13。
陸、免疫療法
2018年9月衛福部公告《特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法》,簡稱特管辦法,才放寬了國內免疫細胞療法於醫療應用上的規範,共開放6種自體免疫細胞應用於癌症治療上,例如副作用較少的殺傷細胞(cytokine-induced killer cells)療法、自然殺手細胞(natural killer cell)療法、樹突細胞(dendritic cell)療法等,但因副作用及安全性顧慮,台灣尚未開放嵌合抗原受體T細胞(chimeric antigen receptor T cell,CAR-T)療法和腫瘤內浸潤型淋巴細胞(tumor-infiltrating lymphocytes)療法14。在癌症免疫療法中,除了CAR-T等治療之外,還有一種免疫檢查點抑制劑(immune checkpoint inhibitor)療法,都是以增強免疫細胞對抗腫瘤的功能14。然而,aducanumab是利用對於Aβ具有專一性的單株抗體,與aducanumab結合後,引發專一性免疫反應來吞噬清除Aβ,達到治療早期輕度AD患者,這與其他癌症免疫療法或傳統化學療法之作用原理、適應症及副作用等方面並不相同,如表二所示。
表二 免疫療法與化學療法之比較7,13-15
柒、結語
Aducanumab是FDA核准上市的第一款抗類澱粉蛋白的單株抗體,亦是一種新型的輕度與初期AD治療藥物,減緩病患認知及功能衰退。Aducanumab建議的有效劑量為10 mg/kg,治療期間需關注病患可能出現的副作用,如大腦輕微水腫、發炎或微出血反應等,每三個月須接受腦部核磁共振造影(MRI)追蹤,以密切觀察施打藥物後腦部是否產生變化、療效及安全性。目前除美國FDA之外,其他國家尚未核准此藥,國內進度停留在小規模臨床試驗階段,臺北榮民總醫院於2020年8月開始招募受試者,評估此藥長期使用之安全性與耐受性,臺北長庚紀念醫院及林口長庚紀念醫院也在2020年11月進行該試驗受試者之招募,預計執行至2023年底,若未來美國藥廠百健(Biogen)之第四期試驗數據樂觀,或許各國將陸續開放此藥的應用,相信必定是AD患者的一大福音。
New Progress with the treatments of Alzheimer's disease – Aducanumab
Guan-Syue Chen1, Cheng-Dean Shih2
1Department of Pharmacy, Tajen University
2Department of Pharmacy and Master Program, Tajen University
Abstract
According to statistics from the Taiwan Alzheimer Disease Association, prevalence rate of dementia among the elderly over 65 is 7.71%, of which Alzheimer's disease (AD) accounts for about half of the cases of dementia. The patients' often symptoms such as language disability, emotional instability, and memory decline. Although scientists have not fully understood the pathological mechanism of AD, the research in recent years has gradually produced new discoveries, such as the monoclonal antibodies that clear β-amyloid peptides can effectively treat AD. Due to numerous AD patients worldwide and the huge market benefits of treating AD, pharmaceutical companies such as Alzheon, Biogen, Roche, and Pfizer have invested a lot of funding in researching AD drugs, hoping to find a suitable treatment method through immunotherapy. Aducanumab (Aduhelm®) has been on the market recently, its functional target is removing β-amyloid peptide in the brain of AD patients. Besides, immunotherapy, which has attracted public attention because good therapeutic effects, is a great advancement in treatment of AD, will also be discussed in this article.
參考資料:
1. Raz L, Knoefel J, Bhaskar K. The neuropathology and cerebrovascular mechanisms of dementia. J Cereb Blood Flow Metab. 2016; 36(1):172-186.
2. U.S. Food & Drug Administration. Aducanumab (marketed as Aduhelm) information. 2021. https://www.fda.gov/drugs/postmarket-drug-safety-information-patients-and-providers/aducanumab-marketed-aduhelm-information
3. Alzheimer's association. Stages of Alzheimer's. 2021. https://www.alz.org/alzheimers-dementia/stages
4. Lomoio S, Willen R, Kim W, et al. Gga3 deletion and a GGA3 rare variant associated with late onset Alzheimer's disease trigger BACE1 accumulation in axonal swellings. Sci Transl Med. 2020; 12(570):eaba1871. doi: 10.1126/scitranslmed.aba1871.
5. Shih YH, Tu LH, Chang TY, et al. TDP-43 interacts with amyloid-β, inhibits fibrillization, and worsens pathology in a model of Alzheimer's disease. Nat Commun. 2020; 11(1):5950. doi: 10.1038/s41467-020-19786-7.
6. Akıncıoğlu H, Gülçin İ. Potent acetylcholinesterase inhibitors: potential drugs for Alzheimer's disease. Mini Rev Med Chem. 2020; 20(8):703-715.
7. Tolar M, Abushakra S, Hey JA, et al. Aducanumab, gantenerumab, BAN2401, and ALZ-801-the first wave of amyloid-targeting drugs for Alzheimer's disease with potential for near term approval. Alzheimers Res Ther. 2020; 12(1):95. doi: 10.1186/s13195-020-00663-w.
8. Hey JA, Yu JY, Versavel M, et al. Clinical pharmacokinetics and safety of ALZ-801, a novel prodrug of tramiprosate in development for the treatment of Alzheimer's disease. Clin Pharmacokinet. 2018; 57(3):315-333.
9. 謝奉勳、徐祖安:解碼消失的記憶:治療阿茲海默症的新主張。國家衛生研究院電子報 2019;776。https://enews.nhri.org.tw/health/1088/
10. Budd Haeberlein S, O'Gorman J, Chiao P, et al. Clinical development of aducanumab, an anti-Aβ Human monoclonal antibody being investigated for the treatment of early Alzheimer's disease. J Prev Alzheimers Dis. 2017; 4(4):255-263.
11. Servick K. Skepticism persists about revived Alzheimer's drug after conference presentation. Science News. 2019. https://www.sciencemag.org/news/2019/12/skepticism-persists-about-revived-alzheimer-s-drug-after-conference-presentation
12. Budd-Haeberlein S, Von Hein C, Tian Y, et al. EMERGE and ENGAGE topline results: two phase 3 studies to evaluate aducanumab in patients with early Alzheimer's disease. San Diego, CA: 12th Clinical Trials on Alzheimer's Disease Conference; 2019.
13. U.S. Food & Drug Administration. Highlights of prescription information-ADUHELM™. 2021. https://www.accessdata.fda.gov/drugsatfda_docs/label/2021/761178s000lbl.pdf
14. 李冠德:癌症自體免疫細胞治療跟化療、放療等之差異。衛生福利部 細胞治療技術資訊專區 2020。https://celltherapy.mohw.gov.tw/education_page.htm?id=67
15. Wang H, Kaur G, Sankin AI, et al. Immune checkpoint blockade and CAR-T cell therapy in hematologic malignancies. J Hematol Oncol. 2019; 12(1): 59. doi: 10.1186/s13045-019-0746-1.
通訊作者:施承典/通訊地址:屏東縣鹽埔鄉維新路20號
服務單位:大仁科技大學藥學系/聯絡電話:(O) 08-7624002 ext 2931