伴隨式診斷-用藥前的檢測
黃素慧、陳琦華、陳玉瑩
長庚醫療財團法人行政中心藥事管理部
摘要
伴隨式診斷為精準醫療的一環,為全球近年來主要的開發項目,根據美國食品藥物管理局定義,伴隨式診斷為醫療器材的一種,其目的是協助醫師選擇正確的藥物,免於無效的治療及不必要的藥品副作用。目前已上市的伴隨式診斷絕大多數都與癌症相關,其檢測方式各有不同,內文整理常見的檢測方式做為參考。
關鍵字: 伴隨式診斷、精準醫療、生物標記
壹、前言
根據美國統計,前10大暢銷藥品中只有4%~25%是屬於有效的治療,雖然台灣沒有相關的統計,故可想而知健保所給付的這些高價藥品中,有一大部分是無效的,被戲稱為不精準治療(imprecision medicine)。精準醫療(precision medicine)等同於精準用藥、又被稱作個人化醫療(personalized medicine),是近年來熱門的話題,也是全球醫療產業積極投入的方向。精準醫療考慮個人基因、環境及生活習慣的差異,量身訂制疾病預防及治療對策,希望能夠達到在對的時間,在對的人上進行對的治療,達到最好的療效、最小的副作用1。其中,用藥前進行的檢測-伴隨式診斷(companion diagnostics,CDx),即為精準醫療的一環,它的發展與精準醫療的進展息息相關。
貳、 檢測性生物標記(predictive biomarker)之目的
在早期的藥物治療是從疾病著手再給予特定藥物,但並非每個病人都能達到相同的治療效果,甚至還會產生副作用,而學理上卻無法說明這樣的差異2。隨著分子醫學的進步,對於疾病發生機轉更為了解,過去這幾年看到透過藥物診斷共同開發(drug-diagnostic co-development)模型搭配著檢測性生物標記分析進行開發的新藥越來越多2。
所謂的生物標記是正常生理或是疾病狀態時,在血液、其他體液或組織中發現的生物分子,可用於了解身體對疾病治療的效果3。不少的癌症藥品透過檢測性生物標記分析在開發的過程中發揮重要的角色,根據塔夫茨藥物開發研究中心近期針對個人化醫療進行的調查,顯示在臨床試驗後期,接受調查的製藥公司約有60%癌症藥物產品線係仰賴於生物標記數據進行評估2。像這樣與特定藥物相關的檢測性生物標記分析又可稱為伴隨式診斷2。
參、伴隨式診斷之誕生與臨床用途
根據美國食品藥物管理局定義,伴隨式診斷為醫療器材的一種,通常是體外診斷器材,可提供患者使用特定治療藥品或生物製劑的相關資訊,以確保用藥的安全和效果4。上述資訊將能協助醫療照護者進行治療決策,評估利弊。而最早應用藥物診斷共同開發模型開發出伴隨式診斷為Herceptin2。Herceptin(trastuzumab)為DNA(deoxyribonucleic acid)重組人源單株抗體,用於治療乳癌,其作用機轉為藉由與人類上皮因子第二型接受器(human epidermal growth factor receptor 2,HER2)的專一接合,阻斷因HER2過度表現所產生的細胞內訊息傳遞及利用引發抗體依賴性細胞毒性(antibody dependent cell-mediated cytotoxicity),進而阻止癌細胞的過度增生及毒殺癌細胞5。然而,並非所有乳癌病人的HER2都會過度表現,僅約1/4的病人族群有此現象,因此原開發Herceptin的藥廠Genetech(現為Roche)與Dako公司聯合開發可準確檢測HER2表現量的伴隨式診斷,以評估病人是否受益於藥物治療,免於不必要的藥品副作用及降低不同實驗室間的檢測差異5。而美國食品藥物管理局則在1998年同時核准單株抗體Herceptin及Dako公司生產的HercepTest,正式宣告治療診斷(theranostics)時代來臨2,5。
利用伴隨式診斷4能夠找出最有可能受益於特定治療產品之病患,亦可得知因進行治療而可能發生嚴重副作用風險之病患;故能夠透過治療之反應之監測而調整治療方式,進而改善安全性或治療效果。
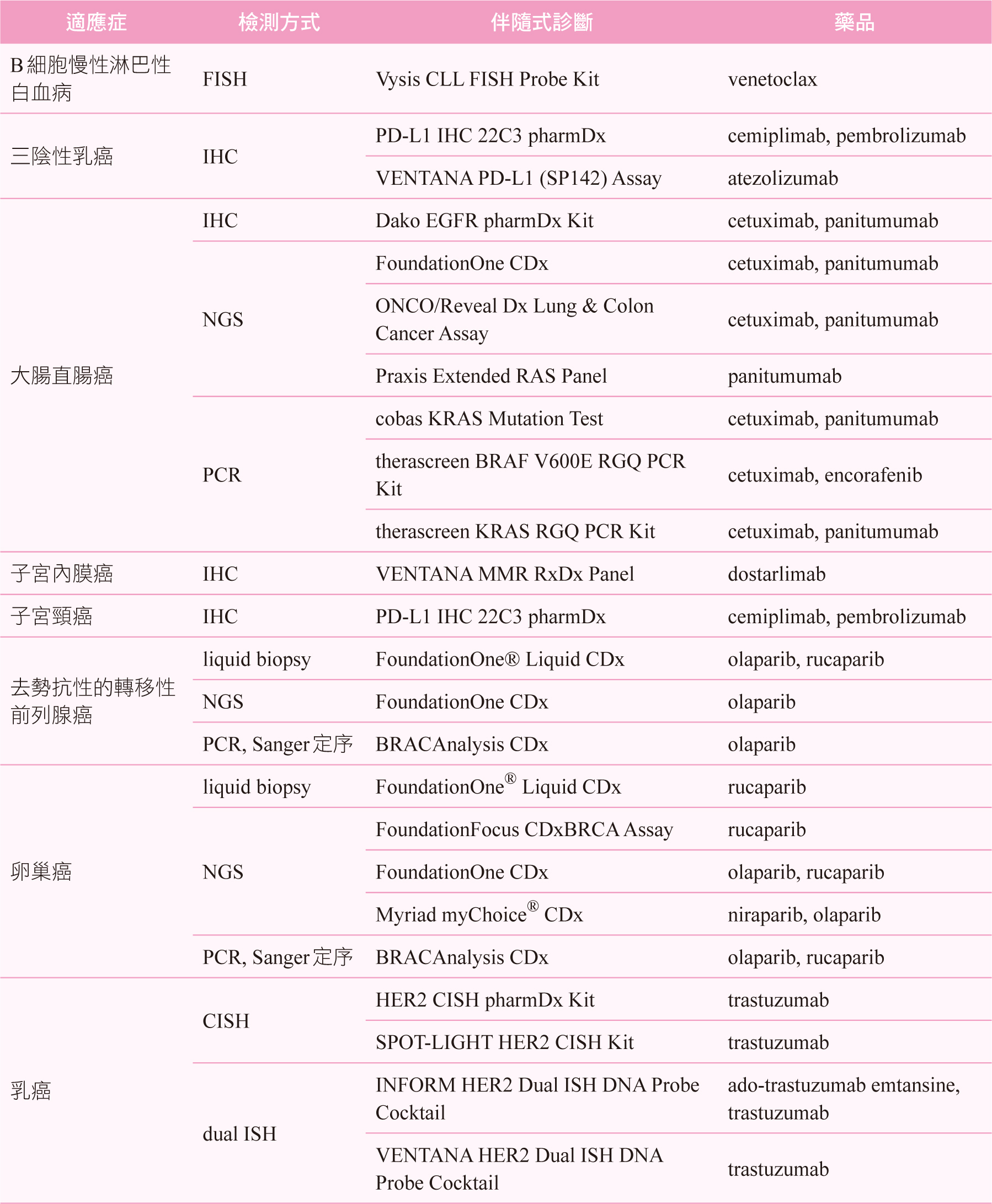
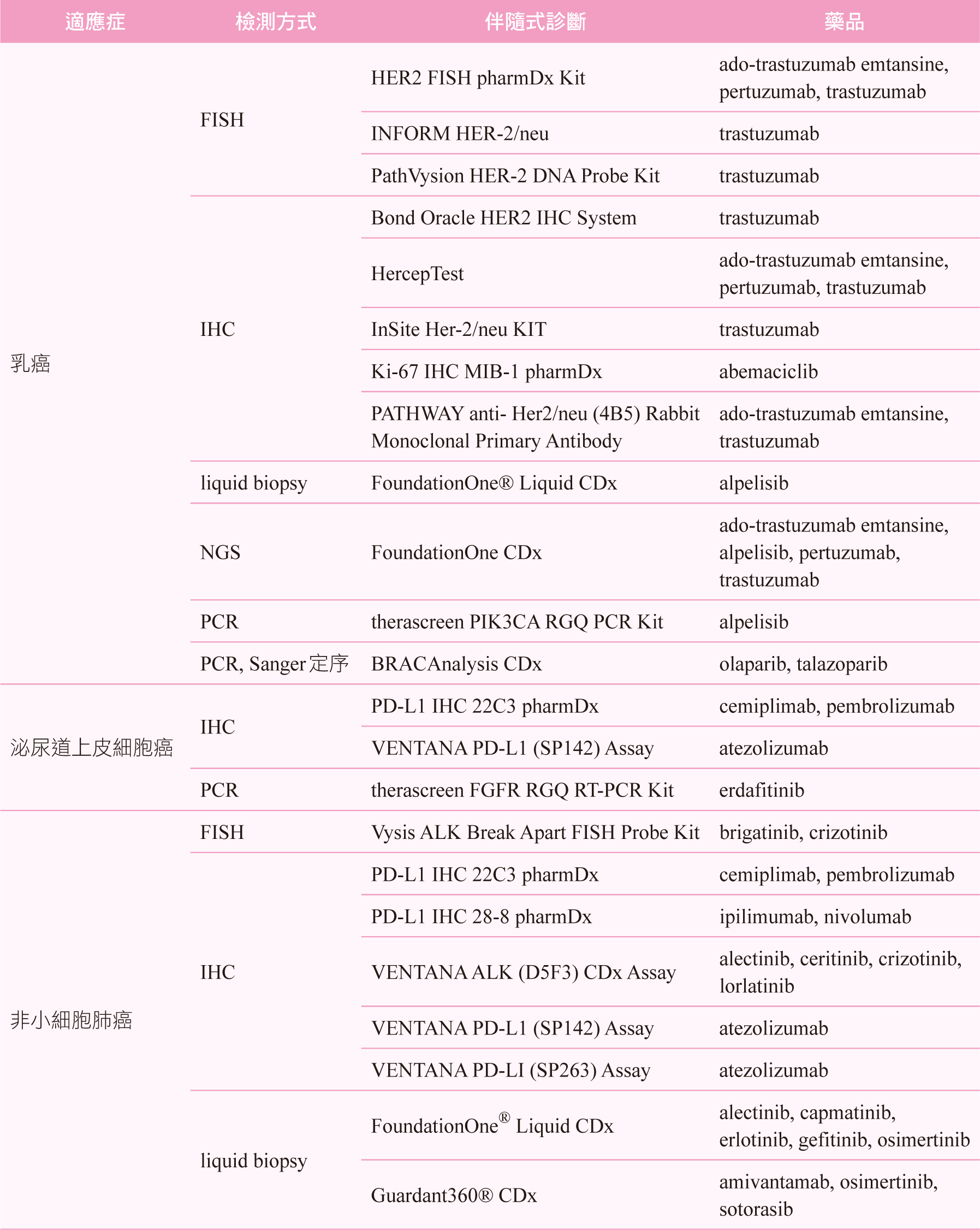
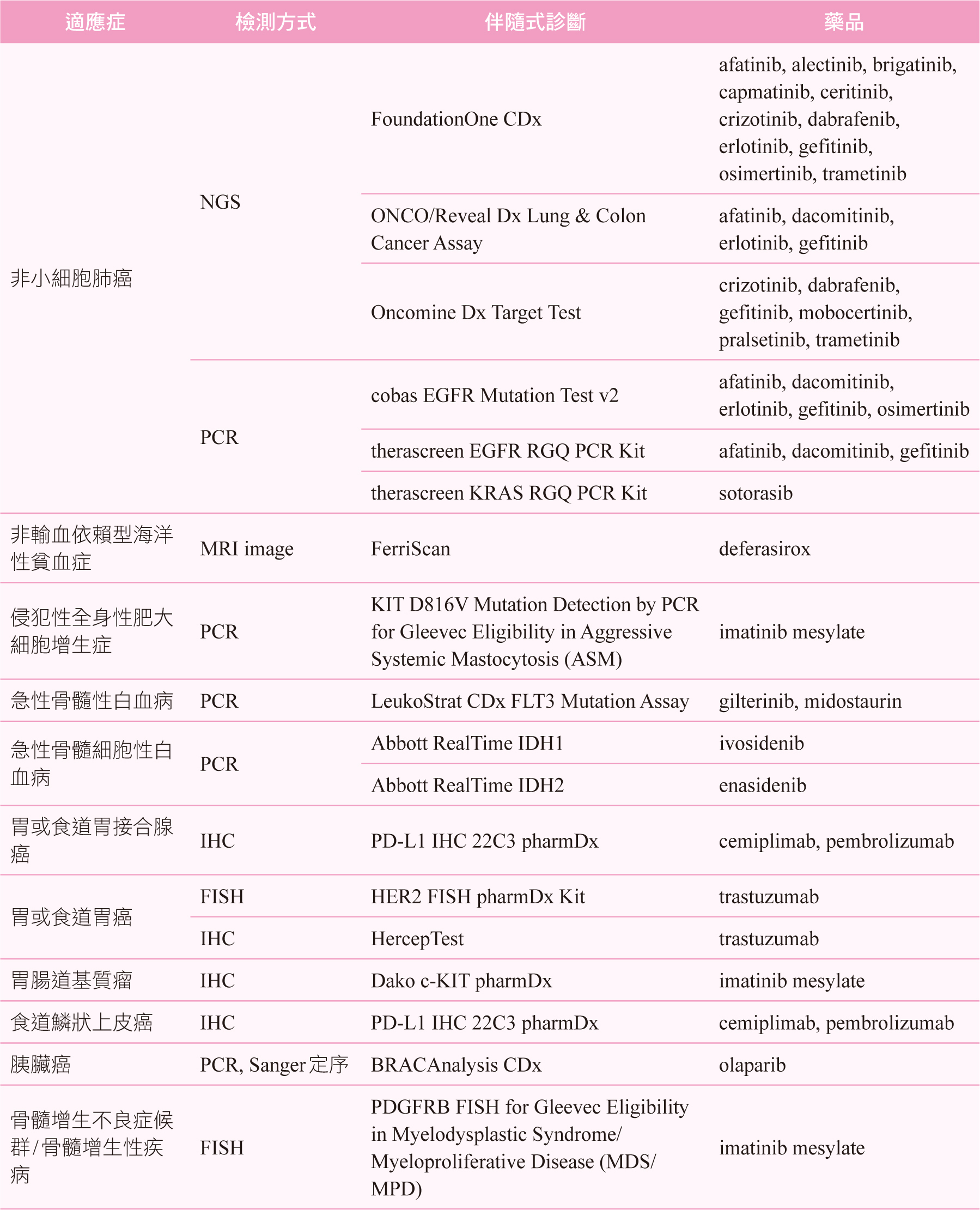
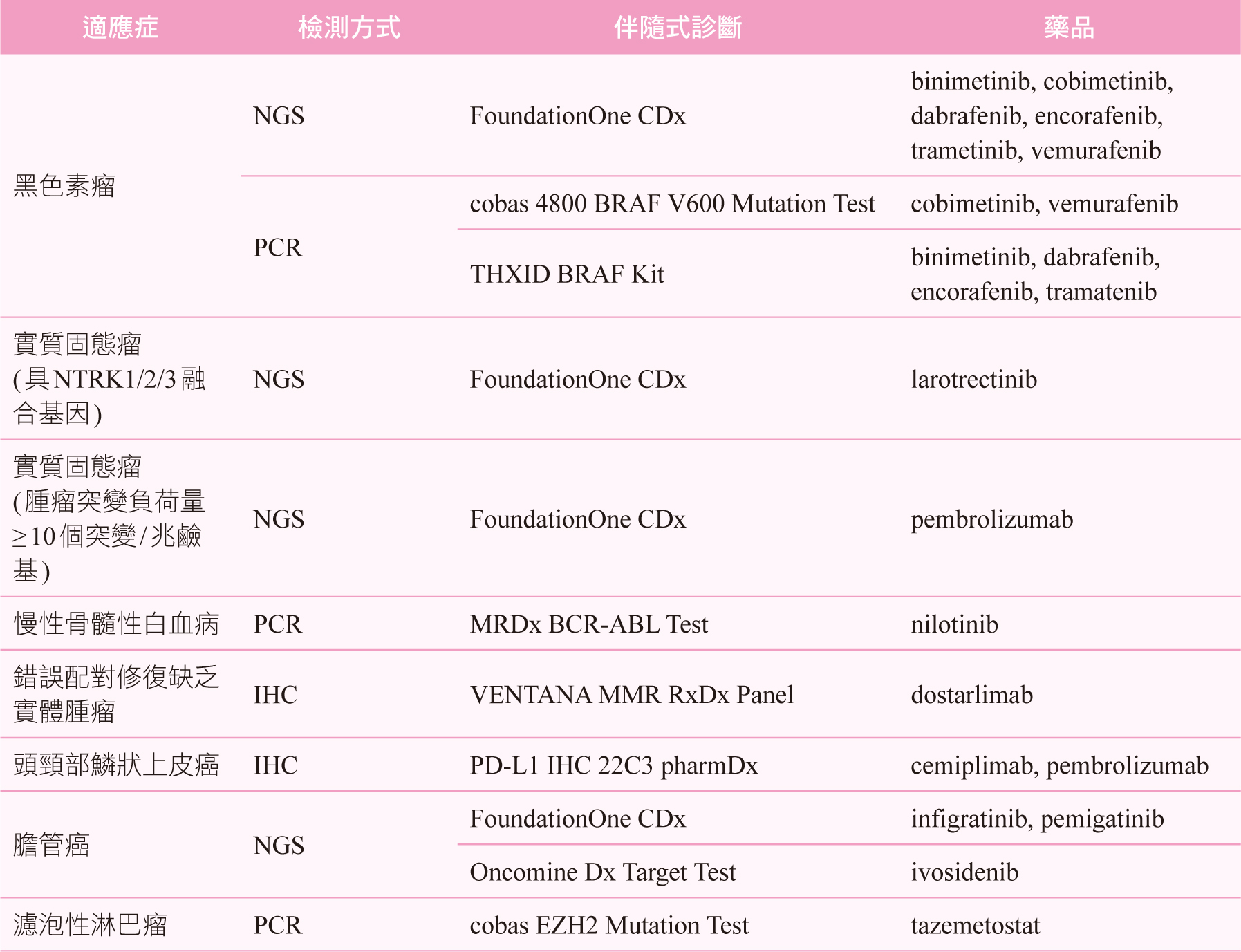
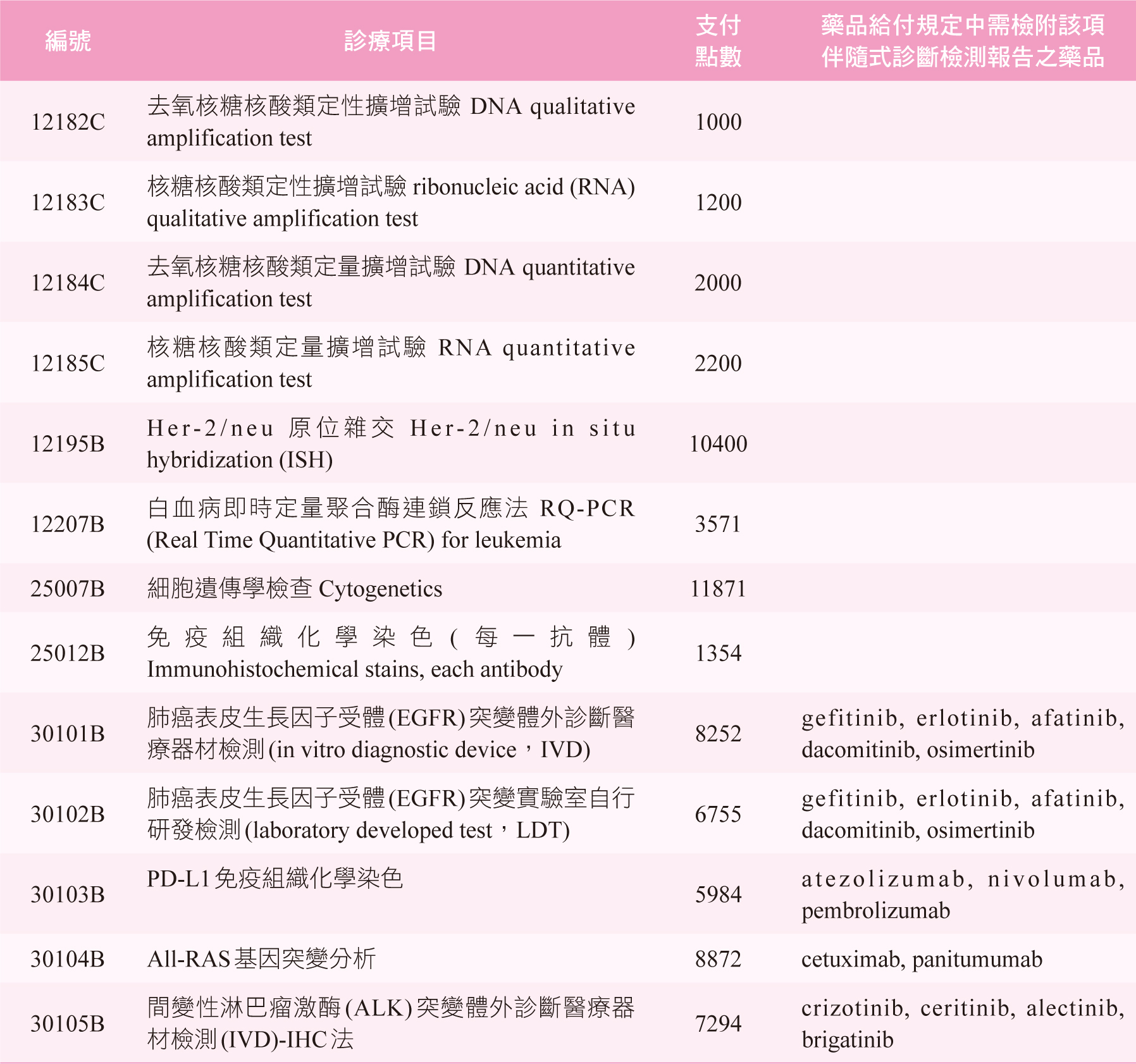
白話來說,伴隨式診斷的檢驗目的是協助醫師選擇正確的藥物。在各國個人化醫學政策帶動之下,伴隨式診斷已為近來熱門開發項目,特別又以個人化的癌症治療為重點,依美國食品藥物管理局已核准伴隨式診斷清單6 (整理如表一),絕大多數為癌症相關,清單中共計有四十八項伴隨式診斷,可作為三十種癌症及五十二種藥品的治療參考依據。而目前國內共十三項伴隨式診斷納入健保給付7,整理相關資料如表二,其中五項更被納入全民健康保險藥物給付項目及支付標準8,包含表皮生長因子受體(epidermal growth factor receptor,EGFR)、第一類程序性細胞死亡配體(programmed cell death ligand 1,PD-L1)、ALL-RAS(rat sarcoma)和間變性淋巴瘤激酶(Anaplastic lymphoma kinase,ALK)等生物標記,使用相關藥物需檢附對應的檢測結果報告才可獲得藥品給付。
表一 美國食品藥物管理局已核准伴隨式診斷清單6
表二 納入健保給付的伴隨式診斷7,8
肆、常見檢測方式
如前所述,美國食品藥物管理局批准第一個伴隨式診斷為HercepTest,其使用的檢測方式為免疫組織化學染色(immunohistochemistry,IHC)2,後續核准的伴隨式診斷則開始導入其他檢測方法。以下就常見的檢測方法進行介紹。
一、 免疫組織化學染色法9
應用免疫反應抗原(蛋白質)和抗體間的專一結合性,確認目標抗原存在以及其位置,或進行半定量測定。常見檢測標的有ALK、EGFR、HER2及PD-L1等基因。
二、 聚合酶連鎖反應(polymerase chain reaction,PCR)10
利用DNA雙股複製的原理,使用DNA聚合酶於體外短時間大量複製特定DNA片段。其中以即時聚合酶鏈鎖反應(real-time polymerase chain reaction,Real-time PCR),又稱定量即時聚合酶鏈鎖反應(quantitative real time polymerase chain reaction,Q-PCR)及微滴式數字PCR(droplet digital PCR)為常見的PCR檢測方式。此檢驗方法常見的檢測標的為BCR-ABL(breakpoint cluster region-abelson)、BRAF(v-raf murine sarcoma viral oncogene homolog B1)、EGFR、KRAS(Kirsten rat sarcoma viral oncogene homolog)等基因。
三、 核酸雜交技術(nucleic acid hybridization)11
透過核苷酸分子間的特異配對產生氫鍵而結合(也就是A::T與G::C)的方式來偵測核酸的表現。常見檢測標的有ALK、HER-2/neu、KRAS等基因。原位雜交技術(in situ hybridization,ISH)依據不同的呈色方式及偵測方法,可分為:
(一) 螢光原位雜交法(fluorescent in situ hybridization,FISH)
透過螢光顯微鏡觀察結果,可檢測特定基因複製倍數的增加(amplification)、基因的缺損(deletion)、與基因的轉位(translocation)。
(二) 顯色原位雜交法(chromogenic in situ hybridization,CISH)
與FISH的基本原理相似,為呈色方式不同,結果可直接在一般光學顯微鏡下觀察,其染色片可以長期保存。
(三) 雙色原位雜交法(dual ISH)
同時利用兩種不同的呈色方式,可在同一視野下同時觀察到兩段核酸表現的情形。
四、 基因定序12
透過解析各片段的基因序列,再運用資訊科技技術協助進行片段資訊整合,達成整個基因組定序的目標。
(一) 第一代定序
雙脫氧鏈終止法(又稱為Sanger定序法)與化學降解法以及其衍生的DNA定序方法,統稱為第一代定序技術,其通量低、成本高且耗時,無法進行大規模的應用。
(二) 次世代定序(next generation sequencing,NGS)
又稱為第二代定序或基因高通量分析,為建構在第一代定序方法基礎上所開發的技術,共分為四步驟:樣本庫製備(library preparation)、樣本庫擴增(library amplification)、定序反應(sequencing reaction),最後才是數據分析(data analysis),透過將定序後的大量資訊與現有的資料庫進行比對(mapping)及計數(counting)分析,設法還原原始待測基因片段序列。與第一代定序技術相比,可同時執行大量的核酸定序,降低單一鹼基定序所需的成本、高通量及快速,使基因定序不在受限於基因大小或多寡,並透過臨床資料庫的驗證,可一次同時找出疾病易感基因和相關變異,作為疾病罹患風險的判斷或提供後續治療所需的相關資訊。美國FDA已陸續核准以下六項應用NGS技術於癌症治療之伴隨式診斷:FoundationFocus CDxBRCA Assay、FoundationOne CDx、Myriad myChoice® CDx、ONCO/Reveal Dx Lung & Colon Cancer Assay、Oncomine Dx Target Test、Praxis Extended RAS Panel。衛生福利部中央健康保險署曾於2021年初邀請國內專家招開專家會議,針對NGS檢測納入健保給付事宜提出建言,後續NGS檢測納入健保給付一事應指日可待。
五、 液態切片(liquid biopsy)13
傳統組織活體檢查(tissue biopsy)為侵入性採樣,結果可能受到患者病況、腫瘤多樣性(heterogeneity)不確定因素的影響,需進行多次取樣。液態切片則是利用低侵襲性取樣的生物體液檢體(如血液、尿液、唾液、肋膜液等)為樣本,經過離心處理分離檢體中與腫瘤相關的:循環腫瘤去氧核醣核酸 (circulating tumor DNA,ctDNA)、循環腫瘤細胞 (circulating tumor cell,CTC)、腫瘤化血小板(tumor educated platelets,TEP)及胞外泌體(exosomes),以偵測癌細胞的存在並獲取相關基因資訊,及時了解腫瘤細胞的基因突變演化、監測藥物治療效果及偵測抗藥性基因突變的產生。又癌細胞的轉移係透過體內循環系統的幫忙,而液態切片的特性可及早發現新的病灶及監控癌症的進程。相較於傳統切片,其檢體收集方便,採樣風險性較低,幾乎不需要痊癒時間,大幅降低患者身體負擔,提高檢測意願,並且更能系統性、即時性地提供基因資訊。目前美國FDA核准應用液態切片技術之伴隨式診斷為FoundationOne® Liquid CDx、Guardant360® CDx。
伍、結語
伴隨式診斷即為搭配特定藥物治療的檢驗項目,藉由分析病人身上特定生物標記,預測特定類別藥物對於該病患是否有效與安全,用於輔助醫師做出治療決策的檢驗方法,提供醫師選擇治療藥物的參考依據。健保對於伴隨式診斷之給付,其合法性與合理性是其重要考量,其次才是成本和給付效益,目前台灣已有多項伴隨式診斷納入給付。近年廣為討論的次世代定序(NGS)可一次同時找出多個疾病易感或變異基因,預估將成為日後伴隨式診斷發展的一大重點。
Companion Diagnostics-The Test before Medication
Su-Hui Huang, Chi-Hua Chen, Yuk-Ying Chan
Department of Pharmaceutical Administration,
Administration Center, Chang Gung Medical
Foundation
Abstract
Companion diagnostics are the key of precision medicine. In recent years, Companion diagnostics are the major development projects in the world. According to the definition of the US Food and Drug Administration, a companion diagnostic is a medical device, which provides information that is essential for the safe and effective use of a corresponding drug or biological product. The test helps a health care professional determine whether a particular therapeutic product’s benefits to patients will outweigh any potential serious side effects or risks. The most of companion diagnostics on the market are related to cancer therapy, but their detection methods are different. This article will introduce these detection methods briefly.
參考資料:
1. FDA. Precision Medicine. Updated 27/09/2018. Accessed 3/17, 2022. https://www.fda.gov/medical-devices/in-vitro-diagnostics/precision-medicine
2. Jørgensen JT. Companion and Complementary Diagnostics: Clinical and Regulatory Perspectives. Trends Cancer. 12 2016;2(12):706-712. doi:10.1016/j.trecan.2016.10.013
3. NCI. biomarker. National Cancer Institute at the National Institutes of Health. Accessed 9/11, 2021. https://www.cancer.gov/publications/dictionaries/cancer-terms/def/biomarker
4. FDA. Companion Diagnostics. FDA. Updated 12/07/2018. Accessed 3/17, 2022. https://www.fda.gov/medical-devices/in-vitro-diagnostics/companion-diagnostics
5. 曾子玲:伴同式體外診斷醫療器材之法規管理現況及趨勢。當代醫藥法規月刊 2018;95:12-23。
6. FDA. List of Cleared or Approved Companion
Diagnostic Devices (In Vitro and Imaging Tools).
FDA. Updated 11/30/2021. Accessed 2/25, 2022.
https://www.fda.gov/medical-devices/in-vitro-diagnostics/list-cleared-or-approved-companion-diagnostic-devices-in-vitro-and-imaging-tools
7. 何小鳳、連恆榮:藥品與伴隨式檢測同步列入健保給付,落實精準用藥。李伯璋,走向雲端病醫雙贏 健保改革日記2.0,台北,行政院衛生署中央健康保險局,2021;404-406。
8. 衛生福利部中央健康保險署:全民健康保險藥物給付項目及支付標準。2022。
9. 曾慶誠:免疫組織化學染色發展的歷史回顧。生物醫學 2012;5(2):105-111。
10. VanGuilder HD, Vrana KE, Freeman WM. Twenty-five years of quantitative PCR for gene expression analysis. Biotechniques. Apr 2008;44(5):619-26. doi:10.2144/000112776
11. 廖儷容、許志怡。HER2/neu之原位雜交檢驗。生物醫學 2011;4(3):148-153。
12. 李曜珊:簡介次世代定序技術及美國的法規管理。當代醫藥法規月刊 2017;83:1-12。
13. 楊福雄、湯旭南:肺癌的液態活檢。內科學誌 2017;28(6):334-343。 doi:10.6314/jimt.2017.28(6).03
通訊作者:黃素慧/通訊地址:桃園市龜山區復興街5號 行政中心藥事管理部
服務單位:長庚醫療財團法人行政中心藥事管理部/聯絡電話:(O) 03-3281200 ext 6785