腸泌素作用劑於減重治療之新進展
顏怡婷、張筱琳、吳求珍
衛生福利部臺北醫院藥劑科
摘要
肥胖盛行率逐年攀升且與慢性病的發生息息相關,是全球高度關注的健康議題,世界各國將肥胖視為疾病已逐漸成為共識。肥胖涵蓋複雜病理生理學,從過去的藥物機轉得知,大多減重藥物發展只經由眾多減重生理機制中的單一路徑,因此在減重成效上較為受限。人體中腸泌素(incretin)賀爾蒙最主要的是昇糖素類似胜肽(Glucagon-like
peptide 1, GLP-1)和胃抑素(Glucose-dependent
insulinotropic polypeptide, GIP),而新一代的腸泌素作用劑(incretin
agonist)由此演變而來。目前腸泌素作用劑的減重作用機轉尚未明確,可能與其透過降低食慾、提升飽足感及增加解脂活性與穩定能量平衡調控有關。常見副作用多為胃腸不適,症狀從輕度至中度且為暫時性,且其使用上的便利性讓使用者更加能接受。腸泌素作用劑對於肥胖、體重過重且合併共病症風險者,新增了另一種治療選擇,且另外再搭配飲食控制與運動介入能讓減重之路更增添信心。
關鍵字: 腸泌素、肥胖、過重、incretin、obesity、GLP-1/GIP
壹、 前言
醫學發展至今,減重是個不分男女皆高度關注的議題,除了與外型體態相關,更與身心健康發展或慢性疾病的發生有著密切關聯。過重或肥胖的標準,根據世界衛生組織
(WHO)與衛生福利部國民健康署發行的成人肥胖防治實證指引不同處,主因是對照相同身體質量指數
(Body Mass Index, BMI)在亞洲族群與高加索人
(Caucasian),亞洲族群的身體脂肪含量較高,但肥胖盛行率反而較低,故國民健康署建議制定BMI分級更加嚴謹,因此以BMI≧24kg/m2為過重,≧27kg/m2為肥胖。減重的方式應以病人的BMI體位分級與疾病危險因子為出發點,來考慮進行的治療方式,包含外科手術、藥物治療或非藥物介入(飲食控制、運動習慣、生活模式改變)1。
體重過重的原因繁多,少吃多運動是最健康且長久的法則,但是調整生活習慣對於現代人而言知易行難,常因無法持之以恆而導致復胖或是體重上升。醫療方式介入,目的除了使體重下降且能持續控制,長期能改善健康與生活狀況,並降低慢性疾病的發生風險,使用任何方式,不管在短期或長程治療,都期望能產生最少的副作用。外科手術與藥物治療為臨床上常使用的減重治療方式,可單獨執行或合併治療。選擇外科手術,臨床上建議個案為BMI≧35
kg/m2,或BMI≧30 kg/m2且合併有高危險併發症並有減重門診治療佐證等條件,經術前完善評估後方可執行,術後的傷口照護及可能造成長期營養吸收不良為其隱憂。建議可優先使用藥物治療,根據病人的合併症、禁忌症、過敏史與藥物不良反應進行考量1。療效評估的時機為使用藥物治療後的第一個月能達到體重下降2kg,三到六個月後能達到體重下降5%。當體重下降達5-10%能顯著降低肥胖相關之心血管風險。病人適合進行藥物治療的條件為BMI≧30kg/m2或27-30kg/m2且至少有一項與體重相關的共病症,如高血壓、高血脂及第二型糖尿病等2。
藥物治療的機轉有許多路徑,過去曾使用過的減重藥物主要作用在中樞神經系統,透過調節正腎上腺素、多巴胺及血清素的釋放,或是抑制回收,進而降低食欲及增加熱量消耗以達到體重減輕;但因這些藥物直接調節上述神經傳遞物質釋放或是抑制回收,所以伴隨的副作用影響甚廣,如sibutramine、phentermine、lorcaserin分別因增加心血管發生風險、影響精神狀況、造成藥物濫用及致癌等不良事件,最後面臨下架。目前臨床使用最久及安全性較高的減重藥物orlistat透過與脂肪酶結合而抑制腸道脂肪分解,進而降低脂肪吸收及增加油脂排出體外,減少熱量攝取達到體重減輕。服用頻率一天三次,用藥期間常有胃脹氣、油便、油斑(沾褲)與排便增加等副作用,另可能增加脂溶性維生素吸收不良的問題,以上缺點對使用者有困擾之虞3。
人體中腸泌素(incretin)賀爾蒙最主要的是GLP-1和GIP。GLP-1由遠端腸道的迴腸及升結腸中L細胞所分泌,主要是以GLP-1(7-37)及GLP-1
(7-36) amide兩種具生物活性方式存在,其代謝產物GLP-1(9-37)、GLP-1
(9-36)
amide,皆由腎臟排除。其生理作用透過促進β細胞增生使胰島素的分泌與合成增加、抑制昇糖素的分泌,進而調控血中葡萄糖濃度;另外亦可作用於下視丘POMC/CART神經核內之神經元釋放飽足感訊號來降低食慾,也作用在腦部最後區(area
postrema)進而延遲胃排空。以上作用能增加飽足感、降低饑餓感及對食物的期待以減少食慾。GIP於十二指腸及近端空腸中的K細胞在進食後分泌,由42個胺基酸組成,具有葡萄糖依賴性刺激胰島素分泌作用。脂肪細胞含有豐富的GIP受體,能增加脂肪組織對胰島素的敏感性,防止異質脂肪組織(heterogeneous
adipose tissue)沉積。GIP及GLP-1經由dipeptidyl
peptidase 4 (DPP4)分解,半衰期分別為5-7分鐘及1-2分鐘3。
基於以上之生理作用,腸泌素作用劑的興起起初是應用在第二型糖尿病治療,在過去臨床試驗發現除了對糖尿病人血糖控制有明顯改善,也具有抑制食慾及減重的效果。而越來越多研究以非糖尿病人為模型進行臨床試驗發現亦有相同結果。
因過去減重藥物有增加心血管風險、影響精神狀況、造成藥物濫用、癌症、油便、油斑(沾褲)及增加脂溶性維生素缺乏等問題,因此腸泌素作用劑進一步被發明使用於減重治療以解決傳統減重藥物造成的重大副作用問題。
貳、腸泌素作用劑之介紹
目前腸泌素作用劑的減重作用機轉不明,可能與其透過降低食慾、提升飽足感及增加解脂活性與穩定能量平衡調控有關。
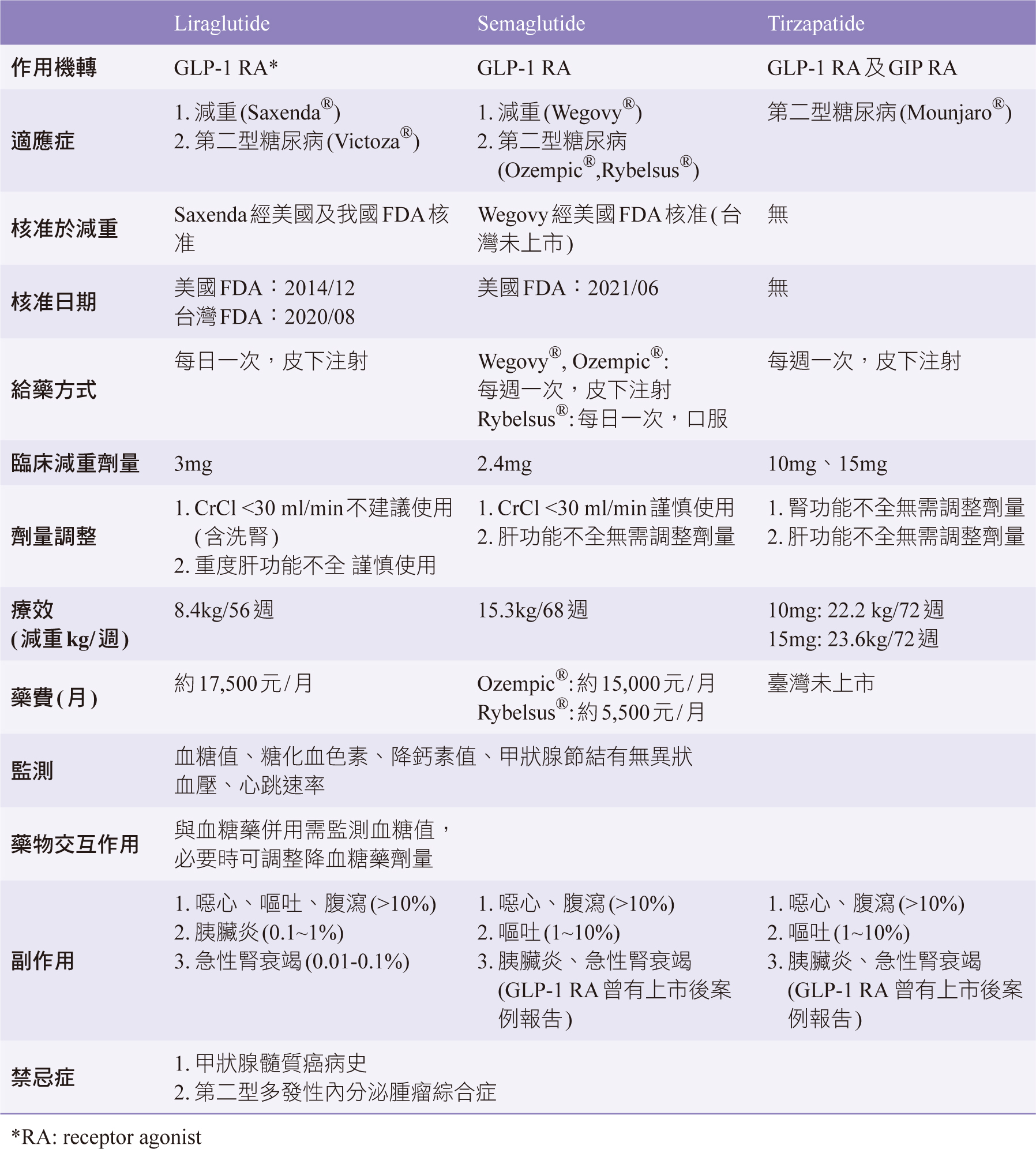
腸泌素作用劑包含GLP-1作用劑及GLP-1合併GIP雙效作用劑兩種,使用方式可分為兩種:短效型(每日一次)及長效型(每週一次),其個別藥物之作用、特性及副作用如表一。
表一 減重治療之腸泌素作用劑
一、 Liraglutide
Liraglutide是目前美國與我國FDA已核可使用於治療肥胖或過重的GLP-1作用劑,商品名為Saxenda®,經由皮下注射給予,可於每日固定時間施打,不需隨餐調整。起始劑量為每日一次0.6mg,劑量調升至少間隔一週,分別為0.6mg、1.2mg、1.8mg、2.4mg、3mg,維持劑量為3mg,若增加至下一個劑量後連續兩週耐受不良,應考慮停止治療4,5。
2015年liraglutide臨床試驗共收錄3731位病人,每日使用3mg治療為期56週可減重達8.4kg6。另一項2022年系統性文獻回顧及統合分析研究,共收錄14個隨機對照臨床試驗,在liraglutide
每日3.0mg治療下平均達到體重減輕5.04 kg7。
輕或中度肝腎功能不全者不需調整劑量,但需謹慎使用。重度肝腎功能不全或末期腎病者則不建議使用。若與上次施打時間超過3日,建議重新以0.6mg起始劑量開始2,4。
二、 Semaglutide
Semaglutide用於減重治療目前為off-lable
use,美國FDA核准用於治療肥胖或過重的GLP-1作用劑,商品名為Wegovy®8,我國FDA尚未核准該適應症。此藥半衰期約1週9,屬長效型GLP-1作用劑,有皮下注射及口服兩種給藥途徑8,10。
皮下注射方式於每週固定時間施打,可在一天中的任何時間注射,不論是否進食,必要時可改變每週注射的日期,但兩次注射之間應至少相隔3天(超過
72
小時)。起始劑量前四週為每週一次0.25mg,劑量以4週作為調升區間,分別為0.5mg、1mg、1.7mg、2.4mg,維持劑量為2.4mg,若增加至下一個劑量後產生耐受不良,可維持原劑量待4週後再進行調升2。
口服給予方式為每日一次,因食物、水及藥物會降低 semaglutide的吸收,故投藥後應至少30分鐘後再進食、喝水或使用其他口服藥10。
在2021年semaglutide之臨床試驗共收錄1961位病人,每週皮下注射一次,目標劑量為2.4mg治療為期68週,平均減重15.8%
(15.3kg),且超過半數受試者皆達到減重目標(減重達5%),在血脂及血壓數據也有改善11。2019年semaglutide口服劑型臨床試驗共收錄703位糖尿病人使用日劑量14mg單一療法26週後,可觀察到體重下降超過2kg12。
肝功能不全者劑量不需調整。輕度與中度腎功能不全者亦不需調整劑量,但因曾有急性腎衰竭個案發生,故在調升劑量過程中需密切監測腎功能變化。目前研究對於重度肝腎功能不全者及末期腎病病人的治療數據有限10。
三、 Tirzepatide
Tirzepatide為新一代GLP-1合併GIP雙效作用劑,美國與我國FDA尚未核可於減重治療,目前核准使用於治療第二型糖尿病。此藥半衰期約5天,屬長效型GLP-1作用劑。經由皮下注射,於每週固定時間施打,可在一天中的任何時間注射,不論是否進食,必要時可改變每週注射的日期,但兩次注射之間應至少相隔3天(超過
72 小時)13。起始劑量為每週一次0.25
mg,劑量以4週作為調升區間,每次調升0.25 mg,目前研究建議最大劑量為每週15
mg。肝腎功能不全者劑量不需調整。
2021年tirzepatide臨床試驗收錄1879位糖尿病受試者,每日5mg、10mg及15mg治療劑量下為期40週,分別平均體重降1.9kg、3.6kg及5.5kg14。另根據tirzepatide2022年之臨床試驗,收錄非糖尿病受試者共2539位,每日使用5mg、10mg及15mg治療劑量下為期72週,分別平均體重降16.1kg、22.2kg及23.6kg;在日劑量10mg及15mg組受試者,超過半數以上體重下降能超過20%15。
由至今發表的文獻中得知,腸泌素作用劑最常見的副作用主要為胃腸道副作用,包含噁心、嘔吐、腹瀉,大多數為輕度至中度、暫時性,常發生在剛開始治療的前幾週內,或是調升劑量過程中,持續治療後可在幾天或幾週內減輕。個人或是家族有甲狀腺髓質癌
(Medullary thyroid carcinoma, MTC)病史,以及有第2型多發性內分泌腫瘤綜合症病人(Multiple
Endocrine Neoplasia syndrome type 2, MEN
2)為使用禁忌症。過去曾有使用腸泌素作用劑產生急性胰臟炎之案例。另也曾有急性腎損傷之報告,尤其當胃腸道副作用或病人有脫水現象時會增加此不良反應發生的風險,故需密切觀察,必要時停藥。動物試驗已證實GLP-1藥物具生殖毒性,由於婦女懷孕期間使用的資料有限,建議計畫懷孕前至少應停用兩個月4,9。
參、總結
新一代腸泌素作用劑的問世,讓減重治療多一項選擇,該類藥物作用機轉主要透過胰島素和昇糖素調節機制,研究的基礎以糖尿病病人為出發點,目前也將非糖尿病者納入,臨床試驗結果成效顯著。本文提及三種腸泌素作用劑中,目前TFDA核准於減重只有liraglutide
(Saxenda®),而semeglutide核准之適應症為第二型糖尿病,tirzepatide尚未於臺灣上市。腸泌素作用劑的臨床試驗中減重療程常以安全性較高的orlistat為對照組,使用療程不建議超過4年。腸泌素作用劑雖減重療效較傳統藥物佳,其作用時間長僅需每天至1週給藥一次,但價格也高出許多。因多採皮下注射給藥,可能造成使用者產生心理壓力。使用藥物或外科手術治療非減重的首選方式,建議配合均衡飲食、規律運動及建立良好的生活習慣才是維持體重管理的良方。
Development of
Incretin Receptor Agonists in Weight Loss
Therapy
Yi Ting Yen, Hsiao Lin Chang, Chiu Jen Wu
Department of Pharmacy, Taipei Hospital,
Ministry of Health and Welfare
Abstract
The prevalence of obesity is increasing every
year and highly correlated to the occurrence of
chronic diseases, which is a global issue and
has gradually become a worldwide consensus that
obesity is viewed as a disease. The
pathophysiology of obesity is complex, and
currently approved anti-obesity drugs target
only a small subset of the multiple pathways
involved; thus, single targeted agents have
limited efficacy. With drug developments, there
are more pharmacotherapy options for weight
loss. GLP-1 (glucagon-like peptide-1) and GIP
(glucose-dependent insulinotropic polypeptide)
are the main incretin hormones from which a new
generation of incretin agonists has been
developed. The mechanism of incretin agonists
are unknown, but it may promote bodyweight loss
by reducing food intake, enhancing satiety and
lipolytic activity, and energy homeostasis.
These drugs provide the other option for obese
or overweight patients with risk of
comorbidities. Overall, incretin receptor
agonists combined with diet control and exercise
intervention are significant and faithful for
weight loss.
參考資料:
1. 衛生福利部國民健康署:成人肥胖防治實證指引。臺北:衛生福利部,2018。
2. Perreault L.(Oct 6, 2022) Treatment of
obesity in adults. Post TW(Ed) UpToDate.
Waltham, MA.(Accessed on Nov 30, 2022)
3. Del Prato S, Gallwitz B, Holst JJ, et al: The
incretin/glucagon system as a target for
pharmacotherapy of obesity. Obes Rev
2022;23(2):e13372.
4. Saxenda [package insert]. Novo Nordisk A/S:
Bagsvaerd, 2022. Retrieved November 30, 2022,
from https://mcp.fda.gov.tw/im_detail_1/%E8%A1%9B%E9%83%A8%E8%8F%8C%E7%96%AB%E8%BC%B8%E5%AD%97%E7%AC%AC001140%E8%99%9F
5. U.S. Food and Drug Administration. (Dec,
2014) Drugs@FDA: FDA-Approved Drugs. Saxenda.
Retrieved November 30, 2022, from https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/206321Orig1s000lbl.pdf
6. Pi-Sunyer X, Astrup A, Fujioka K, et al: A
Randomized, Controlled Trial of 3.0 mg of
Liraglutide in Weight Management. N Engl J Med
2015;373(1):11-22.
7. Konwar M, Bose D, Jaiswal SK, et al: Efficacy
and Safety of Liraglutide 3.0 mg in Patients
with Overweight and Obese with or without
Diabetes: A Systematic Review and Meta-Analysis.
Int J Clin Pract 2022;2022:1-14.
8. U.S. Food and Drug Administration. (Jun,
2022) Drugs@FDA: FDA-Approved Drugs. Wegovy.
Retrieved November 30, 2022, from https://www.accessdata.fda.gov/drugsatfda_docs/label/2021/215256s000lbl.pdf
9. Ozempic [package insert]. Novo Nordisk A/S:
Bagsvaerd, 2018. Retrieved November 30, 2022,
from https://info.fda.gov.tw/MLMS/ShowFile.aspx?LicId=60001107&Seq=003&Type=9
10. Rybelsus [package insert]. Novo Nordisk A/S:
Bagsvaerd, 2020. Retrieved November 30, 2022,
from https://info.fda.gov.tw/mlms/H0001D31.aspx?LicId=60001171
11. Wilding JPH, Batterham RL, Calanna S, et al:
Once-Weekly Semaglutide in Adults with
Overweight or Obesity. N Engl J Med
2021;384(11):989-1002.
12. Aroda VR, Rosenstock J, Terauchi Y, et al:
PIONEER 1: Randomized Clinical Trial of the
Efficacy and Safety of Oral Semaglutide
Monotherapy in Comparison With Placebo in
Patients With Type 2 Diabetes. Diabetes Care
2019;42(9):1724-1732.
13. U.S. Food and Drug Administration. (May,
2022) Drugs@FDA: FDA-Approved Drugs. Mounjaro.
Retrieved November 30, 2022, from https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/215866s000lbl.pdf
14. Frías JP, Davies MJ, Rosenstock J, et al:
Tirzepatide versus Semaglutide Once Weekly in
Patients with Type 2 Diabetes. N Engl J Med
2021;385(6):503-515.
15. Jastreboff AM, Aronne LJ, Ahmad NN, et al:
Tirzepatide Once Weekly for the Treatment of
Obesity. N Engl J Med 2022;387(3):205-216.
通訊作者:顏怡婷/電子信箱:chocayen0822@gmail.com