Lecanemab:阿茲海默症治療的新曙光
許博淳、龐琇綾、陳銘鴻、盧志峯、王郁青
高雄長庚醫院藥劑部
摘要
目前針對阿茲海默症的治療藥物研究方向多是降低大腦類澱粉蛋白斑塊(amyloid β
plaques)的生成與沉積,因此近年來多個針對類澱粉蛋白的藥物正積極發展當中。Lecanemab是人類化的IgG1單株抗體,能夠選擇性結合並清除可溶性的初原纖維類澱粉蛋白聚合物。其第三期臨床試驗使用數個不同失智行為評分驗證其療效,發現皆能有效減緩病程惡化,且以正子斷層造影分析顯示lecanemab也能清除大腦內類澱粉蛋白的沉積。藥物安全性方面,最常見的不良反應為輸注相關的不良反應及類澱粉蛋白相關的影像學異常(amyloid-related
imaging abnormalities,
ARIA)。在18個月的第三期試驗結束後,下階段長期開放性試驗研究(Open-label
trial)已在繼續進行當中。先前美國FDA為了加速藥物的核准速度,直接以能夠清除大腦中類澱粉蛋白作為核准藥證的依據。因此,在有效清除斑塊的第三期試驗成果出來後,lecanemab在未來應該可以順利通過審核。然而這樣的結果也顯示類澱粉蛋白的清除與最終失智症狀的表現並沒有直接的關係,最終在臨床上的利弊仍然相當不明確,且lecanemab並非能夠治癒,只是延緩認知功能的退化。考量到不良反應以及金錢上的支出,或許lecanemab仍不會是第一個廣泛使用的治療阿茲海默症藥物。雖然目前仍只能以非藥物手段介入阿茲海默症患者的治療,但這仍是阿茲海默症治療的一道新曙光。
關鍵字: Alzheimer's disease, Lecanemab, amyloid β
壹、前言
臨床上至今仍然還沒有找到能夠減緩或是逆轉阿茲海默症病程的藥物,因此各界仍然不停地針對各種可能機制進行藥物研發。目前被認為最可能的致病原因大多認為是因為大腦中產生類澱粉蛋白斑塊(amyloid
β plaques, Aβ)以及神經纖維糾結(neurofibrillary tangles,
NFT),形成絲狀的聚集體或沈積物在神經元間異常堆積。Aβ分子量約4k Da,由類澱粉前驅蛋白(amyloid
precursor protein,
APP)切割而來。類澱粉蛋白沈積後會對神經元造成破壞,導致海馬迴的神經元萎縮,接著擴散到大腦皮質進而引發認知障礙與失智症狀。腦血管中的沉積物引發病變,也稱為腦澱粉樣血管病(cerebral
amyloid angiopathy, CAA)可能引發腦出血、中風和腦部發炎等問題1。類澱粉蛋白的生成原因存在廣泛爭議,有可能是生成時錯誤折疊導致其正常功能喪失,或是其他未知機制而成,而某些種類甚至被認為具有內毒性。
文獻回顧分析目前已進入第三期臨床試驗的藥物,統計以病情調節藥物(Disease
modifying therapy, DMT)是研發的主流類別,占了目前所有第三期試驗藥物的68%2。細分目前進入第三期試驗的藥物種類,可分類為單株抗體類別藥物(如aducanumab、lecanemab等)、非抗體類小分子藥物、神經性精神病症狀改善藥物(neuropsychiatric
symptom Tx,如escitalopram等)與認知改善藥物(如donepezil等)等。單株抗體類藥物的作用目標都是針對清除不同種類的類澱粉蛋白相關聚合物,小分子藥物則有不同面向,大多在調控代謝、抗發炎、氧化壓力、Tau蛋白或是一些神經保護相關作用等,剩餘其他種類藥物則主要著重於神經傳導物質相關的調控。
一、 類澱粉蛋白斑塊(amyloid β plaques, Aβ)
類澱粉蛋白理論的發展導致清除類澱粉蛋白成為治療的首要目標。根據這個理論,雖然在認知能力正常的成人中時常也能發現有游離的類澱粉蛋白斑塊存在3,但在移除沈積的斑塊後應該可以阻止阿茲海默症病程發展與惡化,因此近年來多個針對類澱粉蛋白生成、沈積或是分解的藥物積極在發展當中。類澱粉蛋白生成後根據聚合的多寡可以分為很多種類,包含單元體(monomers)、寡聚物(oligomers)、初原纖維(protofibrils)與不溶性的原纖維(fibrils)斑塊沉積4。其中寡聚物與初原纖維已被證實具有神經毒性,因此去除這些物質或許對於治療阿茲海默症具有療效。
使用單株抗體藥物來清除大腦中的類澱粉蛋白斑塊或相關聚合物,被認為是目前最有機會成功的治療方式。但是先前對於輕度至中等的阿茲海默症患者進行臨床試驗的藥物例如
bapineuzumab與solanezumab,因為沒有辦法改善失智症患者的臨床評估指標最終宣告失敗。2019年的aducanumab試驗結果雖然能夠專一結合類澱粉蛋白斑塊,卻也因為無實質臨床效益而喊停。種種因素影響下使得阿茲海默症的藥物研發陷入困境。直到2021年美國FDA意外地修改了阿茲海默症藥物的核准標準,從必須達到實際的臨床指標差異,修改成只需要達到降低患者腦中的類澱粉蛋白斑塊,有條件核准來加速藥物研發速度5。因此aducanumab成了第一個被核准上市的阿茲海默症治療藥物。Aducanumab之詳細內容可參閱本刊152期介紹。
二、Lecanemab
Lecanemab(BAN2401)是以人類化的IgG1單株抗體,選擇性結合類澱粉蛋白中大型可溶性的初原纖維。不同藥物對於各式類澱粉蛋白的結合度不一,lecanemab對於單元體的結合性相當弱,而選擇性的結合在初原纖維上,是對原纖維的十倍。相較之下,aducanumab則主要結合於寡聚物與原纖維。臨床前試驗顯示可降低致病性類澱粉蛋白的沈積,並選擇性的降低實驗動物大腦與脊髓液中的原纖維。Lecanemab在第二期臨床試驗分別測試不同的給藥頻次與劑量,確立以每雙週給予每公斤10mg的劑量於18個月長度能夠達到治療差異,因此以此條件繼續進行第三期試驗6。第三期試驗名為CLARITY
AD試驗7,總數1795名的輕度認知障礙或阿茲海默症受試者,實驗發現lecanemab能夠不僅有效清除腦中的類澱粉蛋白斑塊,也能有效具有臨床指標差異,這是先前所有藥物都沒有的效果。不良反應方面約有21%發生類澱粉蛋白相關的影像異常(amyloid-
related imaging abnormalities,
ARIA),然而這大多是無症狀意外發現的。預計在2023年初,美國與歐洲將會依照實驗結果核准藥證。
第三期臨床試驗設計一個18個月長度的多中心雙盲測試,召集50到90歲具有早期阿茲海默症(輕微認知障礙或失智)且透過正子斷層造影(Positron
emission
tomography)或脊髓液測試具有類澱粉蛋白存在的病人。試驗組給予每二週每公斤10mg的劑量,並評估其失智狀態。另外也使用正子斷層造影評估類澱粉負荷(amyloid
burden),以CL量表(centiloids scale)評估。CL 為 0 至 100
分的量表,以年輕正常人訂為 0,典型阿茲海默症患者訂為1008,用以評估患者大腦中的類澱粉蛋白沉積狀況,若30以上則被視為已是具有沉積的狀態。
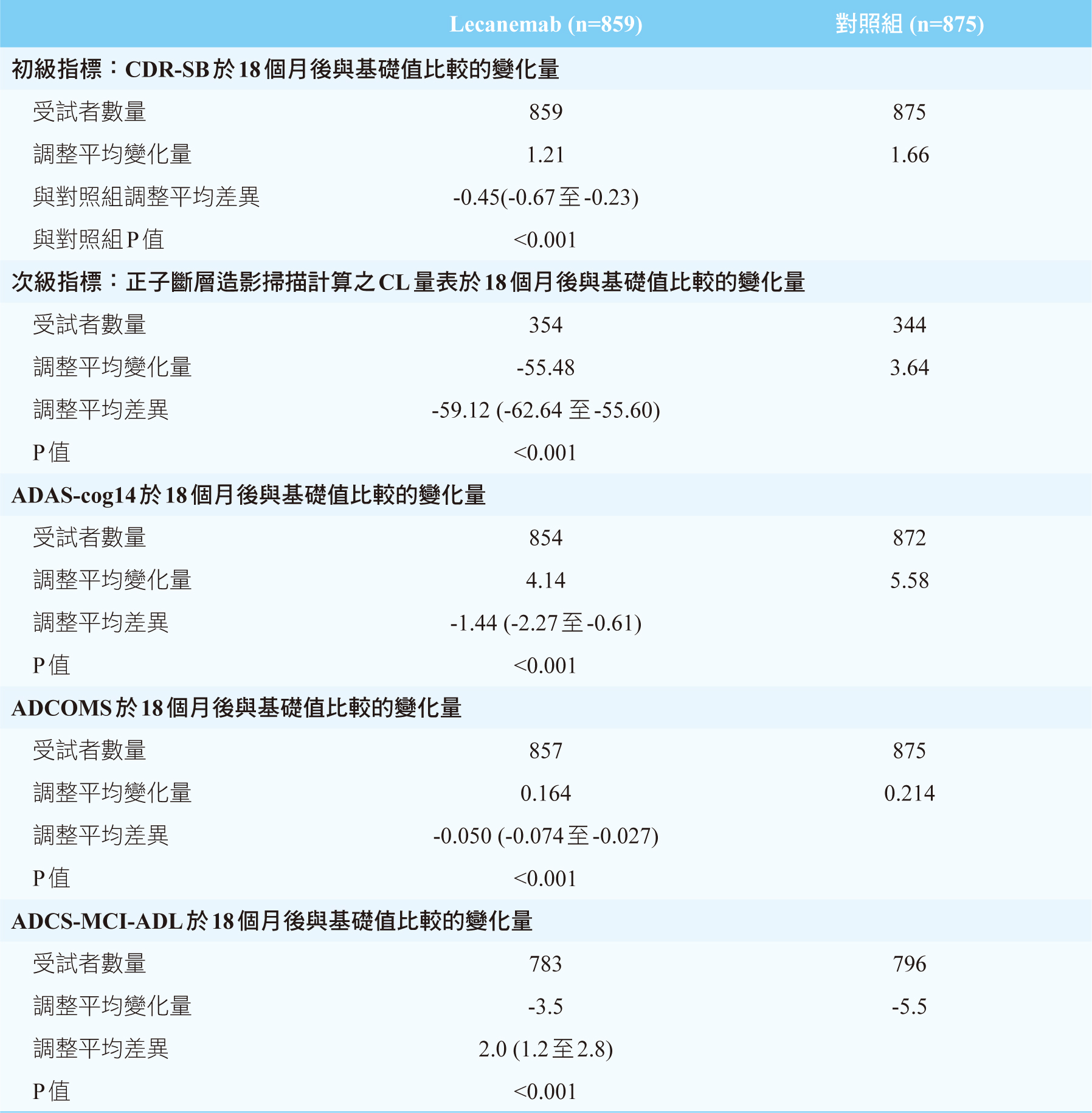
Lecanemab的第三期試驗以CDR-SB、ADAS-cog14、ADCOMS及ADCS-MCI-ADL四種評估系統評分受試者的失智症狀惡化狀態。CDR-SB、ADAS-cog14及ADCOMS為越高分代表越惡化,而ADCS-MCI-ADL為分數越低代表失智越惡化。
阿茲海默症疾病量表(Alzheimer's Disease Assessment
Scale–Cognitive Scale, ADAS-Cog)測試病患的認知功能程度與行為障礙,尾端數字則代表施測項目數量。其測試分為主觀測量口語能力、表達、記憶與言語相關的程度及客觀測量病患的定向能力、語言運用、圖形建構觀念與閱讀後回憶等項目分別計分,得分越高表示認知損傷越嚴重9。阿茲海默症綜合評分量表(Alzheimer's
Disease Composite Score, ADCOMS)由四個認知能力測試、兩個心智試驗與六個臨床失智評估所組成,優點在於對於早期阿茲海默症試驗中,對於較小的統計母體具有較高的敏感性10。
阿茲海默症量表-輕度認知功能障礙-日常生活活動量表(Alzheimer's disease Cooperative Study scale for mild cognitive impairment on activities of daily living, ADCS-MCI-ADL)之測試主要著重於對於輕度認知障礙患者日常生活能力方面的評估。臨床失智評估量表(Clinical Dementia Rating Scale Sum of Boxes, CDR-SB)為一個六項能力評估,由最輕微的0分代表無問題,至最高度的失智程度3分進行評分。六項分別評估記憶力、定向感、解決問題能力、社區活動能力、家居嗜好與自我照料能力,總分18分。若被評分越高則代表失智程度越嚴重,超過1分已表示具有輕度失智症狀。
貳、臨床試驗結果
實驗前基礎CDR-SB分數為3.2分,在18個月實驗後給予lecanemab的實驗組分數上升1.21,而對照組上升了1.66。也就是藥物可以減緩病程惡化,使實驗組分數減少上升了0.45。正子斷層造影掃描後以CL量表計算,相較對照組下降了59.1,lecanemab能夠清除腦部類澱粉斑塊分數至22.99,已低於被認定為具有沈積的大約30附近。其餘指標中ADAS-cog14相較於對照組減少上升了1.44、ADCOMS減少上升0.05以及ADCS-MCI-ADL減少下降了2.0。在這個第三期試驗中,發現不管哪一個指標與對照組相比,lecanemab都能夠延緩病程惡化。
表一 臨床試驗結果
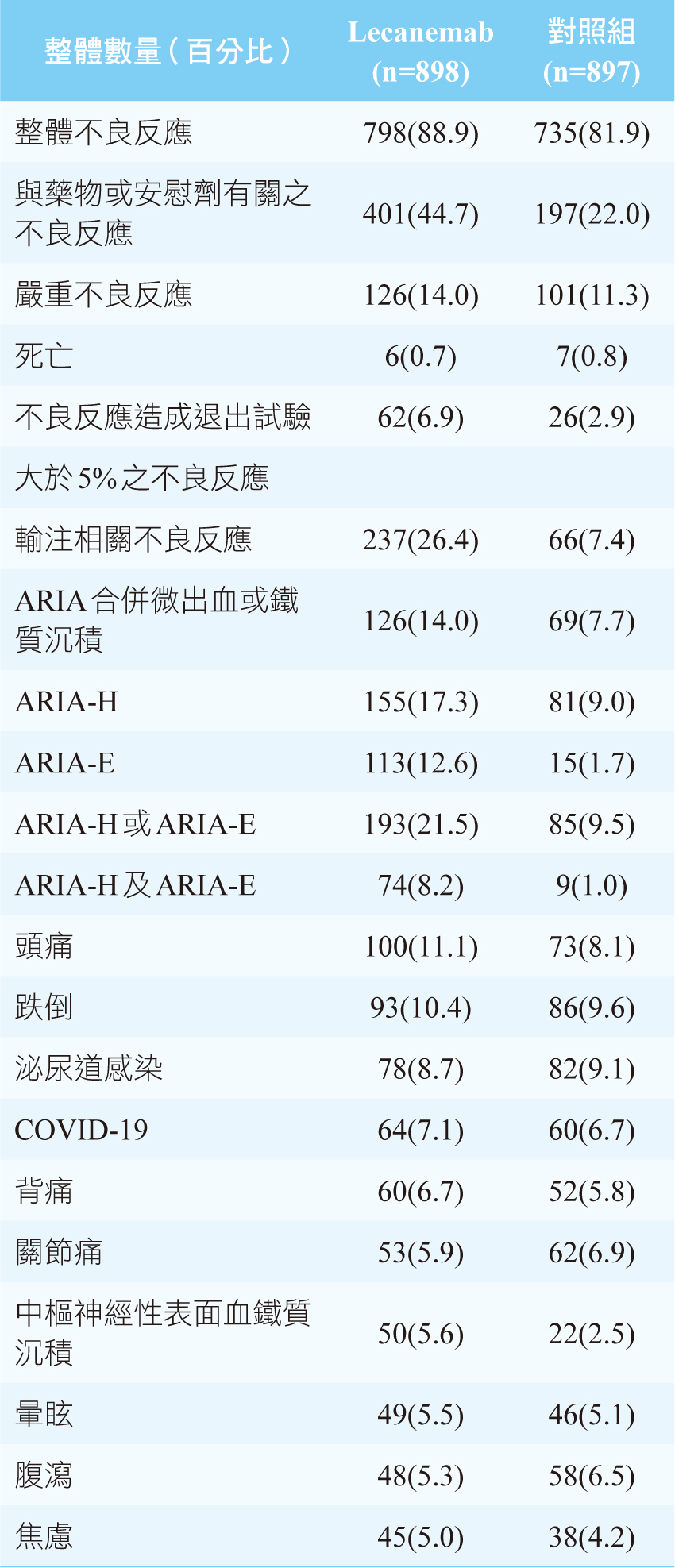
參、安全性問題
統計實驗組病人所發生的不良反應,最多的是有26.4%的受試者發生與輸注相關的不良反應(相較於對照組的7.4%),12.6%的病人產生類澱粉蛋白相關的影像學異常(ARIA)。進一步分析又可以分為發生大腦微出血(ARIA-Hemorrhages)或是積液(ARIA-Effusions)。實驗組受試者的整體死亡率0.7%而對照組為0.8%,顯示兩者之間沒有差異。死亡的受試者沒有因為ARIA不良反應所造成的。有14%的實驗組與11.3%的對照組受試者產生嚴重不良反應,其中1.2%實驗組受試者產生輸注相關的不良反應(對照組則無)、0.8%產生ARIA-E(對照組無)、0.7%產生心房顫動(對照組0.3%)、暈厥(syncope)與心絞痛(angina
pectoris)。
因為不良反應導致6.9%的實驗組與2.9%的對照組受試者退出試驗,最常見(>10%的受試者)的副作用是輸注方面的不良反應,通常是輕至中等程度(佔96%),且通常是第一次注射時發生(75%)。56%的受試者沒有服用預防藥物如NSAID、抗組織胺或是類固醇。發生不良反應者,服用前項預防藥物後,63%沒有再更進一步的反應。
次常見的不良反應為ARIA,其中又分為17.3%的ARIA-H與12.6%ARIA-E(對照組發生率分別為9.0%與1.7%,此為合併計算),大部分為在例行檢查中發現的輕到中度(91%)且無症狀(78%)的不良反應,且大多發生在實驗首三個月(71%),並在接下來四個月內消失(81%)。僅有2.8%的實驗組受試者發生具有症狀的ARIA-E,症狀大多反應是頭痛、視覺障礙與混亂。ARIA-H與ARIA-E分開單獨發生、不重複發生率為8.9%與0.7%,對照組則為7.8%與0.2%。ARIA-H最常出現的症狀是暈眩。ARIA的發生率,不管有無症狀,都相較類似的其他藥物為低。但目前仍然沒有直接的與他種藥物直接比較結果。載脂蛋白ε4等位基因(APOε4),
為偶發性阿茲海默氏症(Sporadic AD)最相關的遺傳危險因素。先前的研
究發現,帶有APOE4者比不帶有APOE4者相較下有更嚴重的記憶障礙、腦 容量減少和代謝率下降11。研究發現具有APOε4基因型者發生ARIA的機率較高。
肆、討論
現今治療阿茲海默症的藥物都只能暫時性的改善症狀,但卻無法延緩病程的惡化。有些研究認為若是清除大腦的類澱粉蛋白可以延緩病程的惡化,因此目前已有類似機制藥物aducanumab已獲美國FDA核准上市。lecanemab是一個人類化的單株抗體藥物,對於可溶性的類澱粉初原纖維具有高度親和性。初原纖維被證實對於神經元的毒性較單元體甚至不可溶的纖維沈積還要高。在先前第二期試驗中,進行12個月的試驗顯示實驗組與對照組間沒有顯著差異。但是在第三期較長18個月的試驗結果,延緩惡化的效益便開始顯現出來。實驗顯示lecanemab能夠有時間相關、劑量相關地清除類澱粉蛋白,而且能夠延緩病情惡化。
雖然說對於臨床症狀有所改善是個很好的消息,但總分18分的CDR-SB評估中僅改善了0.45分似乎在臨床上沒有太大意義,而且ARIA副作用的產生也可能因此造成未遮蔽偏差(unmasking
bias)12。皮下注射劑型lecanemab已經在進行臨床試驗,因為每月兩次的IV注射對於一般病患長期使用仍較為不方便。改善CDR-SB指標在臨床上的實質意義雖然尚未被建立,統計計算出的預估治療效果為具有基礎值3.2分的病患可以緩惡化0.373分,相較於安慰劑預計可以延緩25%的失智症惡化速度。通常若是在連續二次的評分的差異提高0.5以上便代表著阿茲海默症的惡化,進而進展至失智症的下一階段。
雖然在研究數據上有明顯改善病患的各種指標,但是最終在臨床上的效益仍然相當不明確。因為其造成不良反應的機率仍然很高。製造廠商的實驗顯示lecanemab可以結合並排除具有毒性的類澱粉蛋白斑塊,來延緩阿茲海默症的神經退化與病程進展。但這並非治癒,只是延緩認知功能的退化。並且實驗指標的些微進步並不能對應到臨床上的治療效果13
。另外因為實驗在COVID-19流行期間進行,也因此造成一些阻礙。整體的退出率為17.2%,另一個潛在的局限性是使用改良的意向治療分析(intention-to-treat
analysis,
ITT)而沒有填補缺失值。在18個月的實驗結束之後,後續延長的開放性試驗研究(Open-label
trial)仍在繼續進行中。
表二 不良反應
伍、結論
先前美國FDA為了加速藥物的核准,直接以類澱粉蛋白的清除作為核准的依據。因此,在有效清除類澱粉蛋白斑塊的第三期試驗成果出來後,lecanemab在未來應該可以順利通過審核。然而這樣的原因也顯示類澱粉蛋白的清除與最終失智症狀的表現並沒有直接的關係。考量到不良反應的利弊得失,以及金錢上的支出,或許lecanemab仍不會是第一個被廣泛使用的治療阿茲海默症藥物。目前仍然只能以加強非藥物手段介入失智症患者的治療5。
Lecanemab, a Flush
of Hope for Alzheimer's Disease
HSU PO CHUN, Hsiu-Ling Pang, Chen, Ming-hong,
Zhi-Feng Lu, Yu-Chin Lily Wang
Pharmacy, Chang Gung Memorial Hospital
Abstract
The research for Alzheimer's disease is focused
on the formation and accumulation of amyloid β
plaques so far. The clearance of amyloid β has
been the target of new drugs developing
recently. Lecanemab, a humanized IgG1 monoclonal
antibody that binds with high selective affinity
to Aβ soluble protofibrils, and to remove it
from the brain. Phase 3 trial exams with several
different trial endpoints show that lecanemab
could decrease the rate of dementia progression,
and assessment of plaque via PET shows that
lecanemab could also clear the accumulation of
amyloid β plaques. On the safety side, the
adverse effects most frequently reported are
infusion-related reactions and amyloid-related
imaging abnormalities (ARIA). The US Food and
Drug Administration (FDA) under its accelerated
approval program, which allows early approval of
drugs based on amyloid reduction in the brain.
Thus, lecanemab may be approved in the near
future because of the successful clearance of
amyloid plaques. However, the change of approval
condition shows the weak relation of amyloid and
dementia, leading to uncertainty and critics.
Lecanemab couldn't cure Alzheimer's disease but
it palliates, instead. To consider the pros,
cons and costs of lecanemab, it may not be the
first widely prescribed drug for Alzheimer's
disease. Although we still have to treat
Alzheimer's disease with non-pharmaceutical
measures now, it's still a flush of hope for
Alzheimer's disease.
參考資料:
1. Decourt, B., et al., Critical Appraisal of
Amyloid Lowering Agents in AD. Curr Neurol
Neurosci Rep, 2021. 21(8): p. 39.
2. Cummings, J., et al., Alzheimer's disease
drug development pipeline: 2022. Alzheimers
Dement (N Y), 2022. 8(1): p. e12295.
3. Michno, W., et al., Pyroglutamation of
amyloid-betax-42 (Abetax-42) followed by
Abeta1-40 deposition underlies plaque
polymorphism in progressing Alzheimer's disease
pathology. J Biol Chem, 2019. 294(17): p.
6719-6732.
4. Soderberg, L., et al., Lecanemab, Aducanumab,
and Gantenerumab - Binding Profiles to Different
Forms of Amyloid-Beta Might Explain Efficacy and
Side Effects in Clinical Trials for Alzheimer's
Disease. Neurotherapeutics, 2022.
5. The, L., Lecanemab for Alzheimer's disease:
tempering hype and hope. Lancet, 2022.
400(10367): p. 1899.
6. Swanson, C.J., et al., A randomized,
double-blind, phase 2b proof-of-concept clinical
trial in early Alzheimer's disease with
lecanemab, an anti-Abeta protofibril antibody.
Alzheimers Res Ther, 2021. 13(1): p. 80.
7. van Dyck, C.H., et al., Lecanemab in Early
Alzheimer's Disease. N Engl J Med, 2022.
8. 楊邦宏, 吳承翰, and 劉仁賢, 評估利用 Centiloid scale
方法標準定量化β 類澱粉蛋白 C-11 PIB 正子影像. 2021 Annual
Meeting and International Symposium of The
Society of Nuclear Medicine, Taiwan (R.O.C),
2021.
9. 張俊鴻, 神經認知功能的評估與訓練: 從諾貝爾醫學獎談起. 中國醫訊, 2014.
137: p. 14.
10. Wang, J., et al., ADCOMS: a composite
clinical outcome for prodromal Alzheimer's
disease trials. J Neurol Neurosurg Psychiatry,
2016. 87(9): p. 993-9.
11. 陳啟仁, et al., 存在載脂蛋白E (APOE)
的ε4等位基因對其腦結構性及功能性連結之影響—擴散張力素影像及靜息功能磁振造影之研究.
2012.
12. Mahase, E., Lecanemab trial finds slight
slowing of cognitive decline, but clinical
benefits are uncertain. BMJ, 2022. 379: p.
o2912.
13. Walsh, S., et al., Lecanemab for Alzheimer's
disease. BMJ, 2022. 379: p. o3010.
通訊作者:許博淳/電子信箱:hsmnze@gmail.com