葡萄糖轉運蛋白抑制劑:抗利尿分泌不當症候群治療現況與新曙光
盧雅紋、陳世欽
衛生福利部臺中醫院藥劑科
摘要
抗利尿分泌不當症候群(Syndrome of inappropriate
antidiuresis, SIAD)為體內分泌不正常濃度的抗利尿激素繼而導致水份滯留體內而引發低血鈉情形,臨床上並不少見,但其診斷與積極處理的重要性卻時常被忽視。雖然SIAD在1950年代已被發現,相對應的診斷標準也隨之確立,但目前治療的藥物仍然有限,目前第一線療法為限制水分攝取,而第二線治療藥物則有鹽錠、升壓素第二型受體拮抗劑與尿素。目前最新研究顯示葡萄糖轉運蛋白抑制劑能有效提升血鈉,有望為SIAD治療帶來新曙光。
關鍵字: 抗利尿分泌不當症候群、SGLT2抑制劑、低血鈉、SIAD、Tolvaptan
壹、 前言
1957年Bartter和Schwartz在兩位肺癌病人上觀察到低血鈉現象,推估可能和抗利尿激素(antidiuretic
hormone, ADH)或其類似物質分泌異常所導致,抗利尿分泌不當症候群(Syndrome
of inappropriate antidiuresis, SIAD)因此又稱Schwartz-Bartter症候群1。SIAD起因為ADH分泌過量而導致水份從集尿管大量回收,鬱積體內,繼而引發低血鈉。
SIAD是臨床低血鈉常見的原因之一,約佔35-40%2,潛在原因多元,包括惡性腫瘤、肺部疾病、中樞神經系統疾病、藥物副作用或抗利尿激素接受器變異等。惡性腫瘤佔SIAD盛行率約50%~70%,其中以小細胞肺癌(small
cell lung cancer, SCLC)最常見3。
低血鈉是臨床常見的檢驗數值異常,盛行率約1.72%4。低血鈉的病因常常是眾多因素交錯所致,因此尋找潛在病因至關重要。若低血鈉症狀沒有需要緊急處理的情況下,目前指引普遍支持限制水分(fluid
restriction)作為SIAD的第一線療法。若限制水分無效,目前第二線治療仍缺乏大型前瞻性研究,因此尚無共識。本文將介紹SIAD的生理學和鑑別診斷,以及二線治療方式的綜合討論,分別介紹限制水分、tolvaptan和葡萄糖轉運蛋白抑制劑(sodium-glucose
cotransporter 2 inhibitor, SGLT2i)。
貳、 抗利尿激素的功能
抗利尿激素,又稱精胺酸血管加壓素(Arginine Vasopressin, AVP)或血管加壓素。1985年時,下視丘分泌的激素有升高血壓的功能第一次被描述出來。隨後於1913年提出了下視丘分泌的激素有抑制尿液排除的作用(即抗利尿作用)5。ADH的結構首次由du
Vigneaud et al.
於1951年發表,是一種由9個氨基酸組成的胜肽,它在下丘腦(hypothalamus)的兩個分散區域中的巨細胞神經分泌細胞(magnocellular
neurosecretory cells, MNCs)合成:視上核(supraoptic
nucleus)和下視丘室旁核(paraventricular nucleus)6。合成的ADH會被送到腦下垂體後葉貯存,當血液滲透壓升高或體液不足時會刺激腦下垂體分泌ADH。ADH會作用在三個受體上,分別為V1、V2和V3,當作用在這些受體上時,會產生一系列預防脫水、低血容和低器官灌流(organ
hypoperfusion)的效果。當作用在血管平滑肌、肝細胞、血小板、腦和子宮的V1受體時,會引起血管收縮、肝糖分解(glycogenolysis)、血小板凝集和子宮收縮(類似催產素)7。作用在腦下垂體前葉(anterior
pituitary)的V3受體則會刺激腎上腺皮質(adrenocorticotropin,
ACT)分泌8。而V2受體位於兩個地方,分別是血小板,刺激會導致von
Willebrand因子釋放,另一個則位於腎臟,負責調節抗利尿作用。
參、抗利尿分泌不當症候群機轉
SIAD是ADH分泌超出滲透壓需求的結果。SIAD會導致即使血液滲透壓低且沒有低血容問題時,抗利尿作用仍持續進行。ADH持續刺激V2受體,促進水通道蛋白(aquaporin)結合到集尿小管管腔以開啟水通道,增加水分再吸收、濃縮尿液,並在水份持續再回收的情況下,血漿鈉離子濃度因稀釋而下降。此外,為了代償細胞外液的容積增加,醛固酮(aldosterone)分泌被抑制,心房利鈉肽(atrial
natriuretic peptide)分泌增加,導致鈉從尿液流失。
肆、 抗利尿分泌不當症候群之診斷
先測血液滲透壓以排除假性低血鈉(pseudohyponatremia),血中脂肪、蛋白質或糖分過高容易呈現檢驗數值上血鈉過低情形,這種低血鈉數值並非真實缺鈉,而是起因於滲透壓增加而導致易位性低鈉血症(translocational
hyponatremia)。導致低血鈉的潛在原因很多,診斷SIAD被認為是一個排除的過程。評估病史、用藥史和檢驗報告都可以幫助確認低血鈉的原因。
SIAD
診斷的排除標準,除了綜合評估尿液和血液滲透壓與鈉離子濃度,還要配合體液狀態,滿足所有條件即可判斷為SIAD
(表一) 9。
表一 SIAD診斷標準
伍、慢性SIAD之低血鈉的處置建議
慢性SIAD定義為低血鈉症狀持續超過48小時,此時腦部已經漸漸習慣體液處於低張狀態,因此在治療上,需要緩慢提升血鈉,以避免過度校正(overcorrection)而導致的去髓鞘症候群(Osmotic
demyelination syndrome,
ODS)。過度校正的定義為,24小時內血鈉急遽上升超過8 mmol/L10。
目前SIAD引起之低血鈉的治療指引主要是基於專家意見(expert
opinion),儘管在處理方法上尚無共識,但積極處理住院病人的低血鈉是普遍被建議的。Garrahy
A et al. (2021)
縱向回顧一家愛爾蘭醫院的資料發現,2005到2010年間,當專科醫師轉診率(32%增至68%)和積極介入低血鈉治療
(血鈉<120 mmol/L)(63%增至88%)的比例增加,與整體死亡風險降低有關(51%降至15%
)(P < 0.001) 11。另一個英國單一中心研究比較了18名血鈉<127
mmol/L的病人(平均血鈉120.7 mmol/L)與23名對照組(平血鈉124.1 mmol/L),觀察到積極介入低血鈉處理可以較快達到鈉離子增加至少5
mmol/L (3.5天對比7.1天;P =
0.005),以及住院天數顯著減少(10.9天對比14.5天;P = 0.004)
12。
一、 限水
限水方式治療SIAD是目前歐盟和美國低血鈉指引推薦的第一線療法,儘管療效證據有限13。但限水的優點是免費且容易執行。目前沒有統一推薦的限水原則。首要原則是達到體液負平衡,即純水的輸出超過輸入。基於這個原則,美國的建議是限水的液體輸入量應該比24小時尿液輸出量少500
mL,這是一個經驗法則(因無法測量無意識水份流失)。最近一項隨機分派研究收納了46位,慢性無症狀低血鈉病人,初始平均血鈉值為127
mmol/L,把病人分成限水組(每天限制1000 mL)與無限制組,研究觀察限水組的血鈉平均上升3
mmol/L,而無限制組則上升1 mmol/L(研究允許病人自由攝取水份,平均攝取量為1.5
L) 14。
二、 Tolvaptan
Tolvaptan是一種口服的選擇性V2受體拮抗劑,能夠阻斷腎臟ADH作用,促進尿液增加,水分排除,以提高血鈉濃度。這種僅排水而不影響鈉、鉀排除的作用稱為aquaresis。
確認Tolvaptan的療效主要為SALT-1和SALT-2兩個前瞻性研究。研究收錄448名低血鈉病人,平均年齡61歲。收納條件為慢性輕至中度高容積性(hypervolemic)或等容積性(euvolemic)低血鈉病人(表二),基礎血鈉值為129
mmol/L,排除嚴重低血鈉(<120 mmol/L)且伴有神經功能障礙(neurological
impairment)者。共病症方面,30.8%有心衰竭,26.8%有肝硬化,24.6%有SIAD,17.8%為其他15,
16。研究比較了Tolvaptan和安慰劑加上標準治療(限制水分攝取)。兩個研究都顯示,與安慰劑上升約1
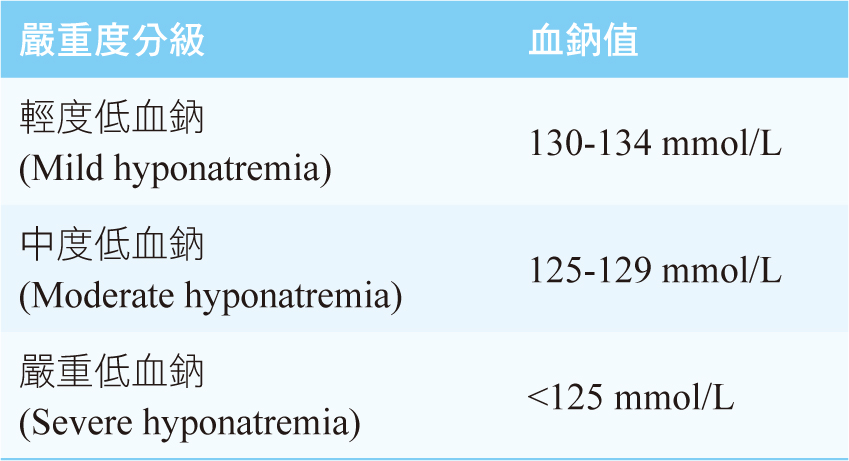
mmol/L相比,Tolvaptan在第4天時上升較多,約4 mmol/L。常見不良反應包括口乾、虛弱、噁心、頭暈、夜尿及頻尿。近年來,有一些證據支持使用較低起始劑量7.5毫克的Tolvaptan。在兩個小型研究中,使用7.5毫克時皆沒有發生血鈉過度校正的事件,然而,使用標準15毫克時,13-40%的病人發生校正過快的問題16,17。臺灣於2010年核准tolvaptan上市,適應症為治療SIAD引起之臨床上明顯之低血鈉症(指血鈉濃度<125
mmol/L,或低血鈉未降至125 mmol/L以下,但具有症狀且對限制水份療法無效者)。Tolvaptan的初始劑量為每天15毫克,在最初24小時的治療期間,應避免限制水份攝取,可依口渴狀況攝取水分。經過至少24小時後,視血鈉目標值需求,劑量可增加至每天30或60毫克。Tolvaptan有95%經肝臟CYP3A酵素代謝,須注意藥品交互作用。為減少肝損傷之風險,投與tolvaptan不要超過
30天。對於輕至中度肝功能受損、心衰竭及肌酸酐清除率≧10mL/min的病人,不需調整劑量,但對於肌酸酐清除率小於10
mL/min,則不建議使用18。
表二 低血鈉分級
三、 SGLT2抑制劑
(一) SGLT2抑制劑作用機轉
SGLT2i是新一代的口服降血糖藥,作用機轉為抑制腎臟再吸收葡萄糖,增加葡萄糖由尿液排出,以達到降低血糖,同時提高鈉離子的排除。目前適應症除了第二型糖尿病外,尚有慢性收縮性心衰竭。SGLT2i還能收縮入球小動脈,減少腎絲球壓力,達到保護腎臟的效果19。目前臺灣有的SGLT2i主要有三種:empagliflozin、dapagliflozin、canagliflozin。
腎臟近曲小管中的SGLT2受體負責90%的葡萄糖和65%的鈉再吸收。抑制SGLT2會導致尿糖增加,伴隨著滲透性利尿(osmotic
diuresis)的作用。SGLT2i利尿的效果除了尿糖效應(glucosuric
effect)外,尚有排納效應(natriuretic
effect)。SGLT2i的排鈉效應機轉被認為是抑制近曲小管Na+/H+ exchanger
3 (NHE3) 和碳酸氫鹽回收(bicarbonate
flux),NHE3負責重新吸收約40%的鈉。Griffin等人的研究顯示,empagliflozin能夠持續降低血液和血漿容積,且empagliflozin使用在心衰竭病人時,並未改變腎臟在任何時間點的鈉分泌率。這可能與empagliflozin在近曲小管中抑制鈉重吸收的作用,而使鈉在剩餘的腎小管和集尿管重吸收增加來進行補償,因此SGLT2i能達到利尿但不增加尿鈉的作用20,21。
(二) SGLT2抑制劑治療SIAD的文獻回顧
因SGLT2i有增加水份排除的機轉,因此開始被研究作為SIAD的新療法。一項收納87名住院病人的隨機分派試驗比較使用4天empagliflozin
25毫克或安慰劑,在病人平均初始血鈉值為125.5 mmol/L的情況下,每天限水1000 mL。在使用empagliflozin加上限水組中,血鈉在4天增加了10
mmol/L,而安慰劑加上限水組則為7mmol/L (P =0 .04) 22。兩組參與者中皆有14%病人合併有第2型糖尿病。Empagliflozin組中有2名病人(5%)出現血鈉校正太快情形,而安慰劑組中有1名。唯一可能與藥物有關的不良反應是empagliflozin組有7%參與者在血鈉恢復後肌酸酐清除率下降。研究中未觀察到低血壓或低血糖情形。在安慰劑組中,僅使用限水治療,也有相對應的血鈉上升結果,這結果表示至少在某些病人中,ADH分泌可能是可逆的。值得注意的是,SIAD的原因在兩組之間存在差異性,因此ADH分泌的自我校正速率上可能有所不同。另外,SGLT2i組中,有更高比例的惡性腫瘤病人(惡性腫瘤為不可逆的SIAD風險因子),如果考量到這個因素對血鈉的影響,則升血鈉的臨床效果預計會偏向安慰劑組。
另一個隨機對照交叉設計的研究,共收納14名病人,男女各半,年齡中位數為72歲,2位有第2型糖尿病23。研究分為empagliflozin
25毫克每天一次治療四週與安慰劑組,兩組都沒給予限水措施,研究對於慢性SIAD低血鈉的門診病人血鈉上升效果。參與者慢性SIAD的原因很多,包含藥物引起(抗癲癇藥[n
= 3]和抗抑鬱藥[n = 1])、肺部疾病(n = 3)或中樞神經系統(n =
2)疾病,以及因慢性疼痛壓力而引起(n =
1),另有4人的病因屬於特異性(idiopathic)低血鈉。起始血鈉中位數為131 mmol/L,使用empagliflozin治療後增加至134
mmol/L,而使用安慰劑則沒有增加(130 mmol/L) (P = 0.004) (表三)。Empagliflozin組的治療耐受性良好。兩組都有約一半的病人有口渴問題,少數病人有頭痛和眩暈;噁心感只有安慰劑組發生。研究期間,未發生血鈉校正過快、低血糖、低血壓、尿道或生殖器感染。借鏡其他適應症使用SGLT2i的經驗得知,SGLT2i用在第2型糖尿病時,有酮酸中毒(ketoacidosis)的風險,尤其在住院中且病況較不穩定的病人24。因此,使用SGLT2i在此類病人的經驗較受限,直得慶幸試驗中沒有發生酮酸中毒的情況。
(三) 使用SGLT2i在鈉水平衡的個案報告
日本Yuji Aoki等人2016年時發表了一個tolvaptan與SGLT2i對於尿鈉與尿量影響的三個案例報告25。研究發現,在糖尿病合併其他共病的病人中,會因SGLT2i使用在不同疾病而有觀察到不同鈉水平衡的差異。在糖尿病合併心衰竭的病人,當病人由tolvaptan轉換成SGLT2i時,觀察到尿鈉和尿量排除的減少,而糖尿病合併腎病症候群(nephrotic
syndrome)病人,轉換成SGLT2i後,觀察到尿鈉和尿量排除增加,尿蛋白降低。兩位病人皆有同時使用furosemide
分別10與20毫克。這項研究與Griffin與Boorsma等人觀察到的SGLT2i於心衰竭的鈉離子平衡一致,意即腎臟的利水效果大於利鈉效果20,21。至於腎病症候群使用SGLT2i導致尿鈉排除增加的解釋可能為,糖尿病合併腎病症候群病人會因尿糖增加而使SGLT2受體增加尿鈉與糖的再吸收,導致靠近遠區小管的緻密斑感受鈉離子降低而啟動腎素-血管張力素-醛固酮系統(renin-angiotensin-aldosterone
system, RAAS),當SGLT2i開始使用後,尿鈉排除恢復,會解除因腎病症候群時而啟動的RAAS系統,因而觀察到腎臟在遠區小管對鈉水的再吸收減少26,相對地增加尿鈉量。而在第三個案例為糖尿病合併高血壓與腎功能異常(肌酸酐清除率35.9
mL/min)病人,病人在沒有使用利尿劑與tolvaptan的情況下使用empagliflozin每日10毫克。研究觀察到,尿量與尿糖顯著增加,而尿鈉排除沒有顯著改變。
Bioletto et al. (2023) 發表了一位68歲男性,有第2型糖尿病和慢性SIAD,血鈉可在合併使用尿素與SGLT2i下控制良好,但停用SGLT2i,單用尿素時,低血鈉則又復發。在重新合併SGLT2i後,血鈉又恢復正常27。
綜合以上個案報告針對SGLT2i對於鈉水平衡的影響,可以得知,SGLT2i在尿鈉的平衡除會受到共病和合併使用的藥品而有影響外,尚因SGLT2i作用於腎小管近端區,對於鈉排除的效果會受後端腎小管
(亨利式環、遠端小管與集尿管等)
的代償影響,而有差異。然而,SGLT2i有利尿與利水的效果,則是一致增加的。
目前正在進行一個大規模的研究,以評估SGLT2i在慢性等容積和體液過多的低血鈉上的臨床使用(ClinicalTrials.gov
Identifier: NCT04447911),值得我們期待。
陸、 結論
低血鈉是一個臨床常見的檢驗異常事件,症狀表現從輕度的虛弱、噁心、頭痛到嚴重甚至可能引起癲癇發作、肺積水、腦疝、呼吸中止、永久性腦損傷或死亡等不可忽視後果。而低血鈉的成因很多,SIAD占了發生率約35-40%。目前臺灣治療SIAD的方法除了限水、補充高濃度氯化鈉外,尚有Tolvaptan,但Tolvaptan使用上須謹慎處理藥品的交互作用與注意水份攝取,並且,Tolvaptan
15毫克(臺灣大塚製藥伸舒康錠)的健保價為新台幣540元(112.04),可近性與價錢相對SGLT2i門檻較高。
SGLT2i在治療SIAD的臨床試驗都呈現了正面的結果,為SIAD的治療開啟一道新曙光。SGLT2i的藥品可近性、臨床使用熟悉度和相對安全性,有機會使其在SIAD中廣泛被使用。有望為SIAD的治療增加另一個較經濟、安全、可近性較高的選擇。
Current Management
on Syndrome of Inappropriate Antidiuretic and
New Hope with
Sodium-glucose Cotransporter 2 Inhibitors
Ya-Wen Lu, Shih-Chin Chen
Department of Pharmacy, Taichung Hospital,
Ministry of Health and Welfare
Abstract
Syndrome of inappropriate antidiuretic secretion
(SIAD) is characterized by abnormal
concentrations of antidiuretic hormones in the
body, resulting in water retention and
subsequently causing hyponatremia. Although SIAD
is a common complication in clinical practice,
its importance of diagnosis and manage
proactively are often neglect. Even though SIAD
was discovered in the 1950s and corresponding
diagnostic criteria have been established snice
then, the available pharmacological treatments
are still limited. Currently, the first-line
therapy involves restricting fluid intake, while
second-line treatment options include salt
tablets, vasopressin receptor antagonists, and
urea. The latest research indicates that
sodium-glucose cotransporter 2 inhibitors can
effectively increase blood sodium levels,
offering a potential new option for the
treatment of SIAD induced hyponatremia.
參考資料:
1. Schwartz WB, Bennett W, Curelop S, et al. A
syndrome of renal sodium loss and hyponatremia
probably resulting from inappropriate secretion
of antidiuretic hormone. 1957[J]. J Am Soc
Nephrol, 2001, 12(12): 2860–2870.
2. Greenberg A, Verbalis JG, Amin AN, et al.
Current treatment practice and outcomes. Report
of the hyponatremia registry. Kidney Int.
2015;88(1):167-177.
3. Gustafsson BI, Kidd M, Chan A, et al.
Bronchopulmonary neuroendocrine tumors[J].
Cancer, 2008, 113(1): 5–21.
4. Mohan S, Gu S, Parikh A, Radhakrishnan J.
Prevalence of hyponatremia and association with
mortality: results from NHANES. Am J Med.
2013;126(12):1127-37.e1.
5. Oliver G, Schäfer EA. On the physiological
action of extracts of pituitary body and certain
other glandular organs: preliminary
communication. J Physiol. 1895; 18(3):277-279
6. Brown CH, Bains JS, Ludwig M, Stern JE.
Physiological regulation of magnocellular
neurosecretory cell activity: integration of
intrinsic, local and afferent mechanisms. J
Neuroendocrinol. 2013;25(8):678-710.
doi:10.1111/jne.12051
7. Caldwell HK, Lee HJ, Macbeth AH, Young WS
3rd. Vasopressin: behavioral roles of an
"original" neuropeptide. Prog Neurobiol. 2008
Jan;84(1):1-24.
8. Aguilera G, Subburaju S, Young S, Chen J. The
parvocellular vasopressinergic system and
responsiveness of the hypothalamic pituitary
adrenal axis during chronic stress. Prog Brain
Res. 2008;170:29-39.
9. 陳和昌、葉宗銓、張湖岳等:台灣老年醫學暨老年學雜誌 2009;4(3):160-168
10. Sterns RH, Riggs JE, Schochet SS Jr. Osmotic
demyelination syndrome following correction of
hyponatremia. N Engl J Med.
1986;314(24):1535-1542..
11. Garrahy A, Cuesta M, Murphy B, et al. Active
management of severe hyponatraemia is associated
with improved mortality. Eur J Endocrinol.
2021;184(1):9-17.
12. Tzoulis P, Carr H, Bagkeris E, Bouloux PM.
Improving care and outcomes of inpatients with
syndrome of inappropriate antidiuresis (SIAD): a
prospective intervention study of intensive
endocrine input vs. routine care. Endocrine.
2017;55(2):539-546.
13. Spasovski G, Vanholder R, Allolio B, et al.
Clinical practice guideline on diagnosis and
treatment of hyponatraemia [published correction
appears in Eur J Endocrinol. 2014
Jul;171(1):X1]. Eur J Endocrinol.
2014;170(3):G1-G47.
14. Garrahy A, Galloway I, Hannon AM, et al.
Fluid Restriction Therapy for Chronic SIAD;
Results of a Prospective Randomized Controlled
Trial. J Clin Endocrinol Metab.
2020;105(12):4360-4369
15. Schrier RW, Gross P, Gheorghiade M, et al.
Tolvaptan, a selective oral vasopressin
V2-receptor antagonist, for hyponatremia. N Engl
J Med. 2006;355(20):2099-2112.
16. Castello LM, Baldrighi M, Panizza A, et al.
Efficacy and safety of two different tolvaptan
doses in the treatment of hyponatremia in the
Emergency Department. Intern Emerg Med.
2017;12(7):993-1001.
17. Harbeck B, Lindner U, Haas CS. Low-dose
tolvaptan for the treatment of hyponatremia in
the syndrome of inappropriate ADH secretion (SIADH).
Endocrine. 2016;53(3):872-873.
18. Verbalis JG, Adler S, Schrier RW, et al.
Efficacy and safety of oral tolvaptan therapy in
patients with the syndrome of inappropriate
antidiuretic hormone secretion. Eur J Endocrinol.
2011;164(5):725-732.
19. Braunwald E. Gliflozins in the Management of
Cardiovascular Disease. N Engl J Med.
2022;386(21):2024-2034.
20. Griffin M, Rao VS, Ivey-Miranda J, et al.
Empagliflozin in Heart Failure: Diuretic and
Cardiorenal Effects. Circulation.
2020;142(11):1028-1039.
21. Boorsma EM, Beusekamp JC, Ter Maaten JM, et
al. Effects of empagliflozin on renal sodium and
glucose handling in patients with acute heart
failure. Eur J Heart Fail. 2021;23(1):68-78.
22. Refardt J, Imber C, Sailer CO, et al. A
Randomized Trial of Empagliflozin to Increase
Plasma Sodium Levels in Patients with the
Syndrome of Inappropriate Antidiuresis. J Am Soc
Nephrol. 2020;31(3):615-624.
23. Refardt J, Imber C, Nobbenhuis R, et al.
Treatment Effect of the SGLT2 Inhibitor
Empagliflozin on Chronic Syndrome of
Inappropriate Antidiuresis: Results of a
Randomized, Double-Blind, Placebo-Controlled,
Crossover Trial. J Am Soc Nephrol.
2023;34(2):322-332.
24. Hamblin PS, Wong R, Ekinci EI, et al. SGLT2
Inhibitors Increase the Risk of Diabetic
Ketoacidosis Developing in the Community and
During Hospital Admission. J Clin Endocrinol
Metab. 2019;104(8)
25. Aoki Y. Comparison of diuretic effects
between empagliflozin, a sodium- glucose
co-transporter 2 inhibitor with osmotic diuresis,
and tolvaptan, a water diuretic, in two type 2
diabetic patients taking sodium diuretics. Dia-
betes Res Open J. 2016; 2(2): 45-49
26. Nelinson DS, Sosa JM, Chilton RJ. SGLT2
inhibitors: a narrative review of efficacy and
safety. J Osteopath Med. 2021;121(2):229-239.
27. Bioletto F, Varaldo E, Prencipe N, Benso A,
Berton AM. Long-term efficacy of empagliflozin
as an add-on treatment for chronic SIAD: a case
report and literature review. Hormones (Athens).
2023;22(2):343-347.
通訊作者:盧雅紋/電子信箱:tinalu1988@gmail.com