認識DPP-4抑制劑引起的類天皰瘡
吳承熹1、羅翠雲2、葉清政1、施如亮3
1天主教永和耕莘醫院藥劑科、2台北市至善老人安養護中心照護組、
3天主教永和耕莘醫院教學研究部
摘要
類天皰瘡 (Bullous pemphigoid)
是一種好發於老年族群的罕見自體免疫性皮膚疾病,自體抗體 (autoantibody)
會破壞皮膚基底細胞 (basal keratinocyte) 及基底膜 (basal
membrane)
的連結,產生緊實的皮膚水泡,並會蔓延全身,導致皮膚潰爛,甚至會有感染的風險。因此,罹患類天皰瘡對病人及照護者來說,都是一大負擔。二肽基肽酶-4
(dipeptidyl peptidase-4, DPP-4)
抑制劑是目前被廣泛使用的降血糖藥物之一,然而,它可能會引發類天皰瘡的不良反應,並不為醫事人員所普遍知悉。本文將藉由安養機構住民的案例來介紹DPP-4抑制劑與類天皰瘡的關聯性,以及在類天皰瘡的治療藥物中,四環黴素類
(tetracyclines) 及菸鹼醯胺 (nicotinamide) 的老藥新用。
關鍵字: 類天皰瘡、Bullous pemphigoid、DPP-4抑制劑、DPP-4
inhibitors
壹、案例
2022年的11月中,北部某安養機構護理師發現,一位82歲患有糖尿病的男性住民,從2022年7月26日起從單一部位的自抓破皮後,逐漸有紅疹及水泡蔓延全身導致皮膚潰爛的病徵,其後就診皮膚科醫師,同年9月22日病人確診罹患「類天皰瘡」。
該住民於2018年12月4日入住安養機構,有心律不整、糖尿病、阿茲海默失智症、攝護腺肥大病史。因有過敏體質常有流鼻水情形,若有打噴嚏情形,需要即時服用抗過敏藥物。該住民的長期用藥包括sennoside
tablets 1# HS、tamsulosin prolonged release
tablets 0.4 mg QD、furosemide tablets 20 mg
QOD、cobalamin capsules 250 mcg 1# QD外,在入住安養機構之前,即已長期服用metformin
tablets 500 mg BID。因病情變化,醫師於2021年6月30日調整降血糖用藥,將metformin
tablets 500 mg BID更換為sitagliptin/metformin
50/500 mg tablets BID,於2022年6月4日又將sitagliptin/metformin
50/500 mg tablets BID更換為vildagliptin/metformin
50/850 mg BID。同年9月22日病人確診罹患類天皰瘡,並開始使用prednisolone
tablets 5 mg BID,於10月13日改換minocycline capsules
100 mg BID 14天,10月20日再開回prednisolone tablets 5
mg
BID。藥師於2022年11月8日執行該住民的藥物評估後建議:「降血糖藥物中之DPP-4抑制劑
(如Januvia或Galvus),據文獻報告可能引發類天皰瘡,並請處方醫師評估是否更換為不同機轉之降血糖藥。」住民於2022年11月16日回診時,皮膚科醫師再開立minocycline
capsules 100 mg BID 14天,神經內科醫師另將vildagliptin/metformin
50/850 mg BID改為glimepiride/metformin 2/500 mg
tablets
BID。至11月29日住民因吸入性肺炎住院,12月10日電話聯絡醫院病房,護理師告知住民身上類天皰瘡傷口只剩雙上臂處,其他傷口已癒合並每天換藥。住民於2023年1月3日出院,僅剩左小腿內側1顆水泡,續用prednisolone
tablets 5 mg QD,後續觀察並未有新發生之水泡。
貳、類天皰瘡介紹
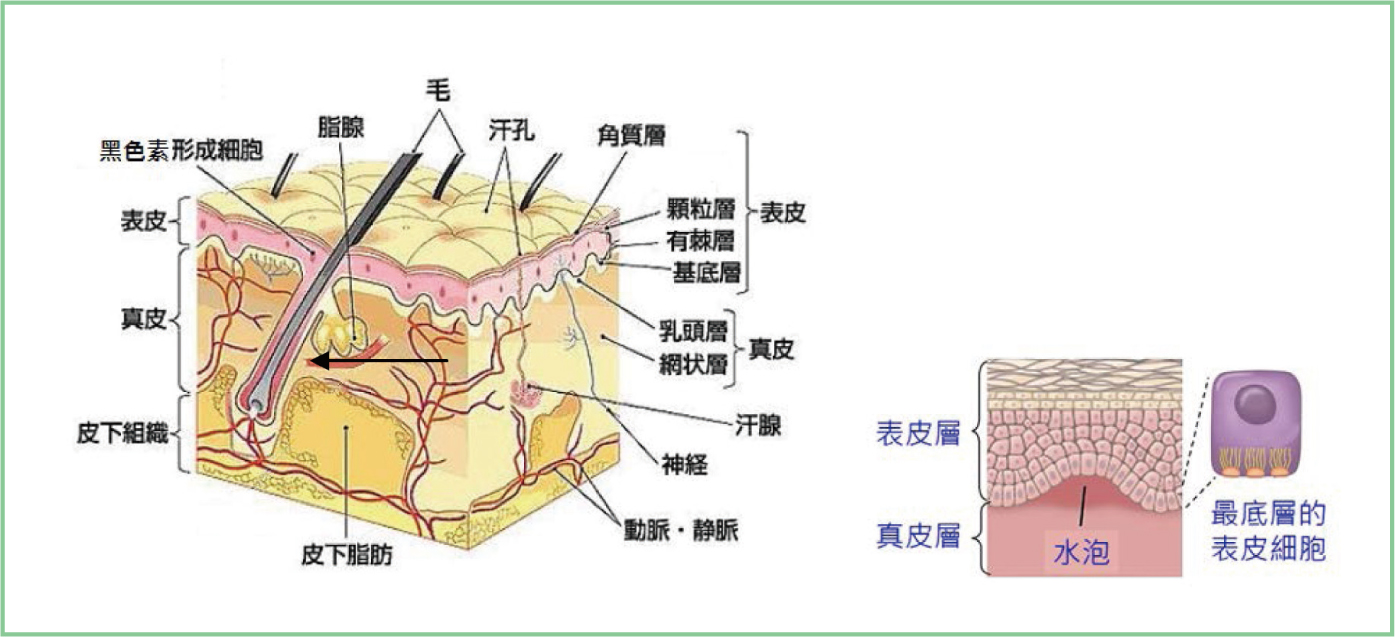
類天皰瘡是一種好發於老年族群的自體免疫性皮膚疾病,其組織病理學特徵是補體蛋白C3及自體抗體IgG會沉積在表皮的基底膜帶
(basement membrane zone)、真皮的乳頭層 (papillary
layer) 有嗜伊紅性白血球浸潤,病徵為全身性蕁麻疹斑塊及散布在表皮下緊實的水泡 (tense
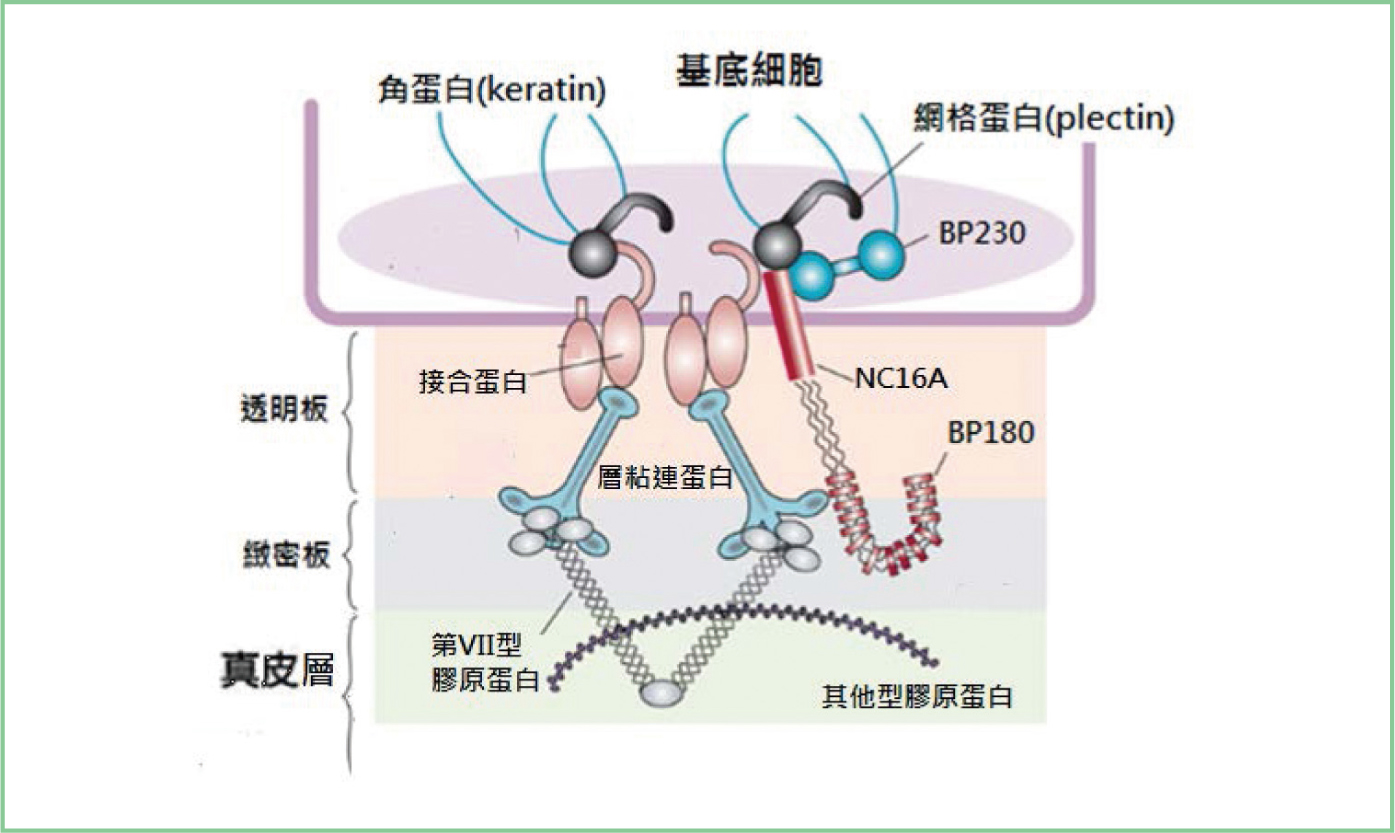
blister)(圖二)。類天皰瘡的自體抗原 (autoantigen)
BP180及BP230,主要存在皮膚的基底膜及中樞神經系統。BP180是一個分子量為180 kD的跨膜膠原蛋白
(collagen XVII);BP230是一個分子量為230 kD的細胞質內plakin家族蛋白
(plakin family
protein)。正常情況下,表皮係藉由跨細胞膜的BP180及細胞內的BP230,將基底層的角質形成細胞
(basal keratinocyte)
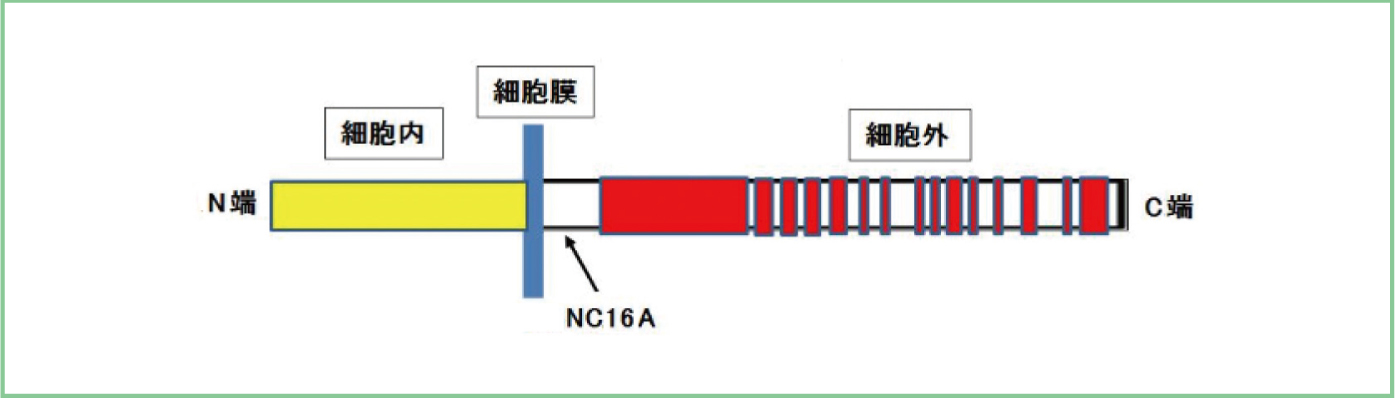
與真皮黏附在一起(圖三)。類天皰瘡的致病機轉是血清中對抗BP180及BP230的自體抗體結合到BP180及BP230後,造成發炎反應以及BP180的分解,破壞了表皮與真皮間的黏附作用,導致水泡的生成。大多數類天皰瘡的自體抗體結合在BP180的NC16A的區域1(圖四)。
許多流行病學的研究發現,類天皰瘡與神經學方面的疾病相關,包括失智、腦中風、帕金森氏症、多發性硬化症等。高濃度的抗BP180自體抗體也被報導與嚴重的阿茲海默症失智有相關性2。目前抗BP180自體抗體的致病角色較抗BP230自體抗體明確。
參、 二肽基肽酶-4(dipeptidyl peptidase-4, DPP-4) 抑制劑介紹
DPP-4又名CD26,是一種肽酶
(protease),存在於許多器官及組織,包括腎臟、肝臟、腸胃道及骨髓,也表現在許多細胞表面,包括上皮細胞、基質細胞(stromal
cell)、T細胞、B細胞、自然殺手細胞、樹突狀細胞及巨噬細胞3。
人類進食時,小腸會分泌腸泌素 (incretins),主要包括葡萄糖依賴性促胰島素分泌胜肽
(glucose-dependent insulinotropic polypeptide,
GIP) 及類升糖素胜肽(glucagon-like peptide-1,
GLP-1)。這些胜肽的促胰島素分泌作用具有葡萄糖依賴的特性,會受到血中葡萄糖濃度的影響,因此較不會產生低血糖的副作用。GLP-1除了可促使胰臟的β細胞製造分泌胰島素,也會抑制胰臟的α細胞分泌升糖素,以降低肝醣生成作用,延緩胃排空的速率,減慢葡萄糖之吸收。GIP、GLP-1、趨化素
(chemokines)/細胞激素 (cytokines)、以及神經肽 (neuropeptides)
都是DPP-4的受質。GLP-1在體內會快速被DPP-4分解,使其無法與GLP-1受體結合,故半衰期僅有1到2分鐘。DPP-4抑制劑即是藉由抑制GLP-1被DPP-4分解,來延長GLP-1的作用時間。
另一方面,DPP-4與免疫系統間的作用是複雜的,跨膜型DPP-4作為細胞膜上的受體與它的配體 (ligand)
結合後,會啟動免疫細胞內的信號傳導路徑,藉由包括T細胞的活化、巨噬細胞的作用、細胞激素的分泌等,來調節免疫功能。最近的研究也發現,DPP-4調節功能的失衡,與多種自體免疫疾病的發生有關,例如:第一型糖尿病病人血清中DPP-4的活性是增加的;而在類風濕性關節炎、紅斑性狼瘡及發炎性腸道疾病病人,血清中DPP-4的濃度相較於健康人卻是低的4。
然而,近年來另有許多研究報導,如類天皰瘡、發炎性腸道疾病等自體免疫疾病案例的增加,卻發現也與使用DPP-4抑制劑相關5,6。2016年法國的研究人員,分析了法國藥品安全監視資料庫
(French Pharmacovigilance Database)
在2008年4月至2014年8月所有主動申報的1,297件與DPP-4抑制劑相關的不良事件中,類天皰瘡有42件,包括vildagliptin
31件、sitagliptin 10件、saxagliptin
1件。合併所有DPP-4抑制劑的通報勝算比 (Reporting Odds Ratio, ROR)
為67.5 (CI: 47.1-96.9),而vildagliptin的ROR為225.3
(CI: 148.9-340.9)、sitagliptin為17.0 (CI:
8.9-32.5)、saxagliptin為16.5
(2.3-119.1)。顯示使用DPP-4抑制劑發生類天皰瘡之風險是高的,且vildagliptin的風險大大地高於其他DPP-4抑制劑7。
在2016年,日本一個全國性的回溯性觀察研究收集了713位新診斷類天皰瘡的病人,其中與DPP-4抑制劑相關的有243位
(34.1%),觀察發現,這些有類天皰瘡的病人,最常用的DPP-4抑制劑也是vildagliptin
(37.2%),其次為linagliptin
(23.8%)。有79.9%的病人確診類天皰瘡之後即停藥,其中17.6%的人未使用類固醇或其他輔助藥物就自然痊癒。疾病達到控制的平均時間是2.87個月8。研究人員還發現,日本人DPP-4抑制劑相關的類天皰瘡
(DPP4i-related BP) 自體抗體,可能與藥物不相關的類天皰瘡
(drug-unrelated) 自體抗體結合到BP180的不同抗原表位 (epitopes)
6。
我國的研究人員亦曾經分析國人的健保資料,自2009年1月1日至2015年12月31日的7年追蹤期間,比較6,340位使用DPP-4抑制劑的病人與25,360位未使用DPP-4抑制劑的病人,觀察使用DPP-4抑制劑與發生類天皰瘡風險之間的關係。結果發現,使用DPP-4抑制劑確實比沒有使用該類藥物的糖尿病病人有較高發生類天皰瘡的風險。另比較國內現有的DPP-4抑制劑藥物,服用成分為vildagliptin的藥物,發生類天皰瘡的風險最高,其次為含saxagliptin的藥物。此外,年齡層大於65歲的病人風險更高9。
Sun等人也在2021年發表了一項回溯性分析,資料包括了在2006年至2021年5月中旬期間,使用DPP-4抑制劑發生類天皰瘡的許多案例報告及個別案例,結果發現發病的中位數在9個月
(介於0.5-59個月),最多人使用vildagliptin (52.63%),其次為linagliptin
(27.19%)。臨床上的症狀最多的是在體幹及四肢有緊實的水泡及紅斑。有64.06%的病人是anti-BP180自體抗體陽性、58.97%是BP180NC16A自體抗體陽性、31.25%是anti-BP230自體抗體陽性。有83.64%的病人在停用DPP-4抑制劑4個月後完全緩解
(介於0.13-72個月)10。
肆、類天皰瘡的藥物治療
類天皰瘡的致死率,大部分原因不是類天皰瘡的直接影響,而是感染的問題。因此,治療的目的在改善類天皰瘡造成的皮膚症狀,並減少感染的風險。依據許多臨床研究,大部分因為使用DPP-4抑制劑發生類天皰瘡的病人,停止繼續使用DPP-4抑制劑,對類天皰瘡的治療效果會比較好。
治療類天皰瘡的藥物,會包括用來抑制產生自體抗體的免疫抑制劑,以及預防及抑制感染造成發炎反應的抗生素。第一線的傳統局部及全身性類固醇,如clobetasol、prednisolone等,以及不斷推陳出新作為第二線輔助用藥的免疫抑制劑,如azathioprine、methotrexate、mycophenolate等,用於治療自體免疫疾病已為醫藥專業人員所熟知。有趣的是,四環黴素類
(tetracyclines) 也被列為是治療類天皰瘡的第一線藥物,單獨使用或合併菸鹼醯胺 (nicotinamide)
使用,在臨床上都被證實有療效。Tetracyclines及nicotinamide均屬於老藥新用,相當值得進一步了解。
Tetracyclines包括doxycycline、tetracycline及minocycline,是一類廣效的抗生素,除了長久以來被使用於治療革蘭氏陽性菌、陰性菌、立克次氏體及巨型濾過性病毒感染症外,於1970年代即有研究發現,tetracycline可以顯著地抑制顆粒性白血球的移行
(migration) 及趨化性 (chemotaxis),而降低皮膚的發炎反應11。近年來,tetracyclines也被發現具有免疫調節作用,雖然機轉尚未明確,但是它們應用在多種自體免疫疾病,如多發性硬化症、類風溼性關節炎、氣喘等,也能呈現治療效果12。
Nicotinamide即維生素B3,主要參與細胞的能量代謝、DNA的修復,以及基因轉錄過程的調節。在自體免疫水泡狀皮膚疾病的治療上,推論也是藉由其抗發炎的作用。它可以抑制的細胞激素,包括促發炎
(pro-inflammantory) 的介白素IL-1ß、IL-6、IL-8及腫瘤壞死因子 (TNF)。Nicotinamide的使用,被研究最多的也是類天皰瘡,它被認為可以作為類固醇保留劑
(steroid sparing agent),來減少類固醇的使用13。
伍、結論
類天皰瘡是好發於年長族群的自體免疫性皮膚疾病,一旦嚴重發作時,不僅是造成病人身心上的痛苦與折磨,也會增加照顧者的照護困難度。雖然,使用DPP-4抑制劑發生類天皰瘡是罕見的,作者希望藉由本文案例的分享,提醒醫療相關人員能及早發現此類病人,即時停止DPP-4抑制劑的使用,並給予其它治療藥物及傷口的完整照護,期能更有效改善病況,大幅提升病人的生活品質。
DPP-4 Inhibitor-associated Bullous Pemphigoid
Cheng-Si Wu1, Tsui-Yun Lo2, Ching-Cheng Yeh1, Ru-Liang Shih3
1Department of Pharmacy, Yonghe Cardinal Tien
Hospital
2Department of Nursing, Taipei city Zhishan
Senior Home
3Education and Research Department, Yonghe
Cardinal Tien Hospital
Abstract
Bullous pemphigoid (BP) is a rare autoimmune
skin disease that tends to occur more frequently
in the elderly. It is characterized by
autoantibody disruption of the connection
between basal keratinocytes and the basal
membrane, resulting in tense skin blisters that
could spread throughout the body, causing skin
ulceration and even predisposing to infection.
Hence, BP is a major burden for both patients
and caregivers. DPP-4 inhibitors are currently
one of the widely used hypoglycemic drugs.
However, medical professionals are generally
unaware that these inhibitors may cause adverse
reactions like BP. This article reports the case
of a resident in nursing institutions to
describe the association between DPP-4
inhibitors and BP and the novel use of
tetracyclines and nicotinamide in treating BP.
參考資料:
1. Nishie W: Update on the pathogenesis of
bullous pemphigoid: An autoantibody-mediated
blistering disease targeting collagen XVII.
Journal of Dermatological Science
2014;73(3):179–186, doi:
10.1016/j.jdermsci.2013.12.001.
2. Kokkonen N, Herukka S-K, Huilaja L, et al:
Increased Levels of the Bullous Pemphigoid BP180
Autoantibody Are Associated with More Severe
Dementia in Alzheimer's Disease. Journal of
Investigative Dermatology 2016, doi:
10.1016/j.jid.2016.09.010.
3. De Meester I, Korom S, Van Damme J, et al:
CD26, let it cut or cut it down,
1999;20(8):367–375, doi: 10.1016/s0167-5699
(99)01486-3.
4. Huang J, Liu X, Wei Y, et al: Emerging Role
of Dipeptidyl Peptidase-4 in Autoimmune Disease
Front Immunol, 2022;13:830863, doi:
10.3389/fimmu.2022.830863.
5. Roy A, Sahoo J, Narayanan N, et al:
Dipeptidyl peptidase-4 inhibitor-induced
autoimmune diseases: Current evidence. World J
Diabetes 2021;12(9):1426-1441, doi:
10.4239/wjd.v12.i9.1426.
6. Nishie W: Dipeptidyl peptidase IV
inhibitor-associated bullous pemphigoid: a
recently recognized autoimmune blistering
disease with unique clinical, immunological and
genetic characteristics. Immunological Medicine
2019;42(1):22–28, doi:
10.1080/25785826.2019.1619233.
7. Béné J, Moulis G, Bennani I, et al: Bullous
pemphigoid and dipeptidyl peptidase IV
inhibitors: a case-noncase study in the French
Pharmacovigilance Database. British Journal of
Dermatology 2016;175(2):296–301, doi:
10.1111/bjd.14601.
8. Sugiyama S, Yamamoto T, Aoyama Y: Clinical
features of dipeptidyl peptidase-4
inhibitor-associated bullous pemphigoid in
Japan: A nationwide retrospective observational
study. J. Dermatol 2022;49:697–702.
9. Hung CT, Liu JS, Cheng CY, et al: Increased
risk of bullous pemphigoid in dipeptidyl
peptidase 4 inhibitors: A nationwide,
population-based, cohort study in Taiwan. J.
Dermatol 2020;47:245–250, doi:
10.1111/1346-8138.15195.
10. Sun L, Wang C, Wu C, et al: Analysis of the
Clinical Characteristics of Dipeptidyl
Peptidase-4 Inhibitor–Induced Bullous Pemphigoid.
Annals of Pharmacotherapy 2021:106002802110227,
doi: 10.1177/10600280211022722.
11. Berk MA, Lorincz AL: The Treatment of
Bullous Pemphigoid With Tetracycline and
Niacinamide. A Preliminary Report. Arch Dermatol
1986;122(6):670-674, doi:
10.1001/archderm.1986.01660180076019.
12. Park CS, Kim SH, Lee CK: Immunotherapy of
Autoimmune Diseases with Nonantibiotic
Properties of Tetracyclines. Immune Netw
2020;20(6):e47, doi: 10.4110/in.2020.20.e47
13. Bains P, Kaur M, Kaur J, et al: Nicotinamide:
Mechanism of action and indications in
dermatology. Indian Journal of Dermatology,
Venereology and Leprology 2018;84(2):234-237.
通訊作者:吳承熹/電子信箱:b313103205@tmu.edu.tw