Atezolizumab與Bevacizumab於晚期
肝癌治療之效果與安全性探討
詹士萱、張筱琳
衛生福利部臺北醫院藥劑科
摘要
肝細胞癌(hepatocellular carcinoma, HCC),簡稱肝癌,是常見且死亡率高的癌症,雖然HCC早期可以手術、肝臟移植或局部治療,但大多數HCC病人不適用這些治療方式且預後不佳。Sorafenib和lenvatinib為治療晚期HCC的標靶藥物,也是長久以來晚期HCC的首選治療藥物,然而近年在癌症免疫治療的快速進展下,第三期臨床試驗IMbrave150證實了atezolizumab併用bevacizumab在晚期HCC病人的整體存活期、無惡化存活期和客觀反應率皆優於sorafenib,並開啟了以免疫檢查點抑制劑(immune
checkpoint inhibitor, ICI)為基礎的療法,突破性地成為治療晚期HCC的首選組合,本文將綜述atezolizumab併用bevacizumab在晚期HCC治療中的臨床試驗重點和真實世界研究結果,探討其治療晚期HCC的有效性和安全性,提供醫療人員晚期HCC病人治療照護的參考。
關鍵字: 肝細胞癌、hepatocellular
carcinoma、atezolizumab、bevacizumab
壹、前言
肝細胞癌(hepatocellular carcinoma, HCC)是台灣最常見的肝癌類型,為肝臟原發性惡性腫瘤,常見於B型肝炎及C型肝炎感染後之慢性肝病或肝硬化病人。根據世界衛生組織(WHO)的最新統計,HCC一年新增了905,677病例,為全球第五位最常見的癌症,也是癌症相關死亡的第三大原因1。根據衛生福利部最新年度死因統計結果分析,HCC於我國癌症死因排名第二位,每十萬人口中約有34人2。
HCC的治療方式包括手術、化療、標靶治療、放射治療等,過去HCC的治療效果並不理想,病人的存活率不高,且HCC通常無早期症狀,診斷時已處於晚期,因此不斷推陳出新各式新的治療方式。HCC的腫瘤微環境(tumor
microenvironment, TME)特徵具有高度的免疫浸潤,主要以免疫抑制和逃避及血管新生為主,這些特徵是以化療治療HCC效果不佳的原因之一。基於HCC的TME特徵,免疫檢查點抑制劑(immune
checkpoint inhibitor, ICI)及抗血管新生標靶藥物的合併療法成為了晚期HCC(advanced
HCC, aHCC)的一線治療組合3。
對於無法切除、經導管動脈化學藥物栓塞治療(Transcatheter Arterial
Chemoembolization, TACE)等失敗的aHCC病人,2023年第一版美國國家癌症資訊網(National
Comprehensive Cancer Network, NCCN)治療指引中4,第一線首選全身性藥物治療包含僅適用於Child-Pugh
class A 的病人atezolizumab併用bevacizumab(Atez/Bev)、tremelimumab併用durvalumab(Trem/Dur),其次是僅適用於Child-Pugh
class A 的病人sorafenib和lenvatinib和單方durvalumab或pembrolizumab;第二線全身性藥物治療包含regorafenib、cabozantinib、nivolumab和nivolumab併用ipilimumab、ramucirumab4等。在第一線全身性藥物治療中,sorafenib和其他支持性治療相比,中位數整體存活期(overall
survival, OS)約3個月,而lenvatinib於第三期臨床試驗結果不劣於sorafenib,然而近年在癌症免疫治療的快速進展下,Atez/Bev在第三期臨床試驗(IMbrave150)被證實相較於sorafenib有較好的中位數OS和無惡化存活期(progression
free survival, PFS);Trem/Dur也在第三期臨床試驗(HIMALAYA)被證實相較於sorafenib有更好的OS,因此Atez/Bev和Trem/Dur成為第一線全身性藥物治療中的優先選擇3。
目前尚無Atez/Bev和Trem/Dur直接比較的臨床試驗,IMbrave150中Atez/Bev的中位數OS為19.2個月,客觀反應率(objective
response rate, ORR)為30%5,6;HIMALAYA中Trem/Dur的中位數OS則為16.43個月,ORR為20%7,間接比較下Atez/Bev可能會是更有效的選擇,但因受試者族群和藥物導致的不良反應有所不同,因此選擇哪一種組合作為首選藥物治療的標準尚未確立。而本文將探討Atez/Bev合併治療在aHCC的有效性和安全性,提供醫療人員晚期HCC治療的參考。
貳、Atezolizumab和bevacizumab於HCC中的作用機轉
肝臟組織的慢性發炎會促進免疫調節的改變,也會誘導細胞死亡和再生導致肝硬化,並可能變成腫瘤。免疫抑制環境是HCC形成的關鍵,也是腫瘤惡化和轉移的重要因素。至今HCC的免疫治療基本原理是觀察到HCC可能因免疫細胞表現免疫檢查點分子(如programmed
cell death protein 1,
PD-1)而避開免疫系統。Atezolizumab是免疫檢查點單株抗體,藉由結合腫瘤細胞的PD-L1受體,去阻斷PD-L1與其受體PD-1和B7-1(CD80)結合。在沒有atezolizumab等藥物的抑制,PD-L1與PD-1的結合除了會抑制抗原特異性T細胞(antigen-specific
T-cell)的活化外,也會抑制T細胞增生、細胞因子產生和細胞溶解能力,導致T細胞失去活性。PD-L1與B7-1的結合則會下調節免疫反應,同樣抑制T細胞活化和細胞因子產生,進而使癌細胞無法被控制。
Bevacizumab是一種重組的單株抗體,可選擇性結合人類血管內皮生長因子(vascular
endothelial growth factor, VEGF),阻斷VEGF與其受體結合。因VEGF是HCC血管生成的重要介質,VEGF會抑制樹突細胞成熟、促進免疫抑制細胞浸潤和增強免疫檢查點分子的表現,故bevacizumab可減少腫瘤的血管形成和抑制腫瘤的生長8。
Atezolizumab和bevacizumab在免疫反應中控制不同步驟,bevacizumab因抑制VEGF可以降低VEGF調節的免疫抑制作用,
atezolizumab阻斷PD-L1與PD-1結合,進而恢復T細胞的活性和增生,使得抗腫瘤免疫反應被更加活化,因此atezolizumab和bevacizumab併用又具協同作用8。
參、Atezolizumab和bevacizumab於aHCC的有效性和安全性
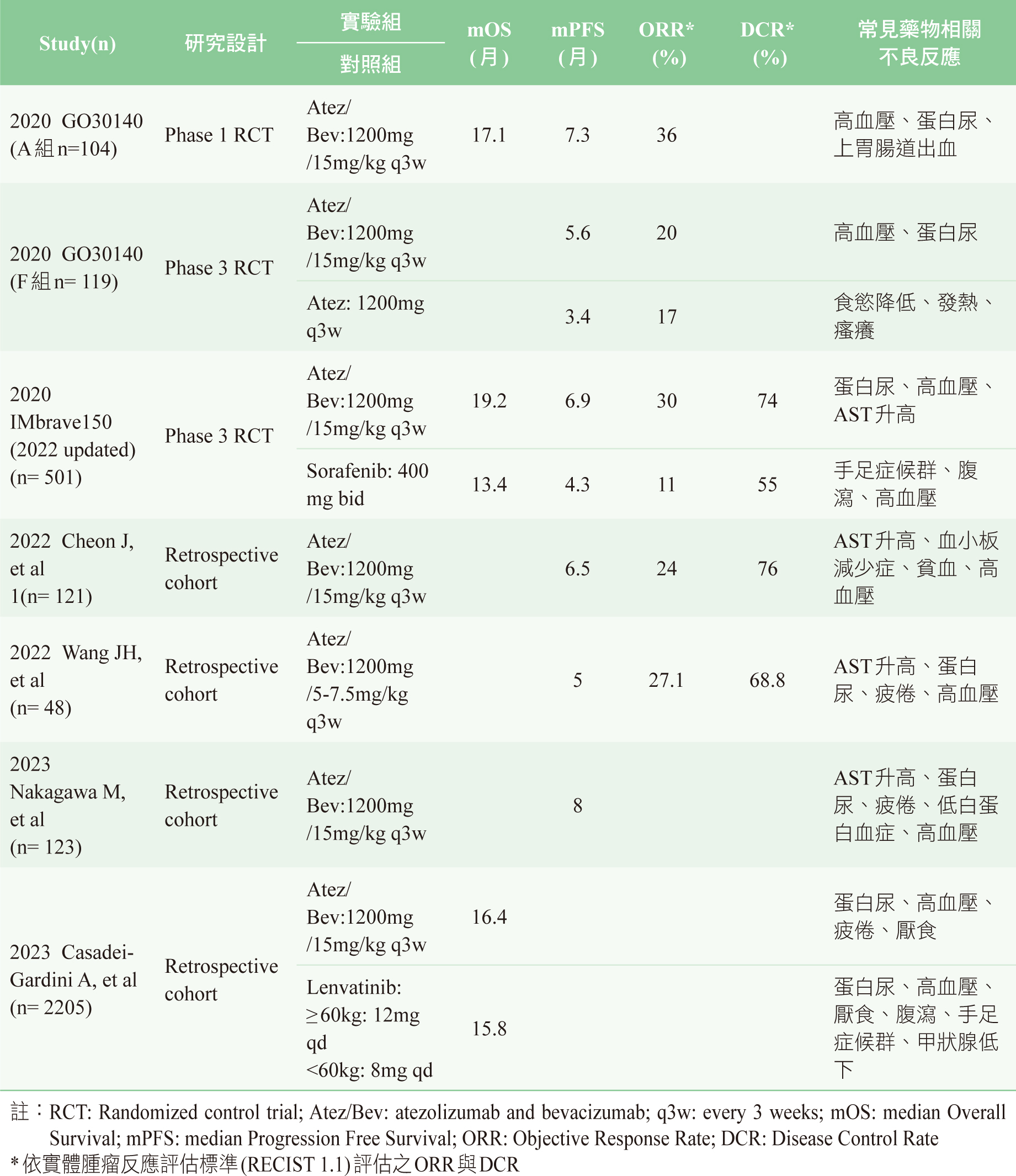
GO30140試驗是一隨機分派開放性、多中心、國際性的第一期臨床試驗。本研究中與HCC相關的群體(cohorts)為A組和F組,前者評估Atez/Bev的療效和安全性,後者比較Atez/Bev和atezolizumab單一治療的臨床表現。A組的中位追蹤時間為12.4個月,ORR為36%,中位數OS和PFS分別為17.1個月和7.3個月,最常見的藥物治療相關之不良反應(adverse
drug reaction, ADR)為高血壓(14 %)和蛋白尿(7%)。Grade
4以上的嚴重ADR則有24%,最常見的有上胃腸道出血、食道靜脈曲張出血和肺炎(pneumonia),而因嚴重ADR導致死亡有3%9。F組中中位追蹤時間約為6.6個月,而Atez/Bev顯著優於atezolizumab單一治療,前者中位數PFS為5.6個月,後者為3.4個月(HR
0.55, 80% CI: 0.4-0.74, p = 0.011)。高血壓(5
%)和蛋白尿(3%)為Atez/Bev組最常見的ADR,嚴重ADR於Atez/Bev組為12%,atezolizumab單獨使用組為3%,因嚴重ADR導致死亡則沒有發生。由此可見Atez/Bev相比單獨使用atezolizumab有較好的療效,而安全性部分Atez/Bev在ADR及嚴重ADR有明顯較高的發生率,這也成為IMbrave150排除治療或治療不完全的食道及胃靜脈曲張出血者或其高出血風險者的原因9。
Atez/Bev的療效成果進一步於IMbrave150被證實,此為一隨機分配、多中心、國際性、開放性的第三期臨床試驗,研究Atez/Bev對未曾接受過全身性療法且無法切除或轉移的aHCC之療效與安全性。研究結果顯示,Atez/Bev組中位數OS為19.2個月,sorafenib組為13.4個月,Atez/Bev可顯著延長OS達5.8個月(HR
0.66, 95% CI: 0.52-0.85, p < 0.001)。另外Atez/Bev組中位數PFS為6.9個月,sorafenib組為4.3個月,Atez/Bev組相較sorafenib組可顯著延長PFS(HR
0.65, 95% CI: 0.53-0.81, p <
0.001)並減少疾病進展和死亡風險達35%,而Atez/Bev組在ORR也顯著優於sorafenib組,兩組之間相差18%(95%
CI: 11-26, p < 0.001)。
Atez/Bev組最常見的ADR為蛋白尿(29%)、高血壓(28%)和aspartate
aminotransferase(AST)升高(16%),sorafenib則為手足症候群(48%)和腹瀉(44%)。因ADR需要停止治療的病人在Atez/Bev組為22%,sorafenib組為12%。另外,Atez/Bev組較sorafenib組亦能顯著延長病人生活品質(patient-reported
quality of life)的惡化(11.2個月vs. 3.6個月,HR 0.63, 95%
CI: 0.46-0.85)及顯著延長身體功能(physical
functioning)的惡化(13.1個月vs.4.9個月,HR 0.53, 95%CI:
0.39-0.73),由以上安全性資料顯示Atez/Bev治療的安全性被認為是可以接受的6。
後來Atez/Bev核准後於真實世界(real-world)的有效性及安全性之回溯性研究(retrospective
study)陸續被發表。
2022年韓國的回溯性研究(共121人)中病人對Atez/Bev的療效及安全性皆與IMbrave150的結果具一致性。此研究之中位追蹤時間為5.9個月,ORR為24%,中位數PFS為6.5個月。最常見的ADR為AST升高(10.7%)、血小板減少症(55.4%)、貧血(47.1%)
和高血壓(44.6%),而有12位病人中斷bevacizumab治療,主要原因為胃腸道出血和穿孔,這些都與IMbrave150的試驗結果相似。然而,此研究發現基線(baseline)中性白血球與淋巴球比值(neutrophil-to-lymphocyte
ratio, NLR)≥5的病人族群中有較差的PFS (NLR ≥5 vs NLR<5 ,
95% CI: 1.12-4.45, p=0.023),因此對於NLR較高的病人使用Atez/Bev治療的效果還需進一步研究10。
同年台灣的回溯性研究中探討Atez/Bev對aHCC病人的療效和安全性,以及NLR和血小板與淋巴球比值(platelet-to-lymphocyte
ratio, PLR)對aHCC病人預後的重要性。此研究的中位追蹤時間為9.5個月,ORR為27.1%,中位數PFS為5個月。最常見的ADR為AST升高(85.4%)、蛋白尿(35.4%)、疲倦(25.0%)
和高血壓(22.9%),且無因ADR需要停止治療的病人,所以Atez/Bev治療的安全性在此研究中的病人是可以接受的。另外,此研究發現病人族群中NLR≥3的病人和PLR≥230之的病人有較差的PFS,NLR≥3的PFS為2.9個月;NLR<3的PFS為9.6個
(HR 0.34, 95% CI: 0.14-0.84, p=0.019),PLR≥230的PFS為2.4個月;PLR<230的PFS為9.3個月(HR
0.36, 95% CI: 0.16-0.81, p=0.014),因此研究顯示NLR和PLR可以成為評估aHCC病人的預後因子,也支持了先前提到的韓國回溯性研究11。
2023年日本的回溯性研究中探討aHCC病人使用Atez/Bev治療之療效及安全性,中位追蹤時間為7.6個月,Atez/Bev相較二線及後線其他藥物治療可顯著延長PFS,Atez/Bev組中位數PFS為8個月,二線及後線其他藥物治療之中位數PFS則為4.1個月(p=0.005)。最常見的ADR為AST升高(54.5%)、蛋白尿(52.0%)、疲倦(49.6%)
、低白蛋白血症(43.9%)和高血壓(42.3%),而在Atez/Bev組中斷bevacizumab治療之主要原因跟其造成蛋白尿(15位)和出血(2位)有關。經進一步分析發現,在具有高血壓和/或糖尿病的病人群中,因bevacizumab相關不良反應而停止用藥者顯著較高(p=0.026),此外病人在24周內中斷bevacizumab治療者與持續治療的病人相比有較差的PFS
(p=0.013) 12。
在上述的回溯性研究中證實了Atez/Bev的有效性,而安全性部分除了大致與IMbrave150相同外,發現NLR和PLR較高及有高血壓和/或糖尿病病人的有效性還需要更多的研究來評估。
另一個2023年的跨國大型回溯性研究比較Atez/Bev與lenvatinib於aHCC病人的療效及安全性。研究結果顯示Atez/Bev的療效並沒有顯著優於lenvatinib,其中位數OS分別為
16.4個月及15.8個月( HR 0.97, 95% CI: 0.80, 1.17, p =
0.739);另外在次組分析中非酒精性脂肪性肝炎(nonalcoholic
steatohepatitis, NASH)及非酒精性脂肪肝疾病(non-alcoholic
fatty liver disease, NAFLD)的病人,lenvatinib的OS顯著優於Atez/Bev
(HR 1.88, 95% CI: 1.16, 3.01, p =
0.014),而在病毒性肝炎(B肝或C肝)病人的OS中Atez/Bev組顯著優於lenvatinib組(HR
0.76, 95% CI: 0.61, 0.96, p =
0.024)。至於安全性部分,Atez/Bev和lenvatinib相比,Atez/Bev的ADR顯著較低(OR:
0.41, 95% CI: 0.22, 0.77, p =
0.009),特別是有較低的厭食、腹瀉、手足症候群和甲狀腺低下的發生率。
此研究所得的Atez/Bev的療效在aHCC病人未優於lenvatinib。而若為NASH或NAFLD的aHCC病人選用lenvatinib治療的療效較佳,若為病毒性肝炎引起者選用Atez/Bev治療的效果會比較好,安全性方面Atez/Bev有較低的ADR13。
以Atez/Bev治療aHCC病人的相關研究之療效與不良反應彙整於表一。
表一 Atez/Bev於aHCC病人相關研究療效與不良反應
肆、Atezolizumab併用bevacizumab之潛在生物標記(biomarkers)
在HCC診斷及治療中最普遍參考的生物標記為基期AFP,而aHCC的免疫治療也有一些生物標記可以測得病人藥物治療的療效,像是PD-L1表現的基線、C反應蛋白(C-Reactive
protein, CRP)、NLR、PLR、轉化生長因子β(transforming
growth factor-β, TGF-β)和進入血液循環的癌細胞及癌細胞的DNA(circulating
tumor DNA, ctDNA),其中可以被用來參考評估Atez/Bev治療結果的生物標記有PD-L1表現、ctDNA、NLR和PLR。從atezolizumab作用機轉可知PD-L1與Atez結合後會使抗腫瘤反應活化,因此PD-L1表現較高的病人使用atezolizumab治療可以達到較好的效果。ctDNA部分則於GO30140試驗中發現,
ctDNA基線表現較高的病人在使用Atez/Bev治療3個療程後,隨著ctDNA降低至呈現陰性反應有較好的PFS(p<0.00029),而NLR和PLR則已於前面韓國及台灣的回溯性研究中提及。另外,Atez/Bev治療在肝臟腫瘤組織中也有相關的生物標記,有一項研究整合了GO30140和IMbrave150中aHCC病人之腫瘤活體組織檢查的數據,分別發現腫瘤微環境中CD8+
T細胞和CD3+T細胞較高或浸潤、帶有ARBS或Teff基因特徵、TERT啟動子突變和CTNNB1突變的病人,皆對Atez/Bev治療有較高的反應14。
伍、未來展望
Atez/Bev治療aHCC尚有很多研究正在進行,有非常多不同臨床特性的病人族群需要進一步的研究來評估,像是AMETHISTA臨床試驗就收錄了使用抗反轉錄病毒治療穩定和檢測不到病毒量的HIV病人,研究此類族群使用Atez/Bev治療aHCC的療性及安全性15。DEMAND臨床試驗則研究HCC以Atez/Bev治療時同步進行TACE是否可以減少正常肝臟組織所附帶的損傷風險16。此外,有效性及安全性也需要更多來自真實世界的研究數據作為Atez/Bev治療aHCC的參考。
陸、總結
Atez/Bev的合併治療對aHCC是一個重大突破,IMbrave150試驗證實了Atez/Bev在OS、PFS和ORR皆優於以往的首選藥物sorafenib,許多真實世界研究也支持其研究結果,對於aHCC病人而言提供了一個新的治療選擇,也可以知道ICIs的合併療法將是HCC未來的治療趨勢,期待有更多病人能受益。
Efficacy and
Safety of Atezolizumab plus Bevacizumab in
Patients with Advanced
Hepatocellular Carcinoma
Shih-Hsuan Chan, Hsiao-Lin Chang
Department of Pharmacy, Taipei Hospital,
Ministry of Health and Welfare
Abstract
Hepatocellular carcinoma (HCC) is a common
cancer with high mortality. Even though
early-stage HCC may be treated by resection,
liver transplantation, or ablation, most
patients are not eligible for these treatments
and have a poor prognosis. Sorafenib and
lenvatinib as targeted therapy were the
first-line treatments for advanced
hepatocellular carcinoma. However,
immunotherapies of cancer treatment are under
rapid development. The phase III IMbrave150
study confirmed that the combination of
atezolizumab and bevacizumab had significantly
superior overall survival, progression-free
survival and objective response rate than
sorafenib in patients with advanced HCC. This
treatment combination has set the foundation and
revolutionized the treatment landscape of
advanced HCC with immune-based combinations.
This article will review the clinical trials and
real world studies of the combination of
atezolizumab and bevacizumab for treating
advanced HCC, and evaluate its efficacy and
safety in an attempt to provide medical
professionals a reference for the treatment and
care for patients with advanced HCC.
參考資料:
1. International Agency for Research on Cancer
,WHO. (December, 2020) Liver and intrahepatic
bile ducts fact sheets. Retrieved March 1, 2023,
from https://gco.iarc.fr/today/data/factsheets/cancers/11-Liver-fact-sheet.pdf
2. 衛生福利部統計處:110年死因統計結果分析。臺北:衛生福利部2021。
3. Tella SH, Kommalapati A, Mahipal A, et al.:
First-Line Targeted Therapy for Hepatocellular
Carcinoma: Role of Atezolizumab/Bevacizumab
Combination. Biomedicines 2022 Jun;10(6): 1304
4. National Comprehensive Cancer Network (NCCN).
(March 10, 2023) NCCN Clinical Practice
Guidelines in Oncology. Hepatobiliary Cancers
Version 1.2023. Retrieved March 21, 2023, from
https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1438
5. Finn RS, Qin S, Ikeda M, et al.: Atezolizumab
plus Bevacizumab in Unresectable Hepatocellular
Carcinoma. N Engl J Med 2020;382(20): 1894-1905.
6. Cheng A L, Qin S, Ikeda M, et al.: Updated
efficacy and safety data from IMbrave150:
Atezolizumab plus bevacizumab vs. sorafenib for
unresectable hepatocellular carcinoma. J Hepatol
2022;76(4): 862-873.
7. Abou-Alfa GK, Lau G, Kudo M, et al.:
Tremelimumab Plus Durvalumab in Unresectable
Hepatocellular Carcinoma. N Engl J Evid
2022;1(8):1-12.
8. Liu X, Lu Y, Qin S: Atezolizumab and
bevacizumab for hepatocellular carcinoma:
mechanism, pharmacokinetics and future treatment
strategies. Future Oncol 2021;17(17): 2243-2256.
9. Lee MS, Ryoo BY, Hsu CH, et al.: Atezolizumab
with or without bevacizumab in unresectable
hepatocellular carcinoma (GO30140): an
open-label, multicentre, phase 1b study. Lancet
Oncol 2020;21(6): 808-820.
10. Cheon J, Yoo C, Hong JY, et al.: Efficacy
and safety of atezolizumab plus bevacizumab in
Korean patients with advanced hepatocellular
carcinoma. Liver Int 2022;42(3): 674-681.
11. Wang JH, Chen YY, Kee KM, et al.: The
Prognostic Value of Neutrophil-to-Lymphocyte
Ratio and Platelet-to-Lymphocyte Ratio in
Patients with Hepatocellular Carcinoma Receiving
Atezolizumab Plus Bevacizumab. Cancers
2022;14(343):1-13.
12. Nakagawa M, Inoue M, Ogasawara S, et al.:
Clinical effects and emerging issues of
atezolizumab plus bevacizumab in patients with
advanced hepatocellular carcinoma from Japanese
real-world practice. Cancer 2023;129(4):590-599.
13. Casadei-Gardini A, Rimini M, Tada T, et al.:
Atezolizumab plus bevacizumab versus lenvatinib
for unresectable hepatocellular carcinoma: a
large real-life worldwide population. Eur J
Cancer 2023;180:9-20.
14. Peng X, Gong C, Zhang W, et al.: Advanced
development of biomarkers for immunotherapy in
hepatocellular carcinoma. Front Oncol
2023;12:1091088.
15. National Institutes of Health.
ClinicalTrials.gov. Retrieved March 1, 2023,
from https://clinicaltrials.gov/ct2/show/NCT04487067
16. National Institutes of Health.
ClinicalTrials.gov. Retrieved March 1, 2023,
from https://clinicaltrials.gov/ct2/show/NCT04224636
通訊作者:詹士萱/電子信箱:katherine0909880@gmail.com