淺談A型免疫球蛋白腎病變之治療
楊凱婷1、黃鏘綺2、吳承誌1、劉淑貞1
1高雄長庚紀念醫院藥劑部、2高雄長庚紀念醫院腎臟科
摘要
A型免疫球蛋白腎病變(Immunoglobulin A nephropathy, IgAN)是最常見的原發性腎絲球性腎炎(primary
glomerulonephritis),通常發生於20-40歲之間,但也可能在任何年齡出現;IgAN病程進展緩慢,並可能在數年內逐漸惡化。與其他腎絲球性腎炎治療方式不同,IgAN的治療主要以支持性療法為主,2021年KDIGO更新IgAN治療方式,另外有臨床試驗研究結果顯示SGLT2抑制劑(sodium-glucose
co-transporter 2 inhibitors)用於治療IgAN有著不錯的試驗結果,本文將進一步探討A型免疫球蛋白腎病變最新治療方向。
關鍵字: A型免疫球蛋白、Immunoglobulin A
nephropathy、IgAN、Berger's病
壹、 簡介
A型免疫球蛋白腎病變(Immunoglobulin A nephropathy, IgAN),又稱為Berger's病,是一種常見的原發性腎絲球性腎炎。雖然IgAN病程通常緩慢,但仍有30-40%的患者在20-30年後會進入末期腎臟病(end-stage
renal disease,
ESRD)1,2。常見的症狀包括腰痛、尿血、夜尿增多、腹部腫脹、頭痛和暈眩。現階段對IgAN的發病機制尚未完全釐清,目前研究傾向是自體免疫或感染因素,使得IgA免疫複合物(immune-complex)在腎絲球系膜(mesangium)細胞中沉積,進而引起炎症和腎臟組織損害3。
貳、 臨床症狀與診斷
IgAN的臨床症狀表現非常廣泛,從無症狀的顯微性血尿 (microscopic
hematuria)、持續性蛋白尿(proteinuria)至腎功能快速惡化都是臨床表徵。IgAN僅能使用腎臟活體組織切片(biopsy),搭配免疫組織化學染色法(immunohistochemical
stains)以及免疫螢光顯微鏡術(immunofluorescence
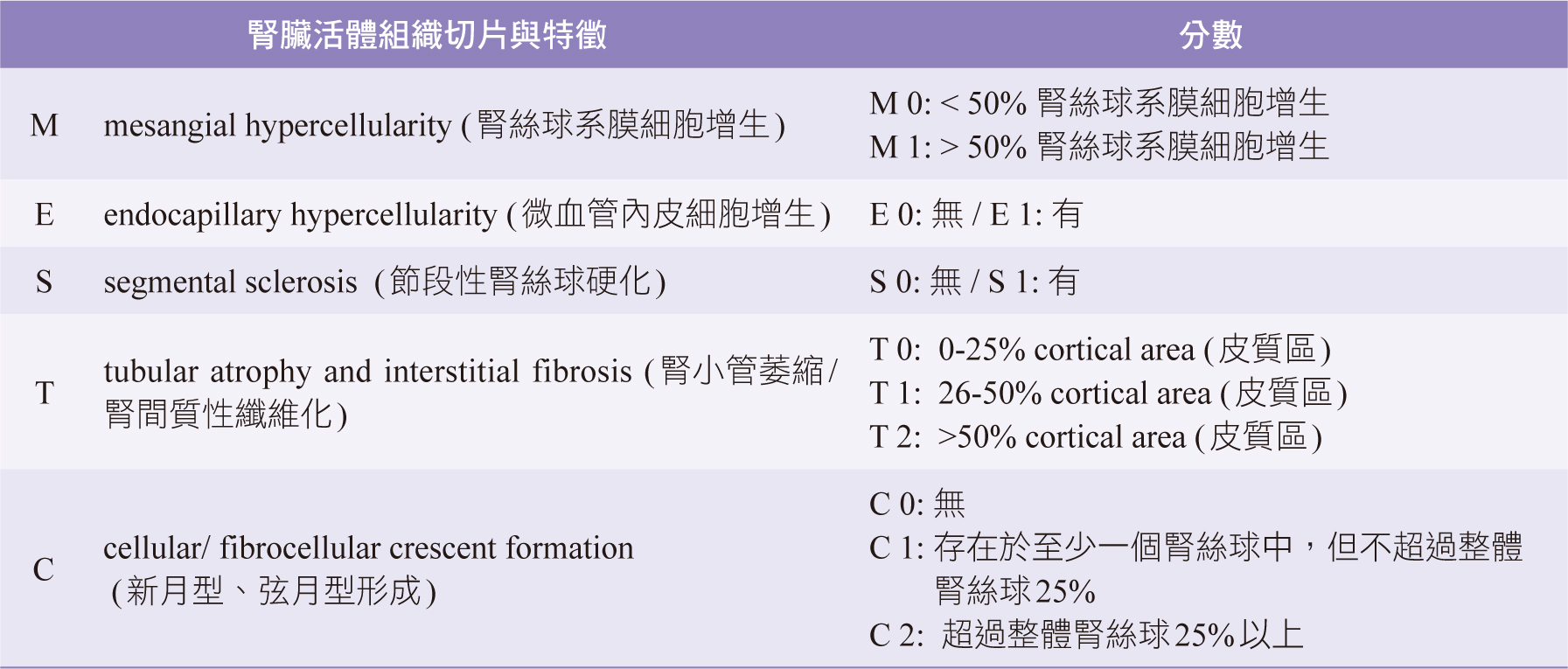
microscopy)作疾病診斷。並使用MEST-C分類法(表一)評估腎臟切片結果3,KDIGO指引也建議可搭配國際IgAN預測工具,預測未來患者eGFR下降至50%或是進入ESRD的機率4,5。
表一 牛津分類(Oxford Classification) -MEST-C分類法(MEST-C
Criteria)4
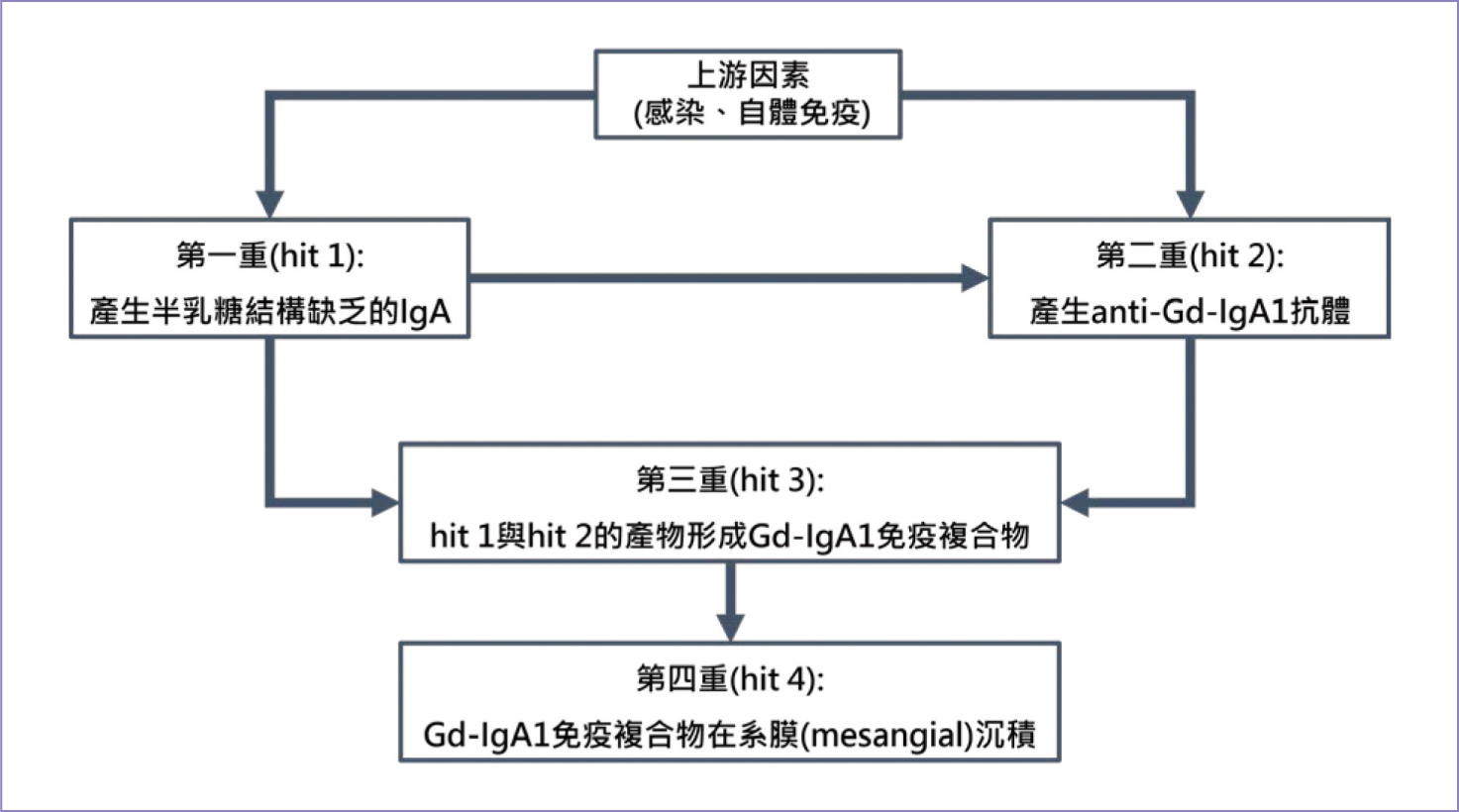
參、 致病機轉
IgAN的致病機轉仍尚未完全釐清,目前研究以多重打擊理論(multi-hit
hypothesis)來解釋其致病機轉。第一重(hit 1):人體產生半乳糖結構缺乏的IgA (galactose-deficient
IgA1, Gd-IgA1),第二重(hit
2):Gd-IgA1觸發免疫反應,產生anti-Gd-IgA1抗體,第三重(hit-3):hit
1與hit 2的產物形成Gd-IgA1免疫複合物,第四重(hit 4):
Gd-IgA1免疫複合物無法完全被清除,便沉積於系膜中(圖一),使補體系統(complement
system)被活化,進一步引發免疫反應並造成腎功能損害,逐漸影響腎臟過濾能力1,3,6。
圖一 IgAN多重打擊理論(multi-hit hypothesis)1
肆、 流行病學
IgAN為最常見的原發性腎絲球性腎炎,先前一篇系統性回顧(Systematic
review)其研究結果顯示IgAN每年的發生率,每十萬人中至少2.5例,另外在次分析的研究結果觀察到,北美洲和歐洲的患病率較低,東亞國家的患病率最高,但該份研究僅納入一份亞洲國家的的研究資料,其他大多源自於歐洲與北美洲2,7,近期一份研究納入更多地區,研究結果顯示每年的發生率為每10萬人中有2-10例2。造成此差異的原因,可以用地區之間的健康篩檢政策和組織切片的施行率做解釋8,另也有研究指出,遺傳學也可能有所影響1,2。除了每年發病率在區域間的差異外,IgAN於原發性腎絲球性腎炎所佔的比例,在不同區域間也有很大的差異,研究顯示,中東地區為5%、歐洲地區為10-35%、東亞洲地區32–54%,而中國甚至高達50%9。另一份研究以性別比下去做分析,觀察到在不同地區的性別間的發生率會有所差異,歐洲地區的男女比例為3:1,而東亞地區為1:12。
伍、 臨床表徵
IgAN患者可能會出現一系列臨床表現,從無症狀的顯微鏡下血尿到快速進行性腎絲球腎炎(rapidly
progressive glomerulonephritis, RPGN)。一些研究結果顯示,南亞或東亞血統的IgAN患者,有較高機率表現出更嚴重的臨床表徵,且進展至ESRD階段的風險較高10。
一、 肉眼可見的血尿約 (40%-50%)
患者會出現一次或反覆發作的肉眼可見血尿,通常伴隨上呼吸道感染。
二、 顯微鏡下血尿,不一定伴隨蛋白尿 (30%-40%)
多是在慢性腎臟病診斷或常規檢查期間,於鏡檢下觀察到血尿伴隨輕度蛋白尿。
三、 腎病症候群(nephrotic syndrome)或快速進行性腎絲球腎炎 (<10%)
患者表現為腎病症候群或快速進行性腎絲球腎炎,其特徵為水腫、高血壓、腎功能損害以及血尿。極少數情況下,IgAN可能表現為惡性高血壓。
四、 急性腎損傷 (Acute kidney injury, AKI)
極少數情況下,患者會出現急性腎損傷。
陸、 IgAN分類
一、 原發性IgAN (primary IgA nephropathy)
佔IgAN最大宗,無明確的致病原因或潛在因素造成IgA免疫複合物在腎絲球腎系膜細胞中沉積,導致腎絲球腎系膜增生2。
二、 次發性IgAN (secondary IgA nephropathy)
臨床上較為少見,目前研究認為是由患者自身臨床疾病所導致,例如:胃腸病和肝臟疾病、病毒感染、自身免疫疾病、麩質敏感性腸病(celiac
disease)、呼吸道疾病和腫瘤。次發性IgAN的治療方向則是以治臨床疾病為主,藉由疾病的改善以減少蛋白尿蛋產生2,11。
柒、 IgAN治療
許多研究顯示血壓控制與蛋白尿減少,可減緩慢性腎臟病(chronic kidney
disease, CKD)患者的腎臟疾病進展12,因此IgAN治療方向以支持性療法(Comprehensive
care)為主,例如血壓控制、尿蛋白減少與生活型態改變,例如:(鹽分攝取控制、戒菸、體重控制以及運動)為主5。
一、 飲食
(一) 低鹽飲食(low-sodium diet):<2.0 g/天 (<90 mmol/天)。
(二) 蛋白質
1. 基於患者蛋白尿程度
腎病程度蛋白尿患者,以植物性飲食(plant-based
diet)為主較為適合,每日蛋白質攝取量0.8 -1g/kg (以理想體重作計算)。
2. 基於患者腎功能程度
當eGFR<60 ml/min/1.73 m2且伴隨腎病程度蛋白尿,每日蛋白質攝取量至多或將目標訂為0.8
g/k,但為避免引起營養不良的風險,不建議小於0.6
g/kg/天,並建議蛋白質來源以蔬菜或植物類為主。
二、 藥物治療
(一) 腎素-血管張力素-醛固酮系統阻斷劑 (RAS blockade)
該類藥物腎臟保護機轉為藉由阻斷腎素-血管張力素-醛固酮系統(renin-angiotensin-aldosterone
system, RAAS),擴張出球小動脈(efferent
arterioles),降低腎絲球後負荷(afterload)13。2021
KDIGO指引建議患者需進行血壓控制: 蛋白尿≤ 1 克/天,其收縮壓(SBP)目標為< 130
mmHg;而蛋白尿>1 克/天,收縮壓則建議控制在125 mmHg以下;且蛋白尿>0.5
克/天時,以angiotensin-converting enzyme Inhibitors (ACEI)或angiotensin
receptor blockers (ARBs)作為初始治療,並建議可給予至身體能承受的最高劑量,以減少蛋白尿。另外,指引更建議不論患者是否有罹患高血壓,當蛋白尿>0.5
克/天時,皆可使用ACEI或ARBs,但仍需注意該類藥物有引起高血鉀的風險,因此使用該類藥物時,建議定期檢測血鉀濃度2,5,9。
(二) 醣皮質類固醇(glucocorticoid)
IgAN發病機制主要是一個炎症過程,而醣皮質類固醇作為一種非特異性免疫抑制劑,可以抑制發炎反應,同時抑制免疫細胞的增殖和活化,進而減少免疫反應,緩解腎臟組織的損傷14。有鑒於安全性與效益,指引建議使用優化支持性療法3個月以上,蛋白尿仍每天大於1克的患者,可以考慮使用醣質類固醇(glucocorticoid)進行6個月療程治療。且須與患者討論使用醣質類固醇時,可能發生風險與益處,例如:潛在感染、骨質疏鬆症(osteoporosis),尤其是eGFR
<50 ml/min per 1.73 m2患者,更可能發生不良反應。另外GFR
<30 ml/min/1.73 m2的臨床益處尚未確定,因此該類族群在使用時須審慎評估或避免使用5。
(三) 其他
1. SGLT2抑制劑(sodium-glucose cotransporter 2
inhibitors)
目前對於SGLT2抑制劑在腎功能保護的機轉尚未完全了解,現有的研究認為該類藥物能透過改善腎絲球超過濾(glomerular
hyperfiltration)和腎缺氧(kidney
hypoxia)的情況,達到保護腎功能的效果。腎絲球超過濾是導致蛋白尿和eGFR下降的因素之一,而SGLT2抑制劑則可以減少近曲小管SGLT2受體對鈉離子的回收,增加緻密斑(macula
densa)細胞鈉離子濃度,進而恢復腎小管腎絲球回饋機制(tubuloglomerular
feedback, TGF),使入球小動脈(afferent arterioles)收縮15-17。此外,還有研究認為SGLT2抑制劑能透過減少鈉和葡萄糖的重吸收,改善腎缺氧情況,降低腎小管負擔,進而減少腎臟的損傷16。
DAPA-CKD (dapagliflozin in patients with chronic
kidney disease)
trial,是一項多國、多中心、雙盲、安慰劑與對照組、隨機分派研究,共270位IgAN患者參與此次試驗,其收納條件為:
eGFR 25-75 mL/min/1.73m2且尿液白蛋白與肌酐比值(urinary
albumin-to-creatinine ratio, UACR) 200-5000
mg/g,並且使用ACEI或ARB至少4週,試驗主要複合性指標為eGFR持續下降至50%、患者進入ESKD以及腎病或心血管疾病引起之死亡,dapagliflozin與安慰劑組人數分別為137人與133人,追蹤平均年限為2.1年,主要複合式評估指標試驗結果:
dapagliflozin組為6位受試者(4%),安慰劑組為20位受試者(15%) (風險比
0.29,95% 信賴區間0.12–0.73,P =0.005);eGFR一年平均下降率在dapagliflozin組與安慰劑組,分別為3.5與4.7
mL/min/1.73m2;而尿中白蛋白(albumin-creatinine
ratio, ACR)方面,dapagliflozin組較安慰組減少26%,兩組的不良事件發生率相似18。
2. Mycophenolate mofetil (MMF)
一項研究觀察到血清中的介白素-6 (Interleukin-6,
IL-6)濃度與蛋白尿量呈正相關係,而MMF可通過抑制IL-6合成間接降低蛋白尿的產生19;此外,有研究指出IgAN與B細胞過度活化有關,MMF可選擇性抑制T細胞與B細胞的活化和增殖,從而減少炎症因子和腎絲球損傷的產生20-22。中國患者可以考慮使用MMF作為醣皮質激素保留劑
(steroid-sparing agents);但在非中國患者中卻沒有證據顯示MMF單獨使用的效益。另外需注意不應用於已懷孕或可能懷孕患者5。
3. Hydroxychloroquine (HCQ)
目前,關於HCQ對於IgA腎病患者減少蛋白尿的機制尚未完全釐清。然而,有些研究認為類鐸受體(toll-like
receptor, TLR)的訊號異常與IgAN有關,而HCQ可能通過直接結合核酸(nucleic
acids)來阻斷TLR信號傳遞;此外,HCQ也可能通過抑制TLR通路來抑制細胞激素(cytokine)的產生23,24。一篇在中國進行的隨機對照試驗(randomized
controlled trial, RCT),此次試驗收納60位IgAN受試者,試驗分成HCQ合併ACEI或ARB與單用ACEI或ARB,主要終點指標為第六個月後的蛋白尿百分比變化,試驗結果HCQ
組與安慰組百分比變化分別為-48.4% (四分位距,-64.2%,-30.5%) 與 10.0%
(四分位距,-38.7% , 30.6%), P < 0.001。由試驗結果可以觀察到HCQ
組的百分比變化高於安慰劑組,雖然研究結果指出合併使用HCQ有助於減少蛋白尿,但此份試驗僅6個月且僅限於中國患者,因此對於CKD進展的長期益處尚不清楚,仍需待進行長期且多種族的試驗後,才能更清楚HCQ的治療效益5,25。
捌、 結論
2021年,KDIGO更新了A型免疫球蛋白腎病變的治療指引,對於藥物治療部分進行了一些調整與刪減,例如:不再建議患者使用魚油;但整體治療方向仍以支持性療法為主。近期的DAPA-CKD試驗表明,SGLT2抑制劑有助於減少尿液中蛋白的產生,並趨緩eGFR下降。美國食品藥物管理局(FDA)和歐洲藥品管理局(EMA)已批准使用dapagliflozin可以用於CKD患者,無論是否罹患第二型糖尿病,因此,SGLT2抑制劑在未來很可能被納入IgAN的治療指引中。
IgAN的病程進展緩慢,但近四成的患者最終會進入ESRD。因此,除了生活型態控制外,適時地使用藥物治療亦可以減緩IgAN病程。在這個過程中,藥師可以提供患者相關的衛教資訊,一同守護患者的健康福祉。
A Brief Discussion on the
Treatment of Immunoglobulin A Nephropathy
Kan-Ting Yang1, Chiang-Chi Huang2,
Cheng-Chih Wu1, Shu-Chen Liu1
1Department of Pharmacy, Kaohsiung
Chang Gung Memorial Hospital
2Department of Internal Medicine,
Division of Nephrology, Kaohsiung Chang Gung
Memorial Hospital
Abstract
Immunoglobulin A nephropathy (IgAN) is the most
common primary glomerulonephritis, which
typically occurs between the ages of 20 and 40,
but can also occur at any age. The course of
IgAN is usually slow and may gradually worsen
over several years. Unlike other
glomerulonephritis, the treatment of IgAN was
supportive care. The 2021 KDIGO guidelines have
updated the latest therapy for IgAN. In
addition, clinical trial results have shown that
the use of SGLT2 inhibitors (sodium-glucose
co-transporter 2) has good results in the
treatment of IgAN. This article will explore the
newest treatments for immunoglobulin A
nephropathy.
參考資料:
1. Lai, K.N., et al., IgA nephropathy. Nature
reviews Disease primers, 2016. 2(1): p. 1-20.
2. Rajasekaran, A., B.A. Julian, and D.V. Rizk,
IgA Nephropathy: An Interesting Autoimmune
Kidney Disease. Am J Med Sci, 2021. 361(2): p.
176-194.
3. Hassler, J.R., IgA nephropathy: A brief
review. Semin Diagn Pathol, 2020. 37(3): p.
143-147.
4. Trimarchi, H., et al., Oxford classification
of IgA nephropathy 2016: an update from the IgA
nephropathy classification working group. Kidney
international, 2017. 91(5): p. 1014-1021.
5. Kidney Disease: Improving Global Outcomes
Glomerular Diseases Work, G., KDIGO 2021
Clinical Practice Guideline for the Management
of Glomerular Diseases. Kidney Int, 2021.
100(4S): p. S1-S276.
6. Rodrigues, J.C., M. Haas, and H.N. Reich, IgA
Nephropathy. Clin J Am Soc Nephrol, 2017. 12(4):
p. 677-686.
7. Rodrigues, J.C., M. Haas, and H.N. Reich, IgA
nephropathy. Clinical Journal of the American
Society of Nephrology, 2017. 12(4): p. 677-686.
8. Schena, F.P. and I. Nistor, Epidemiology of
IgA Nephropathy: A Global Perspective. Semin
Nephrol, 2018. 38(5): p. 435-442.
9. Magistroni, R., et al., New developments in
the genetics, pathogenesis, and therapy of IgA
nephropathy. Kidney Int, 2015. 88(5): p. 974-89.
10. Chee Kay Cheung, P., MRCP, Jonathan Barratt,
PhD, FRCP, IgA nephropathy: Clinical features
and diagnosis, in UpToDate https://www.uptodate.com/contents/iga-nephropathy-clinical-features-and-diagnosis
(Accessed on January 24, 2023). 2022.
11. Saha, M.K., et al., Secondary IgA
nephropathy. Kidney Int, 2018. 94(4): p.
674-681.
12. Xie, X., et al., Renin-angiotensin system
inhibitors and kidney and cardiovascular
outcomes in patients with CKD: a Bayesian
network meta-analysis of randomized clinical
trials. American Journal of Kidney Diseases,
2016. 67(5): p. 728-741.
13. Anders, H.-J., J.M. Davis, and K. Thurau,
Nephron protection in diabetic kidney disease.
New England journal of medicine, 2016. 375(21):
p. 2096-2098.
14. Habas, E., et al., IgA nephropathy
pathogenesis and therapy: Review & updates.
Medicine (Baltimore), 2022. 101(48): p. e31219.
15. Yamazaki, T., et al., Treatment of Diabetic
Kidney Disease: Current and Future. Diabetes
Metab J, 2021. 45(1): p. 11-26.
16. Tuttle, K.R., et al., SGLT2 Inhibition for
CKD and Cardiovascular Disease in Type 2
Diabetes: Report of a Scientific Workshop
Sponsored by the National Kidney Foundation.
Diabetes, 2021. 70(1): p. 1-16.
17. Vallon, V. and S. Verma, Effects of SGLT2
Inhibitors on Kidney and Cardiovascular
Function. Annu Rev Physiol, 2021. 83: p.
503-528.
18. Wheeler, D.C., et al., A pre-specified
analysis of the DAPA-CKD trial demonstrates the
effects of dapagliflozin on major adverse kidney
events in patients with IgA nephropathy. Kidney
Int, 2021. 100(1): p. 215-224.
19. Tang, S., et al., Mycophenolate mofetil
alleviates persistent proteinuria in IgA
nephropathy. Kidney Int, 2005. 68(2): p. 802-12.
20. Tang, S.C., et al., Long-term study of
mycophenolate mofetil treatment in IgA
nephropathy. Kidney Int, 2010. 77(6): p. 543-9.
21. Du, B., et al., Efficacy and safety of
mycophenolate mofetil in patients with IgA
nephropathy: an update meta-analysis. BMC
Nephrol, 2017. 18(1): p. 245.
22. Hou, F.F., et al., Effectiveness of
Mycophenolate Mofetil Among Patients With
Progressive IgA Nephropathy: A Randomized
Clinical Trial. JAMA Netw Open, 2023. 6(2): p.
e2254054.
23. Zhang, J., et al., Effects of
Hydroxychloroquine on Proteinuria in IgA
Nephropathy: A Systematic Review and
Meta-Analysis. Biomed Res Int, 2021. 2021: p.
9171715.
24. Stefan, G. and G. Mircescu,
Hydroxychloroquine in IgA nephropathy: a
systematic review. Ren Fail, 2021. 43(1): p.
1520-1527.
25. Liu, L.J., et al., Effects of
Hydroxychloroquine on Proteinuria in IgA
Nephropathy: A Randomized Controlled Trial. Am J
Kidney Dis, 2019. 74(1): p. 15-22.