乾癬新外用療法-Tapinarof
謝倩玲1、吳俊男1、李建瑩1,2、蕭鈞百3
1中山醫學大學附設醫院藥劑科、2中山醫學大學藥理學科、3大里仁愛醫院藥劑科
摘要
乾癬是一種慢性免疫相關的皮膚疾病,對患者的生活質量有顯著影響,其中斑塊型乾癬(plaque
psoriasis)是最常見的類型。輕度至中度乾癬最常用的外用藥物包括局部性皮質類固醇(topical
corticosteroids, TCS)、維生素D衍生物(如calcipotriene,
calcitriol)、維生素A衍生物(如tazarotene)。儘管現有的局部療法是有效的,但使用上還是有其限制。斑塊型乾癬需要新的和有效的局部治療選擇。Tapinarof是一種芳香烴受體(aryl
hydrocarbon receptor, AhR)調節劑(agonist),可誘導抗氧化、免疫調節和表皮分化調節,促進皮膚屏障正常化。本文將綜述此藥物的臨床治療資訊及臨床試驗結果,提供大家參考。
關鍵字: 斑塊型乾癬、plaque psoriasis、tapinarof
壹、前言
乾癬(又稱牛皮癬或銀屑病,
psoriasis)是個常見、與免疫有關的慢性皮膚發炎疾病,被認為是一種「全身性發炎疾病」,它主要是因為角質細胞(keratinocyte)過度增生,導致皮膚搔癢、出現鱗狀斑塊和發炎的情形,其中以斑塊型乾癬(plaque
psoriasis)是最常見的類型,約占80%1。其病徵表現為界限清楚之突起紅色斑塊,通常對稱分佈於手肘關節、膝關節、頭皮與背上,合併厚層皮屑。乾癬的其他類型包括水滴狀乾癬(guttate
psoriasis)、紅皮症乾癬(erythrodermic psoriasis)和膿皰症乾癬(pustular
psoriasis)。根據健保資料庫的研究顯示,台灣乾癬的盛行率為0.235%。而在年齡層方面,介於30-39歲以及50-69歲是乾癬好發的兩個高峰期。乾癬患者也比較容易合併有乾癬性關節炎、高血脂、代謝症候群、心血管疾病、糖尿病、憂鬱症等。
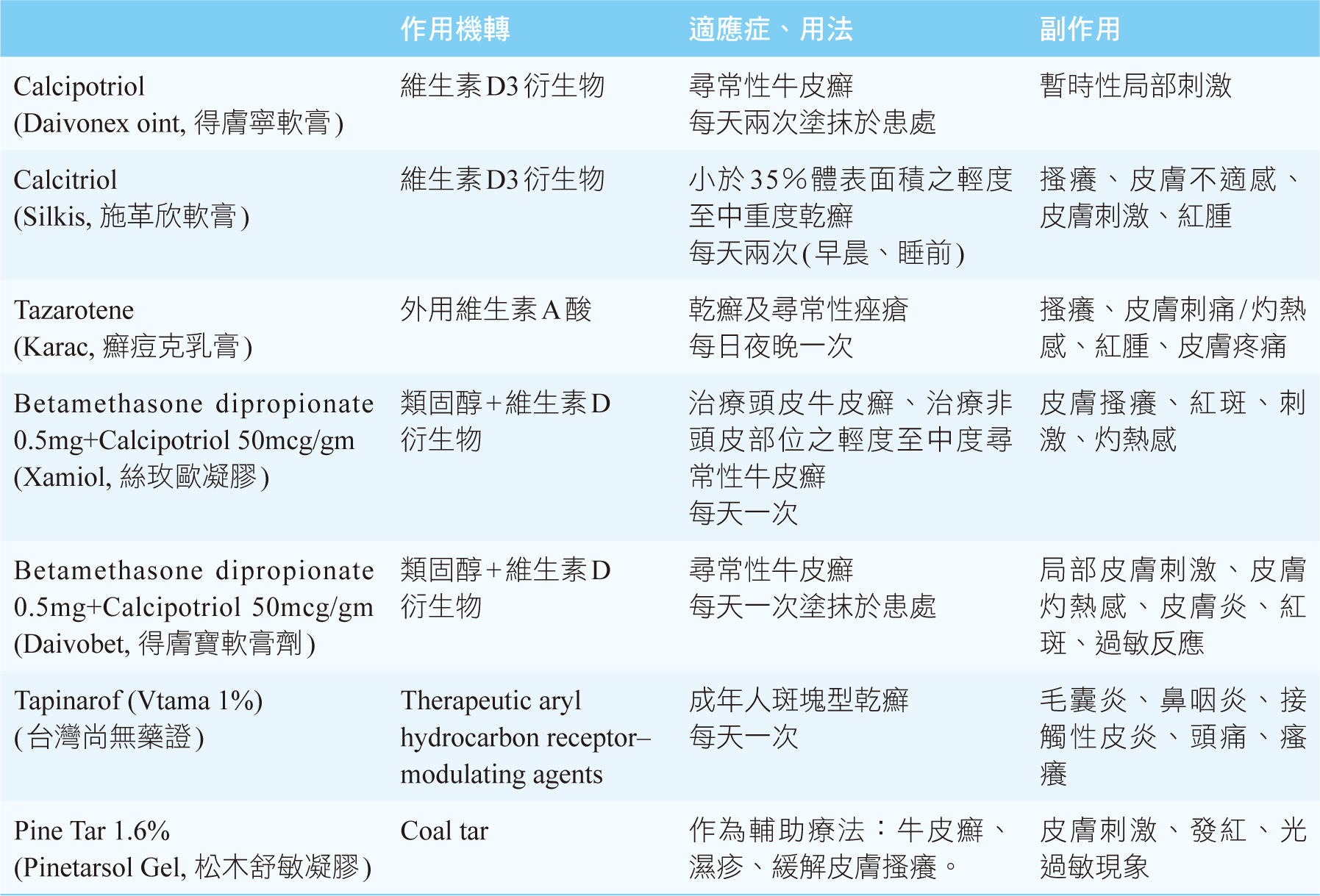
乾癬的治療可分為局部治療(照光或外用藥物)以及全身性治療(全身性照光、口服疾病調節抗風濕藥物和生物製劑)。幾十年來,治療輕度至中度乾癬的主要外用藥物1,2包括局部性皮質類固醇(topical
corticosteroids, TCS)、維生素D衍生物(如calcipotriene,
calcitriol)、維生素A衍生物(如tazarotene)、類固醇複方藥品和焦油(Tar)等(表一)。輔助治療可以使用潤膚劑或尿素等具有保溼功能的藥品,減少乾燥搔癢的問題。這些外用藥物在治療輕度中度乾癬雖然有效,但也有使用上的限制。外用皮質類固醇在持續使用時間、使用位置和使用範圍方面有限制,會造成皮膚萎縮和皮膚感染。維生素D衍生物和外用A酸的皮膚刺激性(skin
irritation)大,很多病人都無法忍受它的刺激性,需要併用類固醇以降低刺激和增加療效。外用藥物在輕度到中度乾癬的治療上有其重要性,需要新的作用機轉和有效的局部治療選擇。Tapinarof是一種芳香烴受體(aryl
hydrocarbon receptor, AhR)調節劑(agonist)3,可誘導抗氧化、免疫調節和表皮分化調節,促進皮膚屏障正常化。美國食品藥物管理局(FDA)於2022年5月23日核准上市,本文將綜述tapinarof的臨床治療資訊。
表一 輕度至中度乾癬的外用藥物2,4
貳、Tapinarof (Vtama cream 1%)
一、適應症和用法劑量3-5
Tapinarof (Vtama
1%)為1%乳膏劑型的外用藥品。美國食品藥物管理局(FDA)核准適應症是用於局部治療成年人斑塊型乾癬(plaque
psoriasis) 3。這是繼類固醇合併維生素D治療組合外,25年來FDA核准的首個非類固醇外用新成分藥物(novel
chemical entities)。除乾癬適應症外,目前也在進行異位性皮膚炎(atopic
dermatitis, AD)的臨床研究。(臨床試驗辨識碼:ADORING 1-NCT
05014568、ADORING 2-NCT 05032859和長期延伸性研究ADORING
3-NCT 05142774) 3。建議劑量每天一次在患部皮膚上均勻塗抹薄薄一層乳膏4,5。可以用於身體所有部位,包括敏感部位,如臉部、皮膚褶皺、頸部、生殖器、肛門癥結、炎症部位和腋窩,但不適用於口服、眼用和陰道內使用。
二、作用機轉3-7
Tapinarof(DMVT-505)2是一種潛在新藥(First-in-Class)的局部治療性芳香烴受體調節劑(therapeutic
aryl hydrocarbon receptor-modulating agent,
TAMA)。有效成分源於土壤線蟲的共生細菌代謝產物中分離純化出來天然化合物,屬低分子量(254
g/mol)的小分子,具抗炎特性(anti-inflammatory
properties),且有良好皮膚滲透性。治療乾癬確切作用機制尚未明確,根據體外和動物研究的證據顯示,tapinarof直接與AhR結合,誘導調節促炎細胞因子,包括白細胞介素17、皮膚屏障蛋白的表達,從而減少皮膚炎症,使皮膚屏障正常化和減少氧化壓力。
三、藥物動力學3-5
局部塗抹tapinarof
1%乳膏後,有效成分會被皮膚吸收,使得血漿濃度低於定量下限(below the
quantifiable limits, BQL)(該檢測的定量極限為50pg/mL)。達到最高血中濃度時間(Tmax)約在使用後2-5小時出現。體外試驗顯示tapinarof在肝臟中通過多種途徑代謝,包括體外氧化(oxidation)、葡萄醣醛酸化(glucuronidation)和硫酸化(sulfation)。重複局部使用未觀察到蓄積現象。在體外血漿蛋白結合試劑顯示tapinarof於血漿與蛋白質的結合率為99%。由於代謝排除階段證據不足,無法確定tapinarof的代謝半衰期。
參、臨床研究及安全性、臨床試驗
FDA依據tapinarof以下綜合性第三期臨床試驗數據(PSOARING 1、PSOARING
2、PSOARING 3)的結果(表二)8,9,核准它的新藥申請(new
drug application, NDA),適用於局部治療成年人斑塊型乾癬。下面將跟大家詳述這些臨床試驗的結果。
一、 PSOARING 1、PSOARING 2臨床試驗
(NCT03956355、NCT03983980)6
PSOARING 1和PSOARING 2是兩項設計相同的tapinarof第三期臨床試驗案(收案時間略有差異),旨在評估tapinarof
1%乳膏外用治療對輕度至重度斑塊型乾癬患者的有效性與安全性。採隨機、雙盲、多中心(美國和加拿大)、安慰劑對照治療試驗,分別篩選了692位及674位,以2:1的方式接受tapinarof
1%乳膏或賦形劑乳膏(vehicle
cream)治療,每天一次,持續12週,塗抹於任何乾癬患部。兩項研究的主要療效指標為比較兩組在第12週時,在醫師整體評估(Physician
Global Assessment, PGA)得分方面,PGA評分為0(清除)或1(幾乎清除),並且從基線下降至少2分。次要療效指標包括(一)乾癬面積暨嚴重度指數(Psoriasis
Area Severity Index, PASI)降幅達75%(PASI 75)的比例,(二)PGA評分為0或1的比例,3.
PASI降幅達90%(PASI 90)的比例。
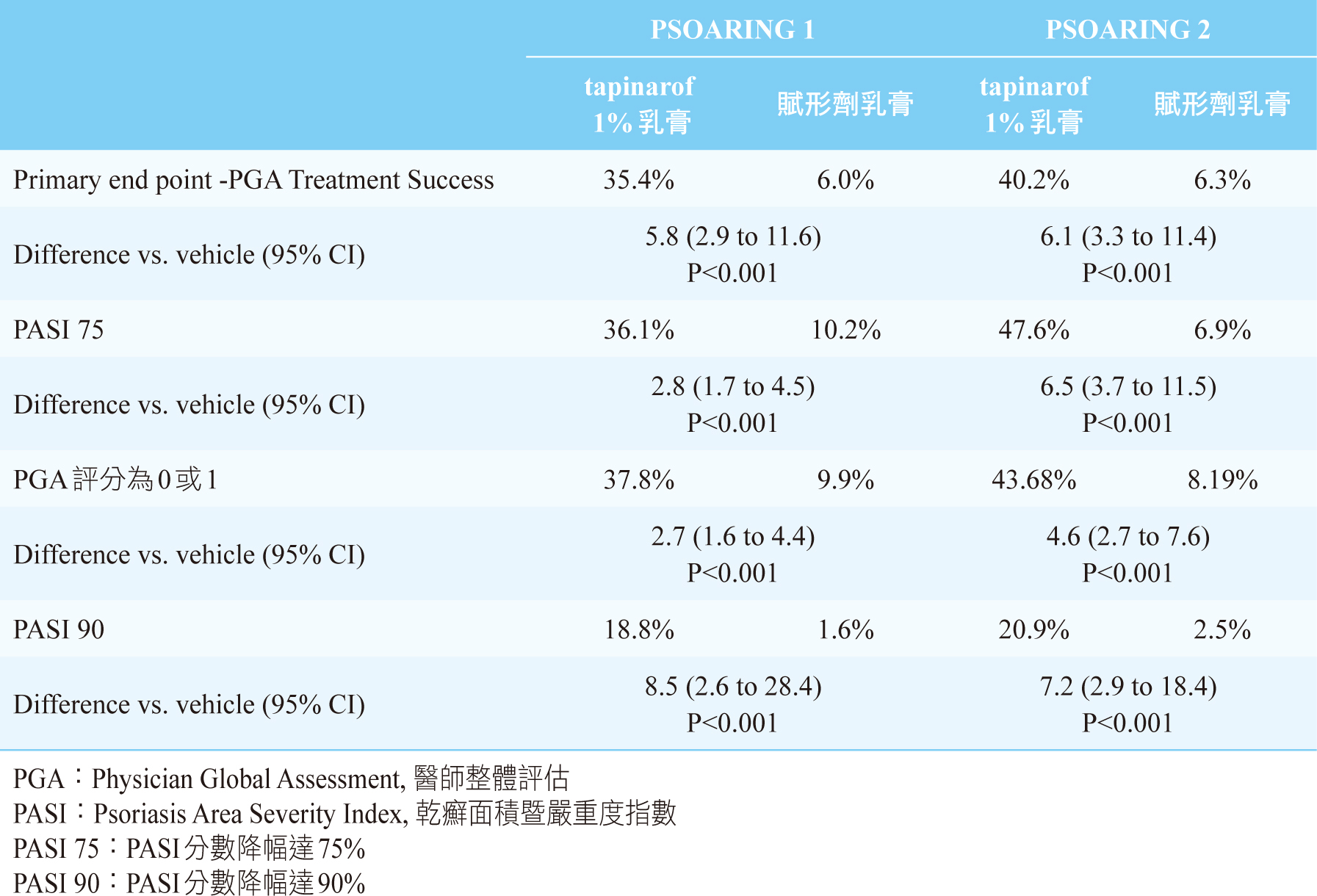
在這兩項研究中,在治療到第12週時,無論是主要療效指標或次要療效指標,tapinarof組在療效方面明顯優於安慰劑組(表二)。PSOARING
1有510位接受了隨機分組,1% tapinarof組有340位和安慰劑170位。結果顯示,tapinarof組與安慰劑組的主要療效指標分別為35.4%和6.0%(95%
CI 2.9-11.6, P<0.001)。在PASI 75反應率則分別是36.1%
和10.2%(95% CI 1.7-4.5, P<0.001)。在PGA評分為0或1的比例分別是37.8%
和9.9%(95% CI 1.6-4.4, P<0.001)。在PASI 90分別是18.8%
和1.6%(95% CI 1.6-28.4, P<0.001)。而PSOARING
2有515位接受了隨機分組,1% tapinarof組有343位和安慰劑172位。結果顯示,tapinarof組與安慰劑組的主要療效指標分別為40.2%和6.3%(95%
CI 3.3-11.4, P<0.001)。在PASI 75反應率則是47.6%
和6.9%(95% CI 3.7-11.5, P<0.001)。在PGA評分為0或1的比例分別是43.68%
和8.19%(95% CI 2.7-7.6, P<0.001)。在PASI
90分別是20.9%和2.5%(95% CI 2.9-18.4, P<0.001)。
安全性方面,在PSOARING
1中,tapinarof組不良事件有171位(50.3%),安慰劑組38位(22.4%)。在PSOARING
2中,tapinarof組不良事件有187位(54.35%),安慰劑組45位(26.2%)。兩項試驗案所呈現出兩組的不良事件大致相似。大部分不良事件都是輕度至中度。毛囊炎(folliculitis)是比例較高的不良事件,在PSOARING
1和PSOARING
2中,tapinarof組毛囊炎發生率分別是23.5%和17.8%,安慰劑組則分別是1.2%和0.6%。其他常見的不良事件是鼻咽炎(nasopharyngitis)、接觸性皮炎(contact
dermatitis)、頭痛(headache)、瘙癢(pruritus)和流感(influenza)。
二、 PSOARING 3臨床試驗 (NCT04053387) 7
PSOARING 3是一項長期、開放標籤(open-label)的延伸性研究,旨在評估tapinarof
1%乳膏用於治療成人斑塊狀銀屑病的安全性和有效性。完成PSOARING 1和PSOARING
2臨床試驗的患者可以參加PSOARING 3 study。為期40週接受tapinarof
1%乳膏治療,之後4週的追蹤。有91.6%(n=763)的患者從PSOARING 1或PSOARING
2接著參加PSOARING 3的患者,總共接受了52週tapinarof乳膏治療。平均年齡為50.7歲,58.7%為男性,參加時PGA基線分布:PGA=0有10.4%;PGA=1有21.1%;PGA=2有32.4.4%;PGA=3有32.6%;PGA=4有3.0%。
結果顯示,40.9%(312/763)的患者在臨床試驗期間達到完全疾病清除(PGA=0)。參加PSOARING
3時,PGA ≥2患者中,有58.2%(302/519)患者有達到PGA=0或1。緩解效應(Remittive
Effect)方面,在試驗期間任何時間,皮膚症狀達到完全清除(PGA=0)後停藥,到第一次惡化(PGA≥2輕度)的時間平均為130.1天。患者滿意度方面,在78.5%(n=599)的完成問卷調查中,有81.7%患者認為tapinarof乳膏比以往的局部治療更有效。有85.8%患者都同意使用tapinarof乳膏治療,可以輕鬆控制乾癬。有86.3%患者對tapinarof乳膏的效果感到滿意。
不良事件方面,與PSOARING 1和PSOARING
2試驗一致,最常見AE的是毛囊炎(22.7%)、接觸性皮炎(5.5%)和上呼吸道感染(4.7%)。
肆、不良反應與注意事項3-5
關於安全性方面,Tapinarof乳膏耐受性普遍良好,大多數不良事件為輕度至中度程度。最常見的不良事件是毛囊炎(毛孔周圍出現紅色凸起的腫塊)、鼻咽炎(鼻子和喉嚨疼痛或腫脹)、接觸性皮炎(皮疹、發紅、脫皮、灼熱或刺痛)、頭痛、瘙癢和流感。在18歲以下兒童患者中的安全性和有效性尚未確定,不建議使用。在體外試驗,tapinarof不抑制CYP2B6、CYP2C8、CYP2C9、CYP2C19、CRP2D6
或CYP3A4/5,也不會誘導CYP1A2、CYP2B6或CYP3A4,因此不易發生交互作用。
伍、總結
乾癬是一種慢性發炎性皮膚病變,由異常的免疫反應引起,對患者的生活產生重大影響。輕度至中度乾癬治療一般是以外用局部治療為主,包含皮質類固醇、維生素D衍生物、維生素A衍生物等外用藥膏。乾癬需要新的和有效的局部治療選擇。Tapinarof是AhR調節劑,是一種非類固醇外用乳膏。臨床研究證明每日一次使用tapinarof
1%乳膏是具有良好的耐受性和有效性,停藥後緩解效果至少4個月。Tapinarof使患者的症狀得到改善並提升生活品質。對於輕度至中度乾癬患者而言,提供臨床治療上另一個選擇。
New Topical Therapies for
Psoriasis-Tapinarof
Chien-Ling Hsieh1, Chun-Nan Wu1,
Chien-Ying Lee1,2, Chun-Pai Hsiao3
1Department of Pharmacy, Chung-Shan
Medical University Hospital
2Department of Pharmacology,
Chung-Shan Medical University
3Department of Pharmacy, Jen-Ai
Hospital, Taichung
Abstract
Psoriasis is a chronic immune-mediated skin
disease with a significant impact on patients’
quality of life. Plaque psoriasis is the most
common variant of psoriasis. The most frequently
prescribed first-line treatment for
mild-to-moderate psoriasis is topical
corticosteroids and vitamin D analogues.
Although existing topical therapies are
efficacious, especially in short-term treatment
of localized disease, some medications in this
class have restrictions relating to duration and
extent of use and application sites. There is a
need for new and effective topical treatment
options for psoriasis. Tapinarof is an aryl
hydrocarbon receptor (AhR) agonist that induces
antioxidant, immunomodulatory and epidermal
differentiation regulation pathways. This review
presents and discusses the current clinical and
scientific evidence pertaining to Tapinarof.
參考資料:
1. Lé AM, Torres T. New Topical Therapies for
Psoriasis. Am J Clin Dermatol. 2022
Jan;23(1):13-24.
2. Bissonnette R, Stein Gold L, Rubenstein DS,
et al. Tapinarof in the treatment of psoriasis:
A review of the unique mechanism of action of a
novel therapeutic aryl hydrocarbon
receptor-modulating agent. J Am Acad Dermatol.
2021 Apr;84(4):1059-1067.
3. Keam SJ. Tapinarof Cream 1%: First Approval.
Drugs. 2022 Aug 8. doi:
10.1007/s40265-022-01748-6..
4. IBM Micromedex® DRUGDEX®(electronic
version).
5. Product Information:Vtama®
6. Lebwohl MG, Stein Gold L, Strober B, et al.
Phase 3 Trials of Tapinarof Cream for Plaque
Psoriasis. N Engl J Med. 2021 Dec
9;385(24):2219-2229.
7. Strober B, Stein Gold L, Bissonnette R, et
al. One-Year Safety and Efficacy of Tapinarof
Cream for the Treatment of Plaque Psoriasis:
Results from the PSOARING 3 Trial. J Am Acad
Dermatol. 2022 Jun 27:S0190-9622(22)02219-8.