針對呼吸道融合病毒的新型單株抗體-
Nirsevimab之探討
陳喬羚1、王建贏2、林依儂1、吳淑娟1
1臺北市立聯合醫院藥劑部、2新北市立聯合醫院藥劑科
摘要
本文回顧了nirsevimab,一種針對呼吸道融合病毒(respiratory
syncytial virus,
RSV)的單株抗體相關臨床文獻。Nirsevimab是一種重組人類IgG1
kappa單株抗體,能與RSV的F蛋白結合,從而阻止病毒融合和感染。該藥物在預防RSV相關併發症方面表現了很大的潛力。Nirsevimab已經在歐盟和英國獲得批准,用於預防新生兒和嬰兒首次RSV季節期間發生的RSV下呼吸道疾病。相較於現有的palivizumab,nirsevimab具有更高的親和力和中和活性,經過Fc區域改造後半衰期延長,使單次給藥可維持五個月的保護力。兩個主要的臨床試驗D5290C00003和MELODY顯示nirsevimab在預防RSV下呼吸道感染方面具有顯著療效,相對風險降低了79.5%。Nirsevimab在試驗中安全性良好,副作用發生率與安慰劑及Palivizumab相當,也未發生被認為與nirsevimab有關的嚴重不良反應。Nirsevimab有望成為減少全球RSV相關疾病和死亡的重要藥物。然而,在廣泛應用前,仍需進一步研究抗藥性、成本效益、與其他預防策略的比較以及不同族群的適應性。
關鍵字: 呼吸道融合病毒、RSV、Nirsevimab、單株抗體
壹、 背景
呼吸道融合病毒(respiratory syncytial virus,
RSV)是一種屬於副黏液病毒科(Paramyxoviridae)的單股負鍊核糖核酸病毒1,其存在兩個亞型:A亞型及B亞型,兩者均在全球廣泛流行。然而,它們在不同地區和時間具有一定的季節性和地域性差異,例如於溫帶地區較常見於冬季至早春,呈現季節性的流行,而位於亞熱帶地區的台灣,病例則全年可見1。RSV具有極強的傳染力,主要通過飛沫、直接接觸和空氣進行傳播,且自1956年被首次描述以來,RSV感染成為了嬰幼兒和免疫功能低下成人住院及死亡的主要原因2。嬰幼兒在2歲前極易感染RSV,部分兒童在同一個流行季節內甚至可能多次感染,進而引起上呼吸道疾病(如流感樣症狀)、下呼吸道感染(lower
respiratory tract infection, LRTI),如支氣管炎、肺炎,嚴重甚至可能引發呼吸衰竭或腦膜炎等併發症。每年全球有超過3,300萬例5歲以下兒童,因RSV感染而導致急性LRTI3。對於某些高危險族群,如早產兒、先天性心臟病患者、支氣管肺發育不良兒童和免疫功能低下者,RSV感染可能導致更嚴重的後果4。
目前,對於RSV感染的治療主要依賴支持性療法,如維持呼吸道通暢和水分平衡,而截至今日仍未有安全有效的
RSV 疫苗被核准使用。對於高危嬰幼兒,使用RSV免疫球蛋白,如palivizumab進行被動免疫預防是一種選擇,其對於預防嚴重的RSV
LRTI具有療效,然而其適應症限制用於早產兒或存在特定心肺合併症的嬰兒,又由於半衰期較短(20天)而需在RSV季節期間分五次每月施用,上述原因均使其使用受到限制,並未普及至所有兒童5。
貳、作用機制
Nirsevimab是一種重組人類IgG1 kappa單株抗體(monoclonal
antibodies, mAbs),主要針對RSV的F蛋白,其作用機制與其他針對RSV F蛋白的mAbs類似,但具有更高的親和力和中和活性6。RSV
F蛋白是一種病毒表面糖蛋白,對於病毒的入侵過程具有關鍵作用。F蛋白在病毒感染過程中負責融合病毒膜與宿主細胞膜,進而將病毒基因物質注入宿主細胞內,最終導致宿主細胞感染7。F蛋白以三聚體形式存在,具有兩個主要的構象態,包含預融合態F蛋白
(prefusion F protein, Pre-F)及後融合態F蛋白(postfusion
F protein,
Post-F),其中預融合態F蛋白具有較高的免疫原性,是病毒感染過程中的關鍵靶點8。Nirsevimab通過與預融合態F蛋白結合,阻止F蛋白的變態過程,從而抑制病毒的融合和感染9。在預融合和後融合構象中,已經確定了六個抗原位點(Ø
和 I 至 V)。抗原位點Ø(nirsevimab所結合的抗原位點)和V只出現在預融合態,而抗原位點I、II(palivizumab所結合的抗原位點)、III和IV則在預融合態和後融合態皆存在10,11。Nirsevimab能有效結合到F蛋白的高度保守區域,體外試驗顯示出對RSV
A亞型和B亞型具有良好的親和力和中和活性(nirsevimab對RSV A和RSV B的KD值分別為0.12
nM和1.22 nM;中位IC50值分別為3.1 ng/mL和3.0 ng/mL)
10,11。相較於已在臨床應用的palivizumab,nirsevimab具有以下優勢,首先,nirsevimab對RSV的親和力和中和活性顯著高於palivizumab,這意味著nirsevimab可能具有更強的抗RSV效果。其次,nirsevimab在Fc區域進行了三個氨基酸置換
[M252Y/S254T/T256E (YTE)],以延長半衰期,這使得它在單次給藥後能維持較長時間的抗病毒作用,為嬰幼兒提供整個呼吸道感染季節的保護12。
Nirsevimab以單劑量(50 mg或100
mg)、預填注射器的形式給予,需儲存在2℃至8℃,架儲期為15個月,可在室溫(20℃至25℃)下保存最多
8 小時13。Nirsevimab應在RSV季節開始前或RSV季節出生的嬰兒,通過肌肉注射給予。建議劑量是根據嬰兒體重分為兩種,第一是體重<5kg的嬰兒應給予單次50mg;第二則是體重≥5kg的嬰兒單次給予100mg,而對於接受心臟手術且使用體外循環的嬰兒,可能需要在手術後給予額外劑量13。此外,Nirsevimab可與兒童疫苗同時給予,並在臨床試驗中顯示出與單獨接種疫苗相似的安全性和反應性13。
參、 臨床療效
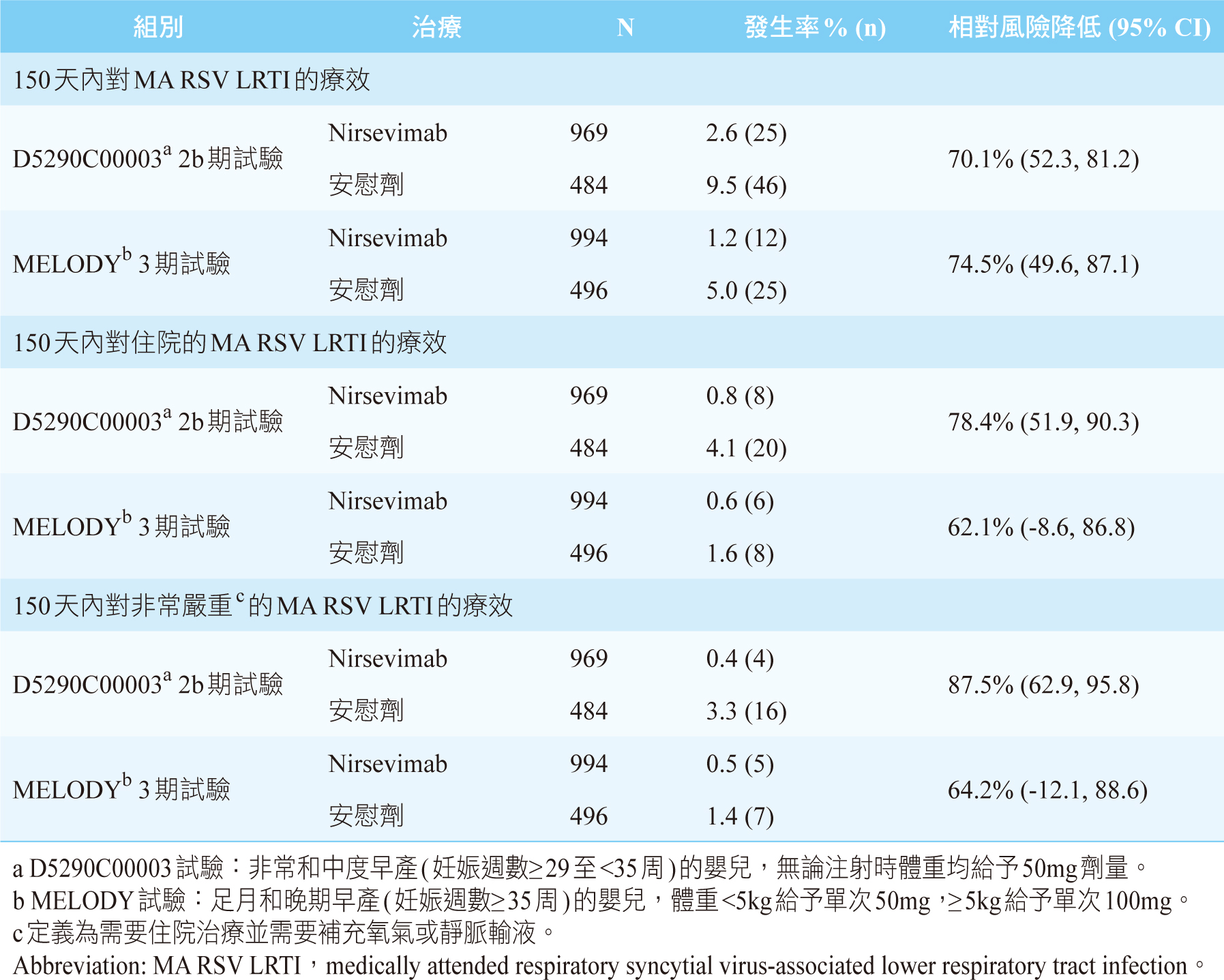
目前nirsevimab在預防健康早產嬰兒和足月嬰兒的RSV LRTI方面的療效,已在第2b期D5290C000035和第3期MELODY14臨床試驗中獲得證實。
在D5290C00003試驗中,共有1,453名符合條件的健康嬰兒參與,包括早產嬰兒孕齡(gestational
age, GA)
≥29週至<35週和年齡≤1歲的足月嬰兒。這些嬰兒依2:1的比例在RSV季節之前接受了一次50mg的肌肉內注射nirsevimab或安慰劑。主要終點是給藥後150天內medically
attended RSV-associated lower respiratory tract
infection (MA RSV LRTI)發生率,次要終點是給藥後150天內由於RSV
LRTI導致的住院率5。試驗結果請見表一。
表一 D5290C00003和MELODY試驗,Nirsevimab與安慰劑在150天內的療效5,14
在MELODY試驗中,共有1,490名符合條件的健康嬰兒參與,包括晚期早產嬰兒GA≥35週和年齡≤1歲的足月嬰兒。這些嬰兒依2:1的比例接受了一次肌肉注射nirsevimab(體重<5kg:50
mg或體重≥5kg:100mg)或安慰劑。主要終點及次要終點同D5290C00003試驗14。試驗結果請見表一。
上述兩項研究均顯示nirsevimab相較於安慰劑對預防RSV LRTI有卓越的療效,而兩項研究之合併分析顯示15,nirsevimab對於MA
RSV LRTI發生率(nirsevimab:安慰劑;1%:
6%)的相對風險降低(relative risk reduction,RRR)為79.5%(95%
CI:65.9-87.7)。對於因RSV LRTI而入院的終點(nirsevimab:安慰劑;1%:3%)和非常嚴重(定義為需要住院治療並需要補充氧氣或靜脈輸液)的RSV
LRTI(nirsevimab:安慰劑;<1%:2%),nirsevimab的RRR分別為77.3%(95%
CI:50.3-89.7)和86.0%(95% CI:62.5-94.8)。
此外,在一項2/3期的隨機、雙盲、由palivizumab為對照組的MEDLEY試驗16,主要評估nirsevimab在先天性心臟病和/或早產兒慢性肺病的嬰兒中的安全性和耐受性。該試驗顯示,給藥後第151天nirsevimab的血清濃度與MELODY及D5290C00003試驗合併分析中的濃度相當,表明nirsevimab在此族群可能與健康的足月和早產嬰兒具有相似的保護作用15。
肆、 安全性
在臨床試驗中,嬰兒對nirsevimab的耐受性良好,常見的不良反應包括皮疹、發熱和注射部位反應,但均為罕見(0.1%-1%)13。
在健康早產和足月嬰兒的試驗中(MELODY和D5290C00003),nirsevimab和安慰劑組的參與者中很少有人出現與試驗相關的不良反應,發生率分別為1.0%:1.4%
14和2.3%:2.1% 5,14。在MEDLEY研究中,對918名高風險發生嚴重RSV
LRTI的嬰兒進行了安全性評估,包括196名極早產嬰兒(GA
<29周)、306名患有早產兒慢性肺病或血流動力學顯著的先天性心臟病的嬰兒,結果顯示,nirsevimab與對照組藥物palivizumab具有相似的安全性表現,並且與D5290C00003及MELODY試驗相似。
此外,mAbs的使用可能誘導抗藥抗體(antidrug antibody,
ADA)的形成,從而導致免疫複合物疾病(immune complex disease)或改變mAbs的藥物代謝動力學和藥效學性質。在上述三個試驗中5,14,16,檢測到ADA的比率如下:MELODY試驗第361天,nirsevimab組6.1%,安慰劑組1.1%;D5290C00003試驗第361天,nirsevimab組5.6%,安慰劑組3.8%;MEDLEY試驗第151天,nirsevimab組0.4%,palivizumab組3.6%。
伍、 總結
Nirsevimab基於上述試驗的結果已於2022年11月3日在歐盟獲批上市,並於2022年11月7日在英國獲批上市,用於預防新生兒和嬰兒首次RSV季節期間發生的RSV
LRTI11。美國食品藥物管理局於2023年1月5日也已接受nirsevimab的生物製劑申請許可Biologics
License Application (BLA)審查。然而,雖然nirsevimab在這些臨床試驗中表現出了很高的預防效果,但在將其用於更廣泛的人群之前,仍需要考慮和關注一些問題:
一、抗藥性
隨著nirsevimab在人群中的應用,應密切關注RSV對該藥物的抗藥性發展,以確保繼續保持其預防效果。
二、成本效益
nirsevimab預防RSV的成本效益需要進一步評估,以確保在全球各地的高風險嬰兒中獲得最大的公共衛生效益。
三、與開發中的其他預防性策略比較
由於有多個針對孕婦的疫苗正處於後期開發階段,需要確定nirsevimab與母親接種疫苗之間的相對有效性和可負擔性。
四、不同族群的適應性
需進一步研究nirsevimab在不同年齡、種族和地理位置的族群中的適應性和效果。
總結來說,nirsevimab在預防RSV相關併發症方面表現了很大的潛力,但在廣泛應用之前,仍需對上述問題進行深入研究和關注。隨著更多的研究和數據的收集,nirsevimab可能成為一種重要的藥物,幫助減少全球RSV相關的嚴重疾病和死亡。
Nirsevimab: A New Monoclonal
Antibody Targeting Respiratory Syncytial Virus
Chiao-Ling Chen1, Jian-Ying Wang2,
Yi-Nung Lin1, Shu-Chuan Wu1
1Department of Pharmacy, Taipei City
Hospital
2Department of Pharmacy, New Taipei
City Hospital
Abstract
This article reviews the literature on
Nirsevimab, a monoclonal antibody targeting
respiratory syncytial virus (RSV). Nirsevimab is
a recombinant human IgG1 kappa monoclonal
antibody that binds to RSV F protein, thereby
inhibiting viral fusion and infection. The drug
has shown great potential in preventing
RSV-related complications. Nirsevimab has been
approved in the European Union and the United
Kingdom for preventing RSV lower respiratory
tract diseases in newborns and infants during
their first RSV season. Compared to the existing
Palivizumab, Nirsevimab exhibits higher affinity
and neutralizing activity, and its half-life has
been extended through Fc region modification,
allowing a single dose to provide protection for
up to five months. Two major clinical trials,
D5290C00003 and MELODY, demonstrated significant
therapeutic effects of Nirsevimab in preventing
RSV lower respiratory tract infections, with a
relative risk reduction of 79.5%. Nirsevimab
showed good safety in trials, with an incidence
of side effects comparable to placebo and
Palivizumab, and no serious adverse reactions
attributed to Nirsevimab. Nirsevimab is expected
to become an important tool for reducing global
RSV-related morbidity and mortality. However,
before widespread use, further research is
needed on drug resistance, cost-effectiveness,
comparison with other preventive strategies, and
adaptability in different populations.
參考資料:
1.
衛生福利部疾病管制署:長期照護機構呼吸道融合病毒(RSV)感染管制指引。臺北:疾病管制署,2015。
2. Nair H, Nokes DJ, Gessner BD, et al: Global
burden of acute lower respiratory infections due
to respiratory syncytial virus in young
children: a systematic review and meta-analysis.
Lancet, 2010. 375(9725): p. 1545-55.
3. Shi T, McAllister DA, O'Brien KL, et al:
Global, regional, and national disease burden
estimates of acute lower respiratory infections
due to respiratory syncytial virus in young
children in 2015: a systematic review and
modelling study. Lancet, 2017. 390(10098): p.
946-958.
4. Mejías A, Ramilo O: Review of palivizumab in
the prophylaxis of respiratory syncytial virus
(RSV) in high-risk infants. Biologics, 2008.
2(3): p. 433-9.
5. Griffin MP, Yuan Y, Takas T, et al:
Single-Dose Nirsevimab for Prevention of RSV in
Preterm Infants. N Engl J Med, 2020. 383(5): p.
415-425.
6. Corti D, Bianchi S, Vanzetta F, et al:
Cross-neutralization of four paramyxoviruses by
a human monoclonal antibody. Nature, 2013.
501(7467): p. 439-43.
7. McLellan JS, Chen M, Leung S, et al:
Structure of RSV fusion glycoprotein trimer
bound to a prefusion-specific neutralizing
antibody. Science, 2013. 340(6136): p. 1113-7.
8. Krarup A, Truan D, Furmanova-Hollenstein P,
et al: A highly stable prefusion RSV F vaccine
derived from structural analysis of the fusion
mechanism. Nat Commun, 2015. 6: p. 8143.
9. Battles MB, McLellan JS: Respiratory
syncytial virus entry and how to block it. Nat
Rev Microbiol, 2019. 17(4): p. 233-245.
10. Jorgensen SCJ: Nirsevimab: review of
pharmacology, antiviral activity and emerging
clinical experience for respiratory syncytial
virus infection in infants. J Antimicrob
Chemother, 2023.
11. Keam SJ: Nirsevimab: First Approval. Drugs,
2023. 83(2): p. 181-187.
12. Domachowske JB, Khan AA, Esser MT, et al:
Safety, Tolerability and Pharmacokinetics of
D5290C00003, an Extended Half-life Single-dose
Respiratory Syncytial Virus Prefusion
F-targeting Monoclonal Antibody Administered as
a Single Dose to Healthy Preterm Infants.
Pediatr Infect Dis J, 2018. 37(9): p. 886-892.
13. European Medicines Agency: Beyfortus, INN-nirsevimab.
Product-information, 2022.
14. Hammitt LL, Dagan R, Yuan Y, et al:
Nirsevimab for Prevention of RSV in Healthy
Late-Preterm and Term Infants. N Engl J Med,
2022. 386(9): p. 837-846.
15. Simões EAF, Madhi SA, Muller WJ, et al:
Efficacy of nirsevimab against respiratory
syncytial virus lower respiratory tract
infections in preterm and term infants, and
pharmacokinetic extrapolation to infants with
congenital heart disease and chronic lung
disease: a pooled analysis of randomised
controlled trials. Lancet Child Adolesc Health,
2023. 7(3): p. 180-189.
16. Domachowske J, Madhi SA, Simões EAF, et al:
Safety of Nirsevimab for RSV in Infants with
Heart or Lung Disease or Prematurity. N Engl J
Med, 2022. 386(9): p. 892-894.